梅毒螺旋体膜蛋白Tpp47对血管内皮细胞黏附功能影响的实验研究
2014-12-04张瑞丽王千秋
张瑞丽 王千秋
·论著·
梅毒螺旋体膜蛋白Tpp47对血管内皮细胞黏附功能影响的实验研究
张瑞丽 王千秋
目的探讨梅毒螺旋体膜蛋白Tpp47对血管内皮细胞的作用。方法利用基因工程技术重组合成的梅毒螺旋体膜蛋白Tpp47及脂多糖分别刺激人脐静脉内皮细胞(HUVEC),ELISA检测上清中细胞间黏附分子1(ICAM-1)及E选择素的水平;荧光定量PCR检测HUVEC中ICAM-1及E选择素mRNA的转录水平;MTT法检测HUVEC增殖水平;将重组蛋白Tpp47及脂多糖预处理的HUVEC与钙黄绿素AM标记的THP-1细胞共培养,荧光倒置显微镜下观察HUVEC与THP-1细胞的黏附情况。结果梅毒螺旋体膜重组蛋白Tpp47刺激HUVEC后,其分泌的黏附分子ICAM-1(1.28±0.03)及E选择素(0.51±0.01)水平显著提高,与空白对照组(0.90±0.01与0.13±0.03)比较,差异均有统计学意义(t值分别为18.28和18.19,均P<0.05);将重组蛋白Tpp47刺激24 h后的HUVEC与THP-1细胞共培养,HUVEC与THP-1细胞的黏附率为56.1%±1.9%,较空白对照组(16.3%±2.1%)明显提高,差异有统计学意义(χ2=12.65,P<0.05)。MTT试验结果显示,重组蛋白Tpp47刺激HUVEC后,其增殖率(19.5%±1.7%)高于空白对照组(10.0%±3.1%),差异有统计学意义(χ2=3.92,P<0.05);较脂多糖低(41.2% ±3.7%),差异有统计学意义(χ2=10.42,P<0.05)。结论梅毒螺旋体膜重组蛋白Tpp47可体外上调HUVEC与THP-1的黏附能力及促进HUVEC增殖,可能在梅毒的发病中起一定作用。
密螺旋体,苍白;细胞黏附分子;E选择素;Tpp47;人脐静脉内皮细胞;THP-1细胞
梅毒是由梅毒螺旋体(Treponema pallidum,Tp)所致的性传播疾病。目前梅毒在世界范围内传播,已成为危害人类健康的公共卫生问题。而Tp与HIV的协同作用使艾滋病的发病机制研究及治疗措施更加复杂[1-2],亦致梅毒发病机制的研究再次成为研究热点。Tp至今未能在体外培养成功,阻碍了梅毒发病机制的深入研究。Tp膜蛋白是螺旋体早期与机体黏附及诱导机体免疫的主要靶点,也是研究梅毒致病机制及机体免疫反应的重要对象[3]。多项研究显示,Tp侵袭血管内皮细胞,可以促进内皮细胞活化,释放炎症介质和炎症细胞的趋化,导致内皮细胞肿胀及局部炎症反应的发生[4-6]。Tp膜蛋白Tpp47是螺旋体的主要抗原成分,在激活单核/巨噬细胞中起着关键作用[7]。本课题以人脐静脉内皮细胞(HUVEC)为实验细胞,观察重组合成的膜蛋白Tpp47对HUVEC黏附功能的影响,研究膜蛋白Tpp47在血管内皮细胞活化中的作用。
材料与方法
一、试剂和仪器
1.主要试剂:原代培养的HUVEC由第三军医大学全军胸外中心赠送,THP-1细胞株(单核巨噬细胞)为本实验室保存,重组蛋白Tpp47由深圳市菲鹏生物股份有限公司赠送,已去除内毒素,纯度>90%,DMEM培养基、RPMI1640培养基、EDTA-胰酶消化液及Hyclone胎牛血清(FBS)为美国Gibco公司产品,荧光染料钙黄绿素AM(Calcein AM)、脂多糖、MTT为美国Sigma公司产品,细胞间黏附分子1(ICAM-1)及E选择素的ELISA检测试剂盒、第一链cDNA合成试剂盒为美国BBI公司产品,Trizol试剂为美国Invitrogen公司产品,SybrGreen PCR Master Mix Kit为美国ABI公司产品。
2.主要仪器:荧光显微镜及EX70倒置显微镜产自日本Olympus公司,分光光度仪产自美国Beckman Coulter公司,高速离心机及多功能酶标仪产自美国Thermo Scientific公司,ABI Stepone plus型荧光定量PCR仪产自美国ABI公司。
二、方法
1.细胞培养:HUVEC培养于含10%胎牛血清的DMEM培养基(含0.05%青霉素-链霉素双抗),THP-1细胞培养于含10%胎牛血清的RPMI1640培养基(含0.05%青霉素-链霉素双抗),均置于37℃、5%CO2孵箱中培养,选取状态良好的细胞进行实验。
2.重组蛋白Tpp47刺激HUVEC:将5×104个HUVEC接种于96孔细胞培养板,37℃、5%CO2培养箱培养24 h,换新鲜培养基(不含青霉素-链霉素双抗),分组分别加入重组蛋白Tpp47或脂多糖,使终浓度分别为 50、100、200、400、800 μg/L, 以不加重组蛋白Tpp47或脂多糖的孔做为空白对照,每次设3个复孔,37℃、5%CO2培养箱分别培养3、6、12、24、48 h。取培养上清液,-20℃冻存。磷酸盐缓冲液(PBS)清洗细胞3次,胰蛋白酶-EDTA消化液消化细胞,加入细胞冻存液,-80℃冻存。
3.细胞因子分泌水平检测:ELISA检测试剂盒检测重组蛋白Tpp47或脂多糖刺激HUVEC后培养上清液中的黏附分子ICAM-1及E选择素的水平。具体步骤按ELISA检测试剂盒说明书操作。
4.实时荧光定量PCR法检测细胞因子转录水平:提取各组HUVEC总RNA,电泳检测提取的RNA,将RNA置-20℃保存备用;按cDNA合成试剂盒合成第一链,将标本置-20℃保存。引物序列采用Primer Premier 5.0软件设计,由上海生工生物工程技术服务有限公司合成。引物序列如下:GAPDH正向:5′-TGGGTGTGAACCATGAGAAGT-3′,反向:5′-TGAGTCCTTCCACGATACCAA-3′, 扩增后目标片段长度为126 bp。ICAM-1正向:5′-GGTAGCAG CCGCAGTCATAAT-3′,反向:5′-GGCTTGTGTGTTC GGTTTCAT-3′, 扩增后目标片段长度为130 bp。E选择素正向:5′-TCTGGGGAACTAGAGGGATACA-3′,反向:5′-TCTATTGAAGTGGTGATGGGTGT-3′,扩增后目标片段长度为131 bp。荧光定量PCR:GAPDH作为内参照,PCR反应体系:ddH2O 7 μl,2×Sybr Mix 10 μl,上下游引物各 1 μl,标本 cDNA 模板 1 μl。反应条件为:95℃2 min;95℃10 s,60℃15 s,72℃30 s,40个循环;72 ℃ 10 min;95 ℃ 15 s。取 10 μl扩增产物进行2%琼脂糖凝胶电泳。
5.HUVEC与THP-1细胞的黏附实验:将5×104个HUVEC接种于96孔细胞培养板上,37℃、5%CO2培养箱培养24 h,换新鲜培养基,分别加入重组蛋白Tpp47或脂多糖,使终浓度分别为400 μg/L和200 μg/L,以不加重组蛋白Tpp47或脂多糖的孔做为空白对照,每孔设3个复孔,37℃、5%CO2培养箱培养24 h,加入Calcein AM(5 μmol/L)标记的THP-1细胞1×105个,37℃、5%CO2培养箱培养6 h,PBS洗去未黏附的THP-1细胞,荧光显微镜下计数未黏附的THP-1细胞,按公式THP-1细胞的黏附率=(加入总THP-1细胞数-未黏附THP-1细胞数)/加入总THP-1细胞数×100%,计算THP-1细胞的黏附率。
6.HUVEC增殖实验:将5×104个HUVEC接种于96孔细胞培养板,37℃、5%CO2培养箱培养24 h,换新鲜培养基,加入重组蛋白Tpp47或脂多糖,使终浓度分别为400 μg/L和200 μg/L,以不加重组蛋白Tpp47或脂多糖的孔为空白对照,每次设3个复孔,37℃、5%CO2培养箱培养24 h。弃上清,PBS洗2次,加入20 μl MTT(终浓度为5 g/L),37℃、5%CO2培养箱培养4 h,弃上清,加入150 μl二甲基亚砜,振荡混匀,以未接种细胞,只加培养基、MTT和二甲基亚砜的孔作为调零孔,酶联免疫检测仪上测定各孔490 nm波长处A值。
7.统计分析:实验结果采用SPSS 16.0统计软件进行数据分析,计量数据采用±s,组间比较采用两样本均数t检验,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
结 果
一、重组蛋白Tpp47刺激HUVEC后ICAM-1及E选择素的分泌水平
ELISA检测结果显示,重组蛋白Tpp47在400μg/L浓度,两种黏附分子的分泌水平均达顶峰(图1),ICAM-1及E选择素的分泌达峰值时间分别为24 h和12 h(图2)。脂多糖分别在200 μg/L和800 μg/L浓度ICAM-1及E选择素的分泌达峰值(图3),所需时间分别为6 h和12 h(图4)。经两样本t检验,重组蛋白Tpp47(ICAM-1为400 μg/L 24 h,E选择素为 400 μg/L 12 h)或脂多糖(ICAM-1 为 200 μg/L 6 h,E选择素为800 μg/L 12 h)刺激HUVEC分泌两种黏附分子的最大值,与空白对照组比较,差异均有统计学意义(表1)。
二、重组蛋白Tpp47刺激HUVEC后ICAM-1及E选择素mRNA的转录水平
重组蛋白Tpp47在400 μg/L浓度,两种黏附分子mRNA转录水平均达顶峰(图5),ICAM-1及E选择素的mRNA转录达峰值所需时间分别为24 h和12 h(图6);脂多糖分别在200 μg/L和800 μg/L浓度(图7),所需时间分别为6 h和12 h(图8),ICAM-1及E选择素的mRNA转录达峰值。经两样本t检验,重组蛋白Tpp47(ICAM-1为400 μg/L 24 h,E选择素为400 μg/L 12 h)或脂多糖(ICAM-1为200 μg/L 6 h,E 选择素为 800 μg/L 12 h) 刺激HUVEC后两种黏附分子mRNA的转录水平的2-ΔΔCt值,与空白对照组比较,差异均有统计学意义(表1)。
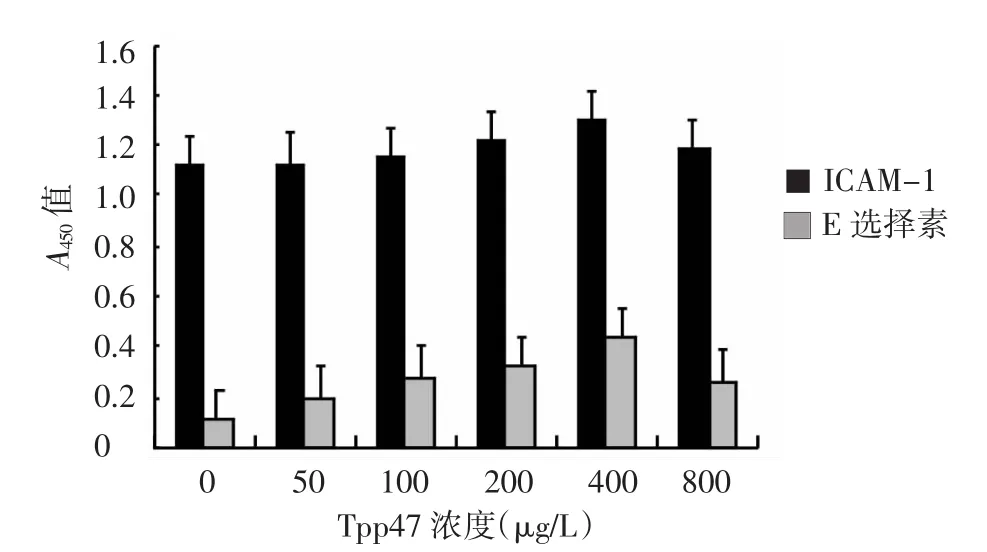
图1 不同浓度重组蛋白Tpp47刺激对人脐静脉内皮细胞24 h时的ICAM-1及E选择素分泌水平

图2 400 μg/L重组蛋白Tpp47刺激对人脐静脉内皮细胞后不同时间点ICAM-1及E选择素分泌水平

图3 不同浓度脂多糖刺激对人脐静脉内皮细胞6 h时的ICAM-1及E选择素分泌水平
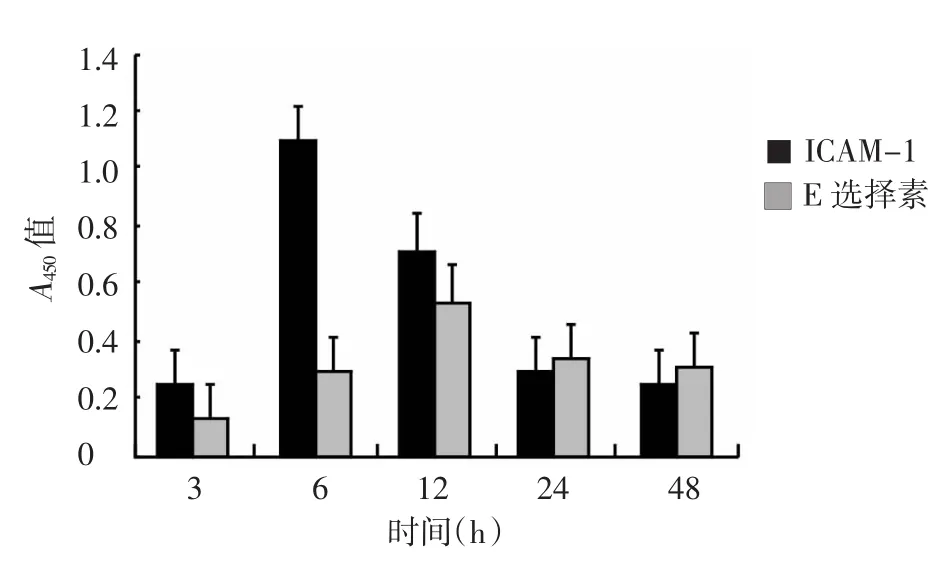
图4 200 μg/L脂多糖刺激对人脐静脉内皮细胞后不同时间点ICAM-1及E选择素分泌水平

表1 重组蛋白Tpp47对人脐静脉内皮细胞分泌细胞间黏附分子1、E选择素及其mRNA转录水平的影响(自由度=4)

图5 不同浓度重组蛋白Tpp47刺激人脐静脉内皮细胞24 h时的ICAM-1及E选择素mRNA的转录水平
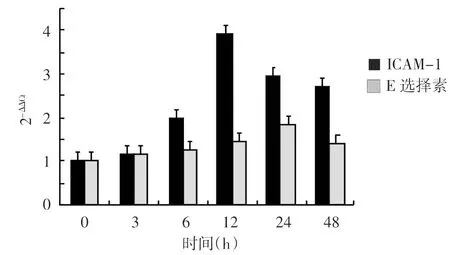
图6 400 μg/L重组蛋白Tpp47刺激人脐静脉内皮细胞后不同时间点ICAM-1及E选择素mRNA的转录水平
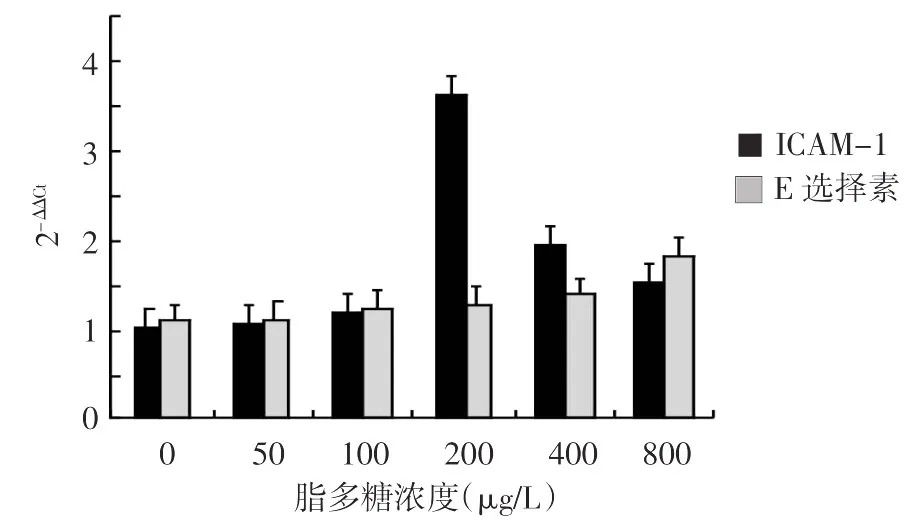
图7 不同浓度脂多糖刺激人脐静脉内皮细胞6 h时的ICAM-1及E选择素mRNA的转录水平

图8 200 μg/L脂多糖刺激人脐静脉内皮细胞后不同时间点ICAM-1及E选择素mRNA的转录水平
三、重组蛋白Tpp47对HUVEC与THP-1细胞黏附的影响
重组蛋白Tpp47刺激HUVEC后,HUVEC与THP-1细胞的黏附率显著增加,为56.1% ± 1.9%,明显高于空白对照组(16.3% ±2.1%),经χ2检验,差异有统计学意义(χ12=12.65,P1<0.05),但与脂多糖组(51.4%±2.7%)比较,差异无统计学意义(χ22=0.54,P2> 0.05)。
四、重组蛋白Tpp47对HUVEC增殖的影响
重组蛋白Tpp47或脂多糖刺激后,HUVEC增殖率(分别为19.5%±1.7%和41.2%±3.7%)增加,分别与空白对照组(10.0%±3.1%)比较,差异均有统计学意义(χ2值分别为3.92和25.29,均P<0.05),但重组蛋白Tpp47组HUVEC增殖率较脂多糖组低,差异有统计学意义(χ2=10.42,P<0.05)。
讨 论
梅毒的主要组织病理特征为血管内皮细胞肿胀,增生,浆细胞、淋巴细胞等炎症细胞浸润,进而导致血管栓塞,这些特征在胎传梅毒、心血管梅毒及神经梅毒中更为明显,阐明此血管病理机制对于阐明梅毒的免疫学机制具有重要的意义。
Tp外膜不含有与革兰阴性细菌引起前炎症反应相同的脂多糖,但含有丰富的脂蛋白。Tp脂蛋白由Tp基因编码,随着基因工程技术的发展及Tp全基因序列的揭示,人工合成了一系列膜蛋白,且发现人工合成或重组表达的膜蛋白与自然来源的Tp膜蛋白生物学特性基本相同[8]。对多种膜蛋白的研究结果显示,Tp膜蛋白可激活炎症细胞,释放炎性介质、细胞因子,造成组织损伤或诱导宿主细胞凋亡,为主要的炎症激动剂,且能诱发T细胞增殖,是介导宿主黏附和免疫的主要靶点[9]。其中Tpp47脂蛋白是免疫原性及免疫反应性均较强的膜蛋白,其基因长度为1 302 bp,编码的蛋白相对分子质量为47 645。Tpp47脂蛋白目前作为单一或与其他抗原联合应用于梅毒的血清学诊断,其特异性可达95%和敏感性可达82%[10]。Tpp47是一种青霉素结合蛋白,青霉素竞争性抑制Tpp47的氨基酸序列中的PBP位点,从而杀灭Tp[11]。
本研究选用HUVEC作为实验细胞,观察重组蛋白Tpp47对内皮细胞黏附功能的影响。实验结果显示,重组合成的膜蛋白Tpp47可以显著提高HUVEC分泌ICAM-1及E选择素的水平;荧光定量RT-PCR结果显示ICAM-1及E选择素的转录水平也得到提高。为了证明随着黏附分子分泌水平的增加,是否也同时提高了内皮细胞与单核细胞之间的黏附,我们选用人单核细胞THP-1细胞与HUVEC相互作用。实验结果显示,经400 μg/L浓度的重组蛋白Tpp47刺激24 h后,THP-1细胞与HUVEC的黏附率显著提高。脂多糖对内皮细胞的作用已在多项研究中证实,可促进HUVEC的增殖、活化、黏附分子及炎症因子的分泌[12]。本实验选用脂多糖作为阳性对照,结果显示,重组蛋白Tpp47在促进HUVEC ICAM-1及E选择素分泌及与THP-1细胞的黏附方面,与脂多糖的作用相似,但促进HUVEC增殖的能力较脂多糖弱(P<0.05)。推测重组蛋白Tpp47对HUVEC的作用主要为促进其活化,通过分泌黏附分子,增加与单核细胞的黏附。Lee等[13]曾将重组蛋白Tpp47作用于人皮肤微血管内皮细胞(HDMEC),结果显示,重组蛋白Tpp47可促进HDMEC分泌黏附分子ICAM-1、血管细胞黏附分子1及E选择素,且可促进HDMEC与外周血T淋巴细胞的黏附。本研究与之不同在于,一是采用HUVEC,为目前国内外研究与血管炎症相关疾病的常用细胞,对解释Tp对机体心血管等内脏器官的损伤更为明确;二是观察了Tpp47对该细胞的促增殖能力,可部分解释梅毒皮损中内皮细胞增生这一病理特征,这也是以往未见报告的。但本研究中的Tpp47系采用基因重组工程技术获得,与Tp细胞上的Tpp47脂蛋白可能不完全相同,其生物学活性亦可能不尽相同。此外本研究所测为HUVEC的分泌型黏附分子,后者的免疫学功能与细胞表面的膜型黏附分子有所不同,因此解释结果时可能存在一定局限性。
本研究结果显示,Tp膜蛋白Tpp47可促进内皮细胞的增殖、分泌黏附分子及促进内皮细胞与淋巴细胞之间的黏附,这在梅毒致病机制中可能起重要作用。鉴于Tp膜蛋白在梅毒发病机制中的作用及梅毒发病机制研究现状,进一步研究膜蛋白Tpp47对内皮细胞其他功能的影响,如对炎症细胞的趋化作用,内皮细胞骨架结构的改变等,以及其他Tp膜蛋白对内皮细胞功能的影响,对深入研究梅毒的发病机制有一定的意义。
[1]Chow EP,Wilson DP,Zhang L.HIV and syphilis co-infectin increasing among men who have sex with men in china:a systematic review and meta-analysis[J].PLoS One,2011,6(8):e22768-.
[2]Buchacz K,Patel P,Taylor M,et al.Syphilis increases HIV viral load and decreases CD4 cell counts in HIV-infected patients with new syphilis infection[J].AIDS,2004,18(15):2075-2079.
[3]Giacani L,Molini B,Godornes C,et al.Quantitative analysis of tpr gene expression inTreponema pallidumisolates:differences among isolates and correlation with T-cell responsiveness in experimental syphilis[J].Infect Immun,2007,75(1):104-112.
[4]Lee JH,Choi HJ,Jung J,et al.Receptors forTreponema pallidumattachment to the surface and matrix proteins of cultured human dermal microvascular endothelial cells[J].Yonsei Med J,2003,44(3):371-378.
[5]Riley BS,Oppenheimer-Marks N,Hansen EJ,et al.VirulentTreponema pallidumactivates human vascular endothelial cells[J].J Infect Dis,1992,165(3):484-493.
[6]Thomas DD,Navab M,Haake DA,et al.Treponema palliduminvades intercellular junctions of endothelial cell monolayers[J].Proc Natl Acad Sci U S A,1988,85(10):3608-3612.
[7]Bouis DA,Popova TG,Takashima A,et al.Dendritic cells phagocytose and are activated byTreponema pallidum[J].Infect Immun,2001,69(01):518-528.
[8]Sokolova O,Heppel N,Jägerhuber R,et al.Interaction ofNeisseriameningitidiswith human brain microvascular endothelial cells:role of MAP-and tyrosine kinases in invasion and inflammatory cytokine release[J].Cell Microbiol,2004,6(12):1153-1166.
[9]Leader BT,Godornes C,VanVoorhis WC,et al.CD4+lymphocytes and gamma interferon predominate in local immune responses in early experimental syphilis[J].Infect Immun,2007,75(6):3021-3026.
[10]Grange PA,Gressier L,Dion PL,et al.Evaluation of a PCR test for detection ofTreponema pallidumin swabs and blood[J].J Clin Microbiol,2012,50(3):546-552.
[11]Deka RK,Machius M,Norgard MV,et al.Crystal structure of the 47-kDa lipoprotein ofTreponema pallidumreveals a novel penicillin-binding protein[J].J Biol Chem,2002,277(44):41857-41864.
[12]Charreau B,Coupel S,Goret F,et al.Association of glucocorticoids and cyclosporin A or rapamycin prevents E-selectin and IL-8 expression during LPS-and TNFalpha-mediated endothelial cell activation[J].Transplantation,2000,69(5):945-953.
[13]Lee KH,Choi HJ,Lee MG,et al.VirulentTreponema pallidum47 kDa antigen regulates the expression of cell adhesion molecules and binding of T-lymphocytes to cultured human dermal microvascular endothelial cells[J].Yonsei Med J,2000,41(5):623-633.
2013-07-05)
(本文编辑:颜艳)
Treponema pallidummembrane protein Tpp47 promotes the adhesion ability of vascular endothelial cellsin vitro:an experimental study
Zhang Ruili,Wang Qianqiu.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
Wang Qianqiu,Email:wangqq@ncstdlc.org
ObjectiveTo evaluate the effect ofTreponema pallidummembrane protein Tpp47 on vascular endothelial cells.MethodsHuman umbilical vein endothelial cells(HUVECs)were classified into multiple groups to be cultured with various concentrations(50,100,200,400 and 800 μg/L)of the recombinant protein Tpp47 or lipopolysaccharide(LPS)for different durations(3,6,12,24 and 48 hours).Then,enzyme-linked immunosorbent assay(ELISA)was performed to determine the levels of intercellular cell adhesion molecule-1(ICAM-1)and E-selectin in the culture supernatant of,fluorescence-based real-time quantitative PCR to quantify the mRNA expressions of ICAM-1 and E-selectin in,HUVECs.The 3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyl tetrazolium bromide(MTT)assay was used to evaluate the proliferation activity of HUVECs treated with Tpp47(400 μg/L)and LPS(200 μg/L)respectively for 24 hours.To estimate the effect on adhesion ability,some HUVECs were pretreated with Tpp47(400 μg/L)and LPS(200 μg/L)respectively for 24 hours followed by coculture with THP-1 human monocytic leukaemia cells for 6 hours,then,the adhesion of HUVECs to THP-1 cells was visualized by fluorescence microscopy.The cells receiving no treatment served as the blank control.Results A significant increase was observed in the supernatant level(expressed as the absorbance value at 450 nm)of ICAM-1 for HUVECs treated with Tpp47 of 400 μg/L for 24 hours(1.28 ± 0.03 vs.0.90 ± 0.01,t=18.28,P< 0.05)and that of E-selectin for HUVECs treated with Tpp47 of 400 μg/L for 12 hours(0.51 ± 0.01 vs.0.13 ± 0.03,t=18.19,P<0.05)compared with untreated HUVECs.The adhesion rate to THP-1 cells was significantly higher in HUVECs pretreated with Tpp47 for 24 hours than in untreated HUVECs(56.1% ±1.9%vs.16.3% ±2.1%,χ2=12.65,P<0.05).The cell proliferation rate was 19.5% ± 1.7%in HUVECs treated with Tpp47,significantly higher than that in untreated HUVECs(10.0% ±3.1%,χ2=3.92,P<0.05),but lower than that in those treated with LPS(41.2% ±3.7%,χ2=10.42,P< 0.05).ConclusionsThe recombinant membrane protein Tpp47 could enhance HUVECs to proliferate and adhere to monocytic THP-1 cells,suggesting a certain role of Tpp47 in the pathogenesis of syphilis.
Treponema pallidum;Cell adhesion molecules;E-selectin;Tpp47;Human umbilical vein endothelial cells;Monocytic THP-1 cells
10.3760/cma.j.issn.0412-4030.2014.05.007
江苏省自然科学基金面上项目(BK2010136)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
王千秋,Email:wangqq@ncstdlc.org
