大鼠缺血性急性肾损伤对海马CA1区的形态学影响*
2014-12-03朱立志李郭锦李晓明
朱立志 李郭锦 田 鹤 李晓明 郭 敏△
急性肾损伤(acute kidney injury,AKI)是临床常见症候群,病死率极高,除AKI外,AKI诱导的肾外器官损伤如急性肝、肺损伤等,也构成患者死亡原因[1]。引起AKI的原因多为肾缺血,又称缺血性急性肾损伤(IAKI)。Caspase依赖的细胞死亡和聚二磷酸腺苷核糖聚合酶1(PARP-1)介导的细胞死亡是2种典型的不同形式的细胞死亡,caspase-3是外源性凋亡的执行者[2],细胞死亡过程中PARP-1的过度激活可致受损细胞死亡,又称PARP-1介导的细胞死亡[3]。IAKI可引起中枢神经系统症状和体征,如急性尿毒症性脑病,其机制不明[4],原因之一是尚不完全清楚神经元对IAKI的反应机制。海马是对外源性刺激,如缺血、游离基等反应最为敏感的部位[5],尽管有学者通过光镜观察了海马神经元对IAKI的反应[6],但有关IAKI对海马神经元形态学的影响尚鲜见报道。本研究复制了IAKI大鼠模型,应用光镜、电镜、免疫组织化学及免疫印迹技术对海马CA1区神经元进行观察和分析,报告如下。
1 材料与方法
1.1 材料 (1)实验动物。清洁级SD大鼠12只,8周龄,雌雄各半,体质量250~300 g,购自大连医科大学实验动物中心,许可证号:SCXK(辽)2008-0002。饲养于辽宁医学院SPF级动物实验室,许可证号:SYXK(辽)2009-0004。(2)主要试剂及仪器。羊抗大鼠PARP-1(Santa Cruz公司)、兔抗大鼠caspase-3单克隆抗体(abcam公司);二抗试剂盒(辣根酶标记抗羊和羊抗兔多聚体、辣根过氧化酶标记抗羊和羊抗兔IgG抗体)、β-actin鼠单克隆抗体及DAB显色试剂盒(北京中杉金桥生物有限公司)。LKB-V型超薄切片机(德国Leica公司),EX1200透射电镜(日本电子公司)。
1.2 方法
1.2.1 动物模型制备 动物以苦味酸编号,之后按单纯随机法(按随机数字表)将动物分为2组,实验组(IAKI组)8只,苯巴比妥钠麻醉后开腹,应用无损伤血管夹阻断双侧肾动脉血流60 min后放开血管夹。对照组(sham组)4只,手术过程同前,但不阻断肾动脉血流。2组动物关腹后于无菌条件下饲养24 h后取材。
1.2.2 取材 各组一半动物麻醉后经腹主动脉取血2 mL用于肾功能常规检查。然后经心室用2.5%多聚甲醛戊二醛灌流固定大脑,经200 mL成功灌注(大鼠出现去大脑强直表现)后,取大脑入同样固定液进行浸润固定48 h;另一半动物断头后迅速切取海马组织用于免疫印迹测定分析。
1.2.3 光镜电镜标本制备 部分多聚甲醛戊二醛固定的脑组织经水洗后进行系列乙醇脱水,二甲苯透明后石蜡定向包埋,行7~8 μm厚切片,部分切片苏木素、伊红染色,光镜观察;部分切片免疫组织化学染色备用。部分经2.5%多聚甲醛戊二醛固定的脑组织再经1%锇酸后固定后,常规电镜标本制备,树脂Epon812包埋,LKB-V型超薄切片机半薄切片,厚1 μm,甲苯胺蓝染色,光镜观察海马各区定位后再行超薄切片,厚70 nm,重金属双染色,EX1200透射电镜观察。
1.2.4 PARP-1和caspase-3免疫组织化学染色 采用石蜡切片免疫组化Envision法。切片常规脱蜡至水,3%过氧化氢溶液处理30 min以去除内源性过氧化物酶,高压修复抗原,分别滴加稀释(1∶100)的一抗(PARP-1和caspase-3单克隆抗体)4℃过夜,滴加辣根酶标记的抗羊和羊抗兔多聚体(PV6001)37℃孵育30 min,DAB显色。以上各步骤之间用0.01 mol/L PBS洗涤3次,苏木素复染,脱水,透明,中性树胶封片,光镜下观察。阴性对照用PBS替代一抗。蛋白阳性表达呈棕黄色,PARP-1阳性颗粒分布于细胞核,caspase-3阳性颗粒出现在细胞质。
1.2.5 PARP-1和caspase-3免疫印迹检测 各组新鲜海马组织加入RIPA裂解液,0℃下剪碎和超声波粉碎20 s后静置30 min,4℃下12 000 r/min离心20 min,留取上清液,BCA法测定蛋白含量,并按每20 μL含50 μg蛋白制成样品,-20℃冰箱保存。取已制备样品适量加入电泳槽,100 V电压下电泳,转膜,常温下半干转印,TBST冲洗后,5%小牛血清白蛋白室温封闭1~2 h。分别加入一抗(PARP-1和caspase-3抗体,稀释度1∶1 000)4℃孵育过夜,TBST缓冲液洗脱3次,每次5 min;分别加入二抗(辣根过氧化酶标记的抗羊和羊抗兔IgG抗体,稀释度1∶200)室温孵育1 h,TBST缓冲液洗脱3次,每次5 min,ECL发光显色;采用β-actin作为内参,扫描电泳条带,用凝胶分析软件分析各蛋白目的条带吸光度。以目的条带与内参条带吸光度的比值表示待测蛋白含量。
1.3 统计学方法 应用SPSS 13.0软件分析,计量资料用x±s表示,2组间比较采用t检验,Plt;0.05为差异有统计学意义。
2 结果
2.1 肾功能检测结果 IAKI组血尿素氮为(39.1±2.7)mmol/L,血清肌酐为(318±26)mmol/L,高于Sham组的血尿素氮(4.2±0.8)mmol/L,血清肌酐(88±17)mmol/L,差异均有统计学意义(t分别为24.597和14.832,均Plt;0.05),IAKI动物模型成立。
2.2 光镜观察结果 海马结构可分CA1、CA2、CA3和DG 4个亚区,由分子层、锥体细胞层和颗粒层组成。Sham组海马结构清晰,锥体细胞层无异常变化,见图1A。IAKI组海马明显的变化发生在CA1区锥体细胞层,出现了固缩的神经元,细胞核与细胞质均固缩,见图1B、C。
2.3 电镜观察结果 Sham组海马CA1区锥体细胞层神经元呈正常结构,见图2A,细胞核圆形,染色质疏松,核仁明显,细胞质电子密度中等,核糖体与粗面内质网清晰可见。IAKI组海马CA1区锥体细胞层神经元呈固缩状,细胞质固缩,细胞核萎缩,核仁依然可见,染色质无固缩边聚表现,见图2B;高倍镜下可见内质网扩张,线粒体肿胀变性,脊紊乱,见图2C(箭头所示)。
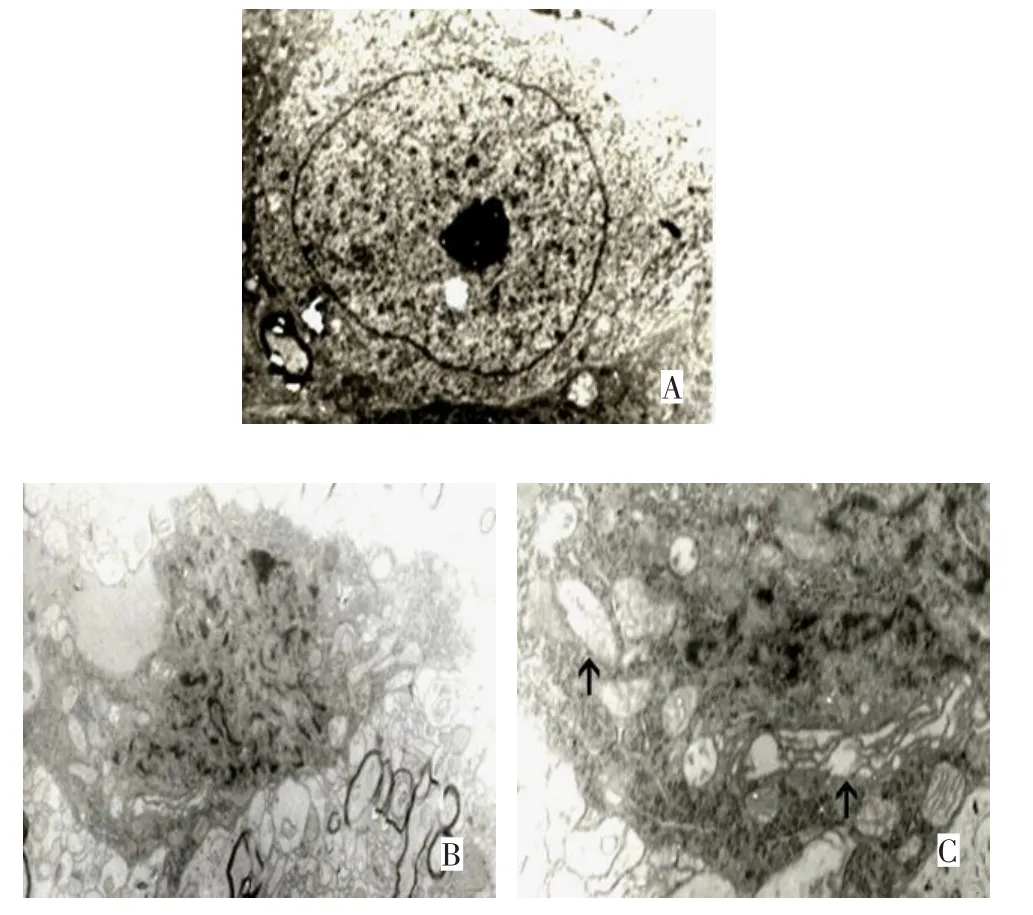
Figure 2 The electron microscope image of hippocampal CA1 pyramidal neurons图2 海马CA1区锥体细胞层神经元电镜图像
2.4 免疫组织化学染色结果 Sham组海马CA1区锥体细胞层PARP-1呈阴性染色,见图3A,IAKI组海马CA1区锥体细胞层固缩的神经元PARP-1呈阳性表达,阳性颗粒集中出现在细胞核内,见图3B,少许出现在细胞质中,见图3C;2组caspase-3均呈阴性表达。
2.5 免疫印迹检测分析结果 2组caspase-3表达均不明显;IAKI组海马PARP-1蛋白表达量高于sham组(0.579 6±0.103 5vs0.351 3±0.092 3,t=3.293,Plt;0.05),见图4。
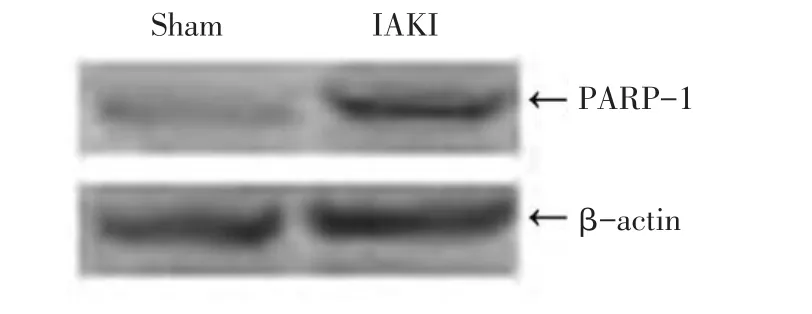
Figure 4 Results of immunoblot analysis of PARP-1 in two groups图4 2组PARP-1免疫印迹电泳条带
3 讨论
国内外常用的大鼠AKI动物模型有缺血性和非缺血性2种,前者为肾缺血再灌注损伤引起的,多采用肾缺血60 min再灌注24 h[7]。从本实验结果可以看出大鼠肾缺血60 min再灌注24 h后(IAKI组)肾功能严重损伤,说明本实验IAKI动物模型是成立的。
有报道IAKI引起肾外器官某些细胞发生固缩性损伤,如肝细胞[7]。本课题组也有同样的发现[8],光镜下细胞固缩,有的核染色质固缩,有的则无固缩表现,经电子显微镜观察以及caspase-3免疫组化染色发现部分光镜下所见的固缩性损伤为凋亡的肝细胞。IAKI诱导的海马神经元的固缩性改变是否属于细胞凋亡尚未知。Liu等[6]于2008年报道IAKI诱导海马锥体细胞层发生固缩性损伤的形态学改变,并提出了固缩性神经元(pyknotic neuron)这一概念,但只是在光镜下所见,没有进行电子显微镜观察以及PARP-1和caspase-3等免疫组化染色分析。从形态学角度确认细胞死亡的条件有4个:(1)细胞膜完整性消失。(2)细胞核固缩碎片化。(3)被吞噬或自噬。(4)细胞固缩,主要细胞器空泡化,又称细胞质死亡(cytoplasmic death)[9]。本研究应用电镜观察发现海马CA1区锥体细胞层固缩的神经元细胞核染色质无固缩边聚的表现,细胞器的损伤也不支持凋亡的结论;同样也没有细胞肿胀、细胞膜破溃等细胞坏死的特征;也没有被吞噬的表现;但具有细胞质死亡的特点,光镜下细胞固缩,电镜下主要表现为细胞质内主要细胞器,如线粒体、内质网等呈肿胀空泡化。
2012年国际细胞死亡分类命名委员会在倡议综述中提出,从分子生物学或生物化学角度命名细胞死亡的时代已经来临。Caspase依赖的细胞死亡和PARP-1介导的细胞死亡是典型的2种不同形式的细胞死亡。Caspase-3是外源性凋亡的执行者(excutor),也是判断细胞凋亡的生化标志(biochemi⁃cal marker)[2,10],PARP-1的过度激活引起的细胞损伤或细胞死亡,也称PARP-1介导的细胞损伤(PARP-1 mediated cell injury)或PARP-1介导的细胞死亡[3,11]。本实验免疫印迹检测分析及免疫组织化学染色结果显示缺血性急性肾损伤的海马cas⁃pase-3阴性表达而PARP-1表达明显增强,说明IA⁃KI诱导的海马神经元的固缩性改变不属于caspase依赖的细胞死亡(细胞凋亡),可能是由于PARP-1的过度激活引起的细胞损伤或死亡。
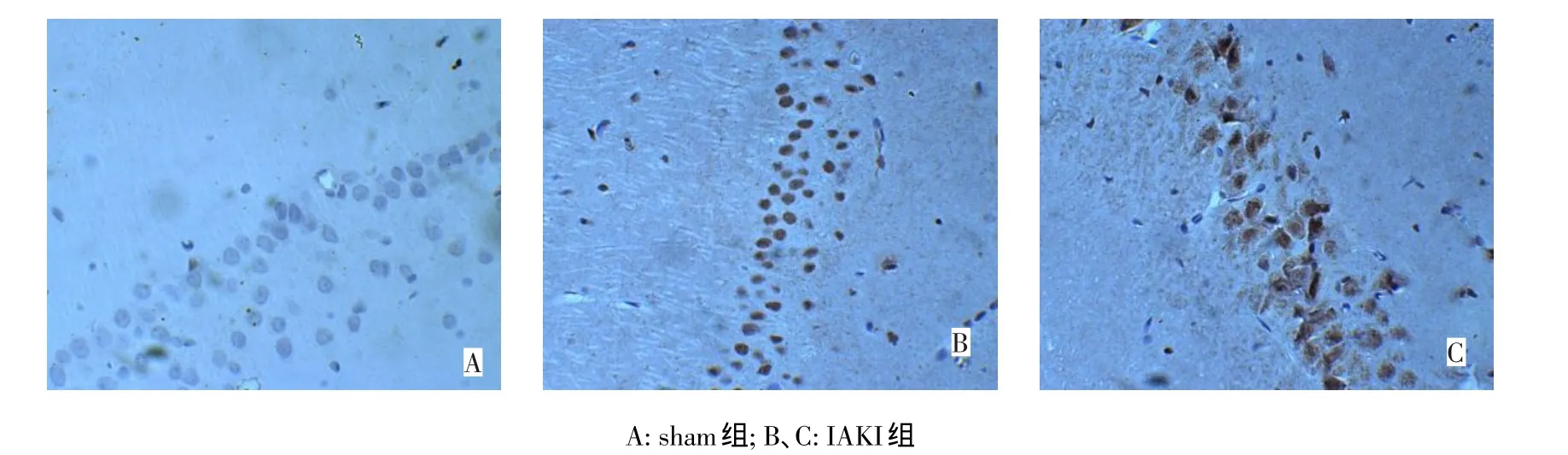
Figure 3 The photos of PARP-1 immunohistochemical staining图3 PARP-1免疫组织化学染色图像(×200)
[1]Faubel S.Acute kidney injury and multiple organ dysfunction syn⁃drome[J].Minerva Urol Nefrol,2009,61(1):171-188.
[2]Pradelli LA,Beneteau M,Ricci J.Mitochondrial control of caspasedependent and independent cell death[J].Cell Mol Life Sci,2010,67(10):1589-1597.
[3]David KK,Andrabi SA,Dawson TM,et al.Parthanatos:a messenger of death[J].Front Biosci,2009,14:1116-1128.
[4]Yap SC,Lee HT.Acute kidney injury and extrarenal organ dysfuc⁃tion[J].Anesthesiology,2012,116(5):1139-1148.
[5]Lipton P.Ischemic cell death in brain neurons[J].Physiological Re⁃view,1999,79(7):1433-1532.
[6]Liu M,Liang Y,Chigurupati S,et al.Acute kidney injury leads to in⁃flammation and functional changes in the brain[J].J Am Soc Nephrol,2008,19(7):1360-1370.
[7]Golab F,Kadkhodaee M,Zahmatkesh M,et al.Ischemic and nonisch⁃emic acute kidney injury cause hepatic damage[J].Kidney Int,2009,75(5):783-792.
[8]包翠芬,邵佑之,刘玉玲,等.大鼠缺血性急性肾损伤对肝细胞形态学的影响[J].解剖学报,2012,43(5):635-640.
[9]Sperandio S,Belle DE,Bredesen DE.An alternative nonapoptosis form of programed cell death[J].Pro Natl Acad Sci,2000,97(26):14376-14381.
[10]Kroemer G,Galluzzi L,Vandenabeele P,et al.Classification of cell death:recommendations of the Nomenclature Committee on Cell Death[J].Cell Death Differ,2009,16(1):3-11.
[11]Alano CC,Garnier P,Ying W,et al.NAD depletion is necessary and sufficient for PARP-1 mediated neuronal death[J].J Neurosci,2010,30(8):2967-2978.
