血清人附睾蛋白4检测对肺癌的诊断意义*
2014-12-03钟殿胜
于 飞 王 倩 钟殿胜 宁 超 马 晴 肖 平
目前诊断肺癌的方法除影像学、病理学等手段外,各种肿瘤标志物的测定也具有重要价值。血清中癌胚抗原(CEA)、细胞角蛋白片段19、神经元特异性烯醇化酶等标志物已被广泛应用于临床中,但这些标志物敏感性不高,往往在肿瘤负荷较重时才显著升高。因此,积极寻找敏感度和特异度较高的肿瘤标志物成为目前提高肺癌确诊率亟待解决的问题。人附睾蛋白4(HE4)属于乳清酸性4-二硫化中心(WFDC)蛋白家族。研究报道HE4在多种正常组织(包括呼吸道、生殖道)的上皮内均有表达[1],在卵巢癌组织中过表达[2],可作为卵巢癌有诊断意义的血清标志物[3]。此外,有学者发现部分肺癌细胞中HE4可呈阳性表达,并且在部分肺癌患者的血清及组织中也存在HE4高水平表达[4],这些均提示血清HE4可能是对肺癌有诊断意义的肿瘤标志物。目前,国内尚鲜见HE4与肺癌之间关系的报道,本研究通过检测HE4在血清中的表达情况,研究其对肺癌诊断及进展评估的价值。
1 对象与方法
1.1 研究对象 收集2012年6月—2013年3月于我院呼吸科、肿瘤科及肺外科住院确诊为肺癌的患者47例为肺癌组,其中男26例,女21例,年龄43~86岁,平均(65.15±11.08)岁;根据国际抗癌联盟(UICC)2009年制定的第7版国际TNM分期标准分期,47例患者中Ⅰ~Ⅲ期17例,Ⅳ期30例。纳入标准:经气管镜组织活检、组织刷片、开胸肺活检、胸水液基细胞学及沉淀物病理检查见肿瘤细胞,结合免疫组化染色及影像学检查确诊为肺癌的患者,且均未接受任何放、化疗治疗。同时收集2012年7月—2012年12月于我院体检中心经常规查体、化验及影像学等检查结果无异常的健康体检者31例为健康组,其中男18例,女13例,年龄44~86岁,平均(61.32±9.60)岁。2组人群年龄(t=1.572)、性别(χ2=0.057)差异均无统计学意义(均P>0.05)。
1.2 仪器及试剂 HE4测定试剂盒购自瑞士富吉瑞必欧Fu⁃jirebio股份有限公司,仪器为瑞典康乃格全自动酶标仪。CEA测定试剂盒购自雅培公司,仪器为美国雅培i2000全自动微粒子化学发光免疫分析仪。
1.3 方法
1.3.1 标本收集 所有患者于清晨空腹抽取肘正中静脉血3 mL于普通血清管内,立即送实验室于4℃条件下3 000 r/min离心10 min,取上清液置于1.5 mL离心管内,-40℃储存。
1.3.2 检测方法 采用酶免疫计量测定法(Enzyme immuno⁃metric assay,EIA)检测患者血清中HE4水平;采用化学发光微粒子免疫测定(Chemiluminescent Microparticle Immunoas⁃say,CMIA)技术测定患者血清中CEA水平。具体操作严格按照说明书执行。
1.4 统计学方法 应用SPSS 16.0统计软件分析数据,对各组数据进行正态性检验,正态分布计量资料采用±ss表示,2组间比较采用t检验,多组间比较采用单因素方差分析;绘制血清HE4及血清CEA诊断肺癌的ROC曲线并计算曲线下面积、敏感度和特异度。Plt;0.05为差异有统计学意义。
2 结果
2.1 肺癌组与健康组血清中HE4水平比较 肺癌患者血清中HE4浓度(253.47±170.03)pmol/L,较健康体检者血清中HE4浓度(84.09±51.03)pmol/L显著升高(t=5.365,Plt;0.01)。
2.2 不同病理类型肺癌患者血清中HE4水平比较 根据各型肺癌的分化程度、形态特征和生物学特点将47例肺癌患者进行组织病理学分类,分为非小细胞癌组与小细胞癌组。非小细胞癌组33例,男19例,女14例,年龄50~86岁,平均(65.03±8.87)岁。小细胞癌组10例,男5例,女5例,年龄43~80岁,平均(60.20±13.99)岁。另有4例患者病理类型不明确,故未予进行统计分析。2组患者年龄(t=1.031),性别(χ2=0.004)差异均无统计学意义(均P>0.05)。非小细胞癌组进一步分组,鳞癌组7例,男5例,女2例,年龄50~78岁,平均(64.57±8.40)岁;腺癌组26例,男14例,女12例,年龄52~86岁,平均(65.15±9.15)岁。鳞癌组、腺癌组与小细胞癌组3组间患者年龄(F=0.846)、性别(χ2=0.900)差异均无统计学意义(均P>0.05)。非小细胞癌组与小细胞癌组患者血清中HE4浓度分别为(241.34±161.81)pmol/L和(293.5±198.76)pmol/L,差异无统计学意义(t=0.847,Pgt;0.05)。鳞癌组患者血清中HE4浓度为(304.29±287.61)pmol/L,腺癌组为(224.39±122.15)pmol/L,与小细胞癌组间HE4浓度差异无统计学意义(F=0.969,P>0.05)。
2.3 Ⅰ~Ⅲ期与Ⅳ期肺癌患者血清中HE4水平比较 47例患者中Ⅰ~Ⅲ期17例,男7例,女10例,年龄50~80岁,平均(61.24±9.64)岁;Ⅳ期30例,男19例,女11例,年龄43~86岁,平均(67.37±11.38)岁。2组患者年龄(t=1.871)、性别(χ2=2.155)差异均无统计学意义(均P>0.05)。Ⅰ~Ⅲ期肺癌患者血清中HE4浓度[(255.27±183.04)pmol/L]与Ⅳ期患者血清中HE4浓度[(288.16±216.49)pmol/L]相比差异无统计学意义(t=0.528,Pgt;0.05)。
2.4 血清HE4和CEA诊断肺癌的ROC分析 以病理结果为金标准,绘制血清HE4和CEA诊断肺癌的ROC曲线。血清HE4的ROC曲线下面积为0.902(P<0.001),当血清中HE4浓度为149.145 pmol/L时,其诊断的敏感度和特异度分别为72.3%和90.3%。血清CEA的曲线下面积为0.765(P<0.001),当CEA质量浓度为4.685 μg/L时,敏感度和特异度分别为57.4%和83.9%。图1显示血清HE4诊断肺癌的敏感度和特异度均较血清CEA高。
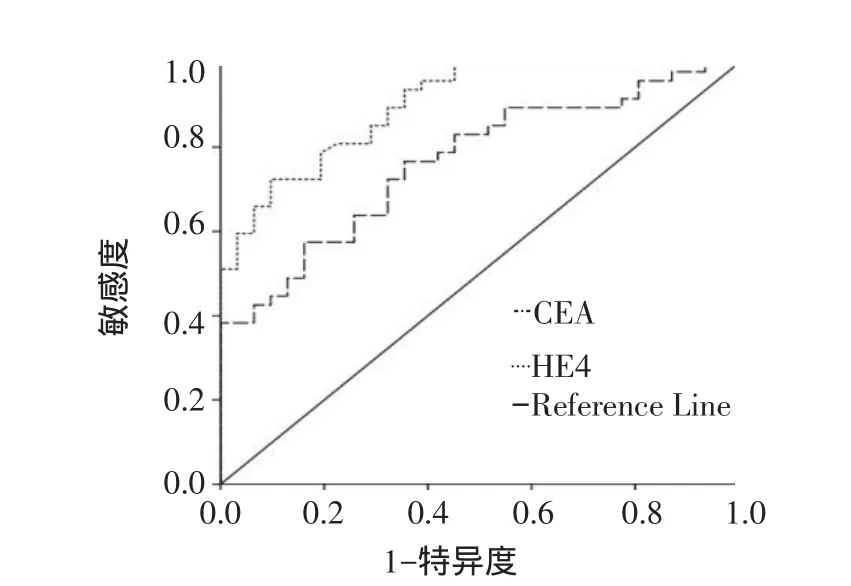
Figure 1 The ROC curve of serum HE4 and serum CEA in diagnosis of lung cancer图1 血清HE4和CEA诊断肺癌的ROC曲线
3 讨论
3.1 HE4的结构及作用 HE4基因最早由Kirchhoff等[5]报道,并于人附睾上皮细胞中克隆出其cDNA,该基因定位于人类基因组染色体20q12-13.1[6],编码一段长度为13 ku的蛋白,糖基化形成后约为20~25 ku。HE4属于乳酸蛋白(whey acidic protien,WAP)结构域家族中的一员,具有疑似胰蛋白酶抑制剂的特性以及抗菌活性和抗炎效果[7]。
3.2 HE4在肺癌患者中的表达及意义 目前国外已有一些关于HE4与肺癌之间关系的报道。Bingle等[8]发现部分肺癌细胞系可表达HE4;Tokuishi等[4]在肺癌细胞胞浆中发现了免疫荧光染色着色的HE4蛋白。Yamashita等[9]利用免疫测定技术分别对原发性肺腺癌及健康志愿者血清中HE4浓度进行检测,结果表明肺癌患者血清中HE4浓度明显较健康组升高,且提示血清中HE4高表达与术后较高的复发率有关。Iwahori等[10]通过酶联免疫吸附(ELISA)法对49例肺癌及18例卵巢癌患者血清中HE4浓度进行测定,结果显示2组患者血清中HE4水平均较健康组明显升高;通过敏感性特异性分析,当临界值定为262.4 pmol/L(6.56 μg/L=262.4 pmol/L)时,90%的非小细胞肺癌、88.9%的小细胞肺癌及44.4%的卵巢癌患者血清中HE4浓度升高;此外对其中24例化疗后患者生存率与HE4浓度关系进行研究发现,血清中高浓度的HE4与治疗后较差的生存率有关。Yamashita等[11]通过免疫组化法对137例肺腺癌患者组织中HE4蛋白表达情况进行测定,发现41.6%的患者HE4呈阳性表达,且HE4阳性表达者的5年无病生存率及5年总体生存率均较对应的阴性表达者明显降低。因此,HE4对于肺癌的诊断、预后的评估等可能有较为广阔的应用前景。目前国内尚鲜见HE4与肺癌之间关系的报道,其在血清中的表达情况与肺癌诊断及进展的关系仍需进一步探究。
3.3 小结 本研究表明,HE4在肺癌患者血清中的表达高于健康体检者,但不同病理类型患者血清中HE4浓度无明显差异,提示血清HE4可能对肺癌的病理类型无明确指向性。Ⅰ~Ⅲ期与Ⅳ期肺癌患者血清中HE4浓度亦无明显差异,推测HE4的来源可能仅与肿瘤组织局部分泌增加和负荷加重有关,而与肿瘤细胞的浸润、转移过程无关。此外,因血清CEA作为肺癌诊断的标志物已广泛用于临床,故以此为对照标志物绘制了血清CEA及HE4诊断肺癌的ROC曲线,其研究显示,血清HE4诊断肺癌具有较高的敏感度和特异度。因此,血清中HE4浓度的升高对于诊断肺癌具有一定临床应用价值。
[1]Galgano MT,Hampton GM,Frierson HJ.Comprehensive analysis of HE4 expression in normal and malignant human tissues[J].Mod Pathol,2006,19(6):847-853.
[2]Molina R,Escudero JM,Auge JM,et al.HE4 a novel tumour mark⁃er for ovarian cancer:comparison with CA 125 and ROMA algo⁃rithm in patients with gynaecological diseases[J].Tumour Biol,2011,32(6):1087-1095.
[3]Li J,Dowdy S,Tipton T,et al.HE4 as a biomarker for ovarian and endometrial cancer management[J].Expert Rev Mol Diagn,2009,9(6):555-566.
[4]Tokuishi K,Yamashita S,Ohbo K,et al.Splice variant HE4-V3 ex⁃pression is associated with favorable prognosis in pulmonary adeno⁃carcinoma[J].Tumour Biol,2012,33(1):103-109.
[5]Kirchhoff C,Habben I,Ivell R,et al.A major human epididymisspecific cDNA encodes a protein with sequence homology to extra⁃cellular proteinase inhibitors[J].Biol Reprod,1991,45(2):350-357.
[6]Iwabuchi H,Sakamoto M,Sakunaga H,et al.Genetic analysis of be⁃nign,low-grade,and high-grade ovarian tumors[J].Cancer Res,1995,55(24):6172-6180.
[7]Bouchard D,Morisset D,Bourbonnais Y,et al.Proteins with wheyacidic-protein motifs and cancer[J].Lancet Oncol,2006,7(2):167-174.
[8]Bingle L,Cross SS,High AS,et al.WFDC2(HE4):a potential role in the innate immunity of the oral cavity and respiratory tract and the development of adenocarcinomas of the lung[J].Respir Res,2006,7:61.
[9]Yamashita S,Tokuishi K,Moroga T,et al.Serum level of HE4 is closely associated with pulmonary adenocarcinoma progression[J].Tumour Biol,2012,33(6):2365-2370.
[10]Iwahori K,Suzuki H,Kishi Y,et al.Serum HE4 as a diagnostic and prognostic marker for lung cancer[J].Tumour Biol,2012,33(4):1141-1149.
[11]Yamashita S,Tokuishi K,Hashimoto T,et al.Prognostic signifi⁃cance of HE4 expression in pulmonary adenocarcinoma[J].Tumour Biol,2011,32(2):265-271.
