P16、细胞周期蛋白D1在大鼠胃黏膜萎缩过程中的表达变化及意义
2014-12-03陈海金王惠吉福建医科大学附属协和医院急诊科福建福州35000
陈海金 王惠吉 (福建医科大学附属协和医院急诊科,福建 福州 35000)
慢性萎缩性胃炎(CAG)是消化系统常见病,由多种因素导致的,慢性胃炎尤其胃窦萎缩性胃炎与胃癌关系密切〔1,2〕。胃黏膜发生恶性变的过程中,存在细胞增殖的异常,这种细胞增殖的异常由多种癌基因、抑癌基因及凋亡调控因素共同参与调节。我国即将进入老年化社会,在老年群体中,胃黏膜组织的退行性萎缩非常普遍,老年人对疾病反应不敏感,一旦检出胃癌往往已进入进展期癌,因此对萎缩性胃炎组织学及分子生物学改变进行研究十分必要。
1 对象与方法
1.1 研究对象 健康成年雄性SD大鼠,8周龄,体重200~250 g,共72只,购自北京维通利华实验动物有限公司,饲养于首都医科大学附属北京友谊医院动物实验室。随机分成正常对照组24只,模型组48只,两组再根据时间点分为2,4,6个月组,对照组分别为8只,模型组实验过程中有动物死亡,分别处死10,10,12只。
1.2 试剂、药品及仪器 氨水(NH3OH),乙醇,脱氧胆酸钠:购自北京化学试剂公司;Cyclin D1免疫组化试剂及P16免疫组化试剂:Santa Cruz公司;Envision试剂:Dako公司。IMS细胞图像分析系统:上海申腾信息技术有限公司。
1.3 动物模型诱导 参照文献〔3〕,模型组采用 60%酒精8 ml/kg每3天空腹灌胃1次(前1 d晚上撤除饲料),0.1%氨水自由饮用,20 mmol/L脱氧胆酸钠8 ml/kg每天灌胃。对照组自由饮水及进食,共6个月。每周测量动物体重,根据体重调整药物剂量。
1.4 标本制作及指标检测
1.4.1 标本制备 动物处死前禁食24 h,以50 mg/kg的戊巴比妥钠腹腔注射麻醉,沿正中线剪开腹腔及胸腔,取全胃,沿胃大弯剪开,于冰盐水中洗净,肉眼观察大体标本,沿胃小弯及大弯全长分别纵行切取宽约4 mm组织,置入4%甲醛溶液,固定24 h,石蜡包埋,切片,行HE染色。
1.4.2 病理组织学观察 于光学显微镜下观察胃窦和胃体部病理切片,萎缩性胃炎分级参考悉尼分级系统和萎缩联谊会2000标准进行〔4〕,即腺体减少1/3位为轻度萎缩,减少在1/3到2/3之间中度萎缩,减少2/3以上为重度萎缩。
1.4.3 胃黏膜P16,Cyclin D1蛋白表达检测 采用免疫组化Envision二步法。主要步骤:切片常规脱蜡至水;3%H2O2封闭10 min以消除内源性过氧化物酶,PBS冲洗;置于0.01 mol/L pH6.0柠檬酸缓冲液中抗原修复;1%二抗正常血清室温下封闭20 min;不洗,加适当稀释一抗(50 μl),4℃冰箱过夜;PBS冲洗3次;Envision试剂37℃,15 min;PBS冲洗3次;0.04%DAB+0.03%H2O 28 min显色,自来水洗3 min,苏木素复染,常规树脂封片。结果观察:用已知阳性标本作阳性对照。阳性为棕黄色或棕褐色,并呈颗粒状,背景呈紫蓝色。用PBS代替一抗,作为阴性对照。用专业图像分析系统分析免疫组化图像中P16,Cyclin D1蛋白阳性区域面积和阳性比率,每张切片至少分析5个视野,取平均值(阳性面积率=单位面积中阳性反应的总面积/单位面积中细胞的总面积)。
1.5 统计学方法 应用SPSS13.0进行统计分析,结果以s表示。计量资料先进行方差齐性检验和正态性检验,符合条件的进行方差分析,否则作秩和检验。计数资料行χ2检验。
2 结果
2.1 病理组织学观察
2.1.1 肉眼观察 对照组胃黏膜皱襞完整,厚薄适中,表面光滑,色泽淡红。模型组胃黏膜变薄,可见黏膜下血管。皱襞减少,色泽紫暗,胃黏膜有充血、糜烂、溃疡等病变。
2.1.2 光镜观察 对照组大鼠胃黏膜内偶可见少量淋巴细胞及嗜酸细胞,模型组于第2个月可见大量淋巴细胞浸润,部分可见淋巴滤泡形成,同时可见少量中性粒细胞浸润。第4个月及第6个月组大鼠仍有大量淋巴细胞浸润,但较第2个月组有所减轻,中性粒细胞浸润不多见。
对照组大鼠胃窦小凹和腺体厚度约1∶1,腺体排列整齐,模型大鼠胃窦黏膜在2个月时即可见小凹增生,腺体轻度变薄,4个月及6个月组腺体有不同程度的排列紊乱,稀疏,腺体部纤维结缔组织增生,黏膜肌层增厚,向黏膜固有层伸展呈分支状插入腺体之间,伴有大量炎症细胞浸润,部分有成堆淋巴细胞聚集灶,胃小凹变宽,稀疏,腺体层变薄。
对照组胃体腺排列整齐,小凹较浅,腺体分布有大量壁细胞。模型组大鼠腺体逐渐出现小凹增生,小弯侧胃体腺逐渐减少,为幽门腺所取代,部分大鼠甚至胃体腺消失,全部由幽门腺所取代,即发生幽门腺化生。大弯侧胃体仅表现为小凹增生。见图1。
2.1.3 病理结果 根据萎缩性胃炎诊断标准,造模2个月组基本上属于慢性浅表性胃炎,少数为轻度萎缩性胃炎,而4个月及6个月模型组则基本达到中度萎缩性胃炎,少数为轻度或重度萎缩性胃炎(见表1)。4个月组及6个月组分别见1只大鼠胃小弯胃体腺为幽门腺所取代。
2.2 胃窦黏膜P16,Cyclin D1蛋白表达 P16阳性表达主要位于细胞核,在对照组大鼠高表达,模型组表达阳性面积较对照组有降低,6个月组较同期对照组降低有统计学差异(P<0.05)(表2)。Cyclin D1蛋白表达于细胞核或细胞质,在正常胃黏膜低表达,模型组大鼠胃黏膜表达较正常组有所增加,2,4个月组及6个月组较同期对照组增加均有统计学差异(P<0.05)(表2)。按萎缩程度分组,Cyclin D1在各种程度萎缩中的表达均较未萎缩者增高(P<0.01),而P16于中重度萎缩者表达较未萎缩者减低(P<0.01)。见表3,图2。

图1 正常及CAG胃黏膜(HE,×40)

表1 各组大鼠胃窦黏膜病理定性结果(n)
表2 各组大鼠胃窦黏膜P16、Cyclin D1表达(s,%)
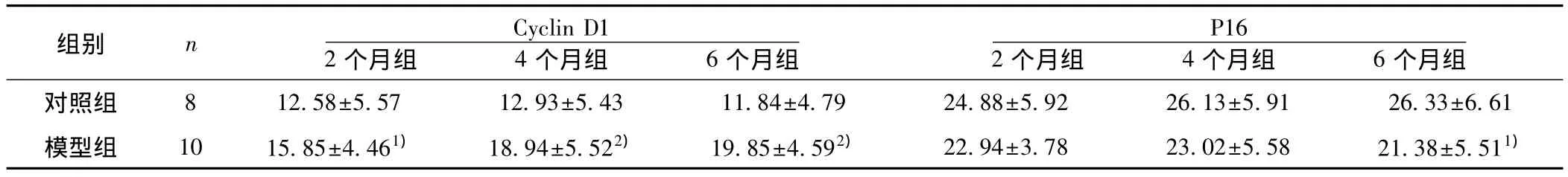
表2 各组大鼠胃窦黏膜P16、Cyclin D1表达(s,%)
与同期对照组比较:1)P<0.05,2)P<0.01
组别 n Cyclin D1 2个月组 4个月组 6个月组P16 2个月组 4个月组 6个月组对照组 8 12.58±5.57 12.93±5.43 11.84±4.79 24.88±5.92 26.13±5.91 26.33±6.61模型组 10 15.85±4.461) 18.94±5.522) 19.85±4.592) 22.94±3.78 23.02±5.58 21.38±5.511)
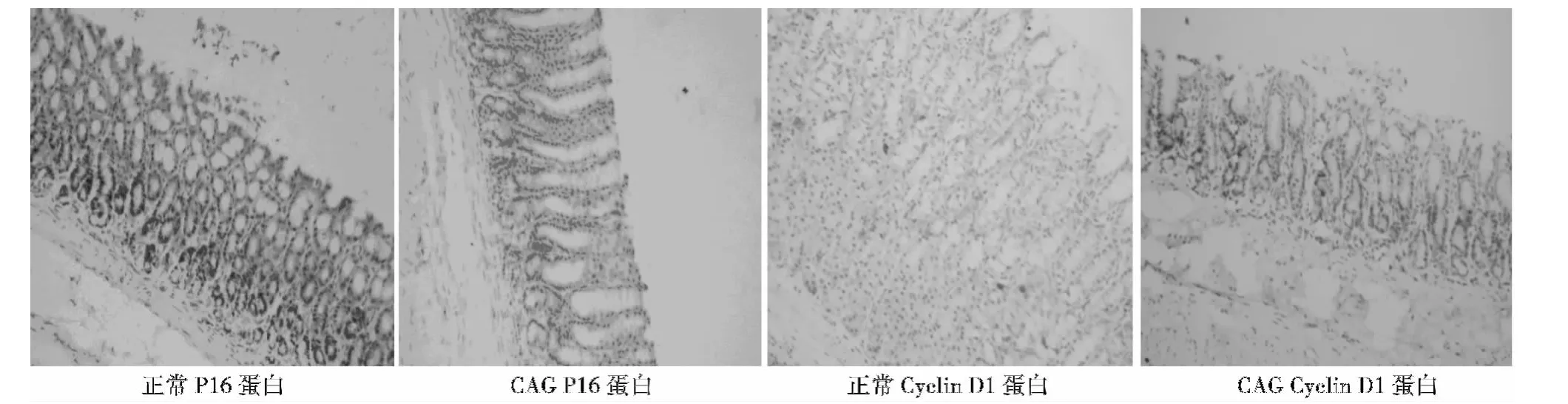
图2 各组胃黏膜P16、CyclinD1蛋白表达(DAB,×100)
表3 p16、Cyclin D1在CAG不同胃窦黏膜病变中的表达(s,%)

表3 p16、Cyclin D1在CAG不同胃窦黏膜病变中的表达(s,%)
与无萎缩组比较:1)P<0.05;2)P<0.01
萎缩程度 n Cyclin D1 P16无 28 11.89±4.69 26.15±5.61轻度 12 16.74±4.932) 23.02±4.441)中重度 16 21.37±5.322) 20.27±4.832)
3 讨论
临床上,按Strickland分类法萎缩性胃炎可分为A和B二型,B型多见于胃窦部,呈多灶性分布,又称多灶性萎缩性胃炎(MAG),易发生肠型胃癌〔5〕,在中国、日本等胃癌高发地区多见,占萎缩性胃炎的95%以上。在本实验中,综合应用乙醇损伤胃黏膜模拟长期饮酒,以脱氧胆酸钠模拟胆汁反流,以氨水模拟Hp感染导致的胃黏膜高氨状态,联合三因素长期慢性刺激胃黏膜,造成胃炎状态持续存在。在实验过程中,病理检查发现胃黏膜变薄,可见淋巴细胞和中性粒细胞浸润,可见小凹增生,胃窦黏膜变薄,腺体数目减少,黏膜肌层增厚,间质增生等表现,与人类萎缩性胃炎病理变化极为相似。
Cyclin D1是G期第1个合成的细胞周期蛋白,在G1/S期转换中发挥重要作用,在受到有害生长信号刺激后Cyclin D1大量表达并与相应的细胞周期蛋白依赖性激酶(CDK)4或CDK6结合,导致CDK4或CDK6活化,促进DNA的合成,G期缩短,从而导致细胞失控性生长,有助于肿瘤的发生。研究表明,Cyclin D1在正常组织中表达很低,其过度表达是多种恶性肿瘤细胞的共有特征〔6〕。已有研究发现,Cyclin D1蛋白在早期胃癌和癌前病变中有过度表达〔7〕,其表达与胃癌的病理学类型、是否淋巴结转移等没有相关性〔8〕,提示Cyclin D1基因的扩增和过度表达可能发生在癌变的早期阶段。本试验中,实验性萎缩性胃炎大鼠的胃黏膜Cyclin D1蛋白的表达出现明显增高,出现高增殖状态,这有助于受损胃黏膜的修复和再生,而处于高增殖状态是具有恶性潜能的细胞,细胞增殖活跃,增加了自发性DNA复制错误的可能性,同时增加了内外源性致癌因子使DNA基因突变的发生机会,导致肿瘤发生〔9〕。
P16基因是一种多瘤抑制基因,其基因产物P16蛋白可与Cyclin D1竞争结合CDK4,抑制Cvclin D1/CDK4活性,从而使细胞停滞于G1期,抑制细胞增殖,呈现抑癌基因作用。在细胞周期调控中,P16的失活和其缺失或突变在肿瘤发生过程中起着重要作用。在早期胃癌和癌前病变中,发现P16蛋白表达低下,提示P16蛋白表达低下发生在胃癌发展过程的早期〔10〕。在本试验中,大鼠萎缩性胃炎胃黏膜中P16蛋白表达尚未明显缺失,但其表达程度已有明显下调。Shapiro等〔11〕在研究中发现,P16蛋白表达缺失的出现率比p16基因的缺失出现率较高,认为p16蛋白表达缺失与p16基因的缺失关系不明显,可能与p16基因的调控有关。大鼠胃黏膜病变中P16蛋白表达改变尚需以各种因素刺激造成更进一步的病变以及检测更多相关基因进一步研究。
本实验中,大鼠胃窦炎表现为单纯萎缩性胃炎,没有出现明显肠上皮化生和异型增生,但其P16蛋白的表达是下降的而Cyclin D1蛋白表达是增加的,董西林等〔12〕通过制作十二指肠胃反流动物模型,也发现大鼠胃黏膜发生萎缩,异性增生等病变,并且也出现P16蛋白的表达是下降的而Cyclin D1蛋白表达增加,这一变化可能使胃黏膜细胞增殖增加,细胞凋亡受到抑制,张玲霞等的实验证实萎缩性胃炎胃黏膜中存在细胞增殖增加和凋亡减少〔13〕,细胞增殖和细胞凋亡的平衡被打破,将有发展成胃癌的危险。
1 Faraji EI,Frank BB.Multifocal atrophic gastritis and gastric carcinoma〔J〕.Gastroenterol Clin North Am,2002;31(2):499-516.
2 Machado JC,Figueiredo C,Canedo P,et al.A proinflammatory genetic profile increases the risk for chronic atrophic gastritis and gastric carcinoma〔J〕.Gastroenterology,2003;125(2):364-71.
3 姒健敏,吴加国,曹 倩.鼠慢性萎缩性胃炎模型的建立及致萎缩因素探讨〔J〕.中华消化杂志,2001;21(2):75-8.
4 施 尧.慢性胃炎的萎缩诊断标准和分期分级〔J〕.胃肠病学,2006;11(4):195-7.
5 EI-Zimaity HM,Ota H,Graham DY,et al.Patterns of gastric atrophy in intestinal type gastric carcinoma〔J〕.Cancer,2002;94(5):1428-36.
6 Khoo ML,Ezzat S,Freeman JL,et al.Cyclin D1 protein expression predicts metastatic behavior in thyroid papillary microcarcinomas but is not associated with gene amplification〔J〕.J Clin Endocrinol Metab,2002;87(4):1810-3.
7 陈 谦,邓怀慈,郑 伟,等.小鼠前胃癌组织形成中VEGF和Cyclin D1及p27kip1的表达〔J〕.肿瘤防治杂志,2005;12(20):1535-8.
8 Blok P,Craanen ME,van Diest PJ,et al.Lack of cyclin D1 overexpression in gastric carcinogenesis〔J〕.Histopathology,2000;36(2):151-5.
9 许岸高,李韶光,刘集鸿,等.胃癌癌前病变演化与细胞凋亡和增殖的关系〔J〕.中华医学杂志,1999;79(3):185-6.
10 周长玉,高 歌,阎晓凯,等.胃癌及癌前病变中PCNA、Bcl-2及P16蛋白的表达〔J〕.白求恩医科大学学报,2001;27(6):617-9.
11 Shapiro GI,Edwards CD,Kobzik L,et al.Reciprocal RB inactivation and p16INK4 expression in primary lung cancers and cell lines〔J〕.Cancer Res,1995;55(3):505-9.
12 董西林,董 蕾,柴宁利,等.十二指肠胃反流模型大鼠胃黏膜组织Cyclin D1、P16 蛋白表达〔J〕.医学临床研究,2004;21(5):467-71.
13 张玲霞,张 沥,徐俊荣,等.萎缩性胃炎胃黏膜组织细胞增殖与凋亡的实验研究〔J〕.中华内科杂志,2003;42(2):84-7.
