PTEN,HIF-1α和VEGF在食管鳞癌组织中的表达及其意义
2014-12-03窦鹏挥邢雨彤朱晓峰邹志田佳木斯大学附属第一医院心胸外科黑龙江佳木斯154002
窦鹏挥 邢雨彤 周 钢 朱晓峰 邹志田 (佳木斯大学附属第一医院心胸外科,黑龙江 佳木斯 154002)
食管癌是我国高发的消化系统恶性肿瘤之一,因其恶性度高,5年生存率仅20%左右〔1〕。目前因其确切病因及发病机制仍不明确,治疗方法大都采用手术结合大剂量放、化疗法,由于反复多次的放、化疗导致患者免疫功能下降,尤其是患者抵抗力降低,容易转移,从而加速了患者死亡;早期发现和针对其早期浸润转移入手而进行有针对性的治疗是该病治疗成败的关键〔2〕。目前公认的肿瘤性疾病实质上是一种多基因病〔3〕。目前对于PTEN、VEGF与HIF-1α在食管鳞癌中的共同表达情况及其相关性研究,在国内外尚未见报道。本研究利用RT-PCR、免疫组化技术研究PTEN、缺氧诱导因子(HIF)-1α及VEGF在食管鳞癌组织中的表达情况,分析三者与食管鳞癌临床病理因素的关系及其相关性,探讨各自功能、相互联系及其与食管癌发生发展机制的关系。
1 实验方法
1.1 材料 选取我院2010年10月至2013年10月收治的71例食管鳞癌患者组织样本(所有病例术前均未经过任何放化疗及激素治疗),年龄62~84〔平均(72.8±3.1)〕岁;其中16例Tis(原位癌),24例T1期(只侵及黏膜固有层和下层),15例T2期(侵及肌层),9例T3期(侵及食管纤维膜),7例T4期(侵及邻近器官区域)。另收集20例T0期正常组织作为对照,根据患者病理分期将其随机分成四组,四组患者在年龄、性别、病变长度及淋巴结转移情况均不具有显著性差异(P>0.05),具有可比性。抗体采用兔多克隆VEGF抗体(abcam,美国),S-P试剂(Maixin,中国)。
1.2 试验方法
1.2.1 免疫组化(SP法)操作步骤 切片常规脱蜡至水,并进行抗原修复,缓冲液洗3 min/2次。滴加Ultra V Block,在室温下孵育5 min以封闭非特异性的背景染色。缓冲液洗5 min/2次。滴加一抗工作液37℃孵育1~2 h。缓冲液洗5 min/2次。滴加 Primary Antibody Enhancer(增强子),在室温下孵育20 min。缓冲液洗5 min/2次。滴加 HRP Polymer(酶标二抗),在室温下孵育30 min。缓冲液洗5 min/2次。滴加DAB Plus Substrate到切片上,孵育3~15 min。自来水充分冲洗,复染,脱水,透明,封片,拍照。
1.2.2 RT-PCR操作步骤 采用RT-PCR检测PTEN、HIF-1α及VEGF基因的转录表达:取各例实验材料一部分,用于提取总RNA。同时针对上述3个基因设计PCR引物,利用RT-PCR试剂盒检测个样本中各个基因的转录表达情况。
1.3 统计学方法 采用SPSS14.0软件,组间样本均数比较采用独立样本t检验和ANOVA方差分析。
2 结果
2.1 食管鳞癌患者组织内PTEN和HIF-1α表达量特点PTEN mRNA和HIF-1α mRNA表达水平通过棕色颗粒表达,多存在于肿瘤细胞的细胞质和内皮细胞和血管细胞质中,测量PTEN、HIF-1α mRNA及VEGF在食管鳞癌患者组织中的表达量显示,在不同病理分级患者组织中,各表达量均具有显著性差异,PTEN 在 T0、Tis组(0.178 2±0.027 1)及 T1和 T2组(0.168 3±0.039 7)患者中表达量比 T3和T4组(0.147 0±0.052 4)患者中的表达显著增高(P<0.05),HIF-1α表达在T3+T4组中的表达量(0.233 5±0.074 8)比 Tis(0.102 9±0.045 7)及T1+T2组(0.165 6±0.032 9)患者显著增高,且均大于T0组患者表达量。HIF-1α和VEGF的变化趋势相似。见图 1,图 2。
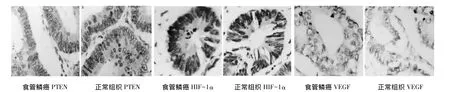
图1 食管鳞癌及正常组织中PTEN、HIF-1α、VEGF表达(S-P法,×400)
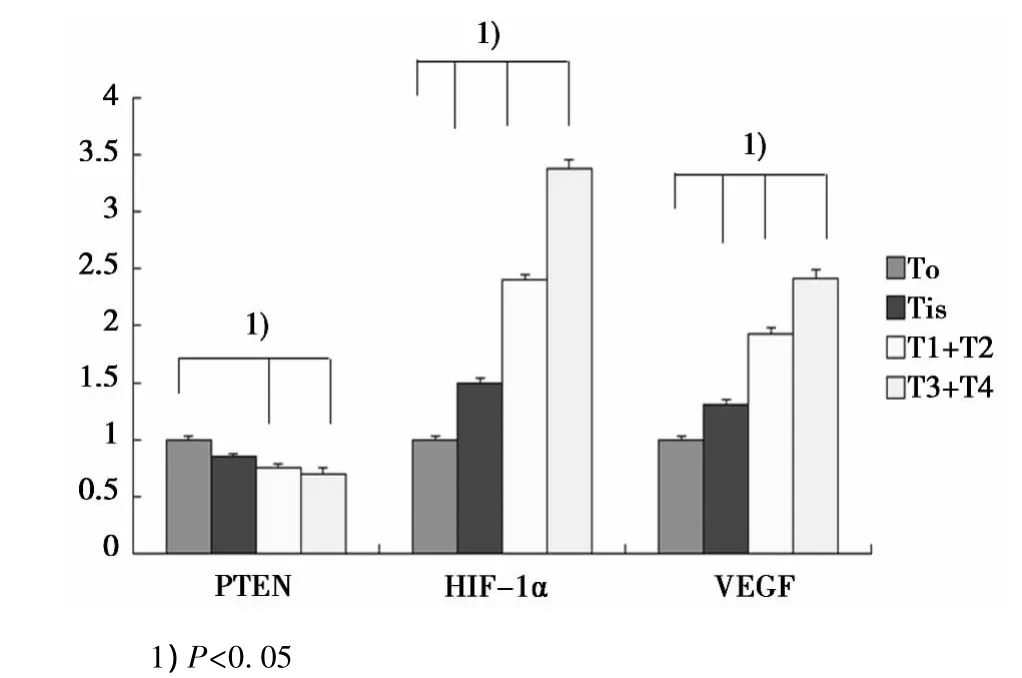
图2 食管鳞癌患者组织内PTEN、HIF-1α及VEGF表达量(RT-PCR)
2.2 PTEN,HIF-1α,VEGF与食管鳞癌相关性研究 PTEN的表达与 HIF-1α VEGF的表达均具有显著相关性(r=-0.36,-0.68,均 P<0.05),而 HIF-1α 的表达量与 VEGF 表达量同样具有显著相关性(r=0.72,P<0.05)。
3 讨论
PTEN基因(MMAC1)是具有磷酸酶活性的抑癌基因,可通过抑制肿瘤细胞浸润和促进细胞凋亡等多种途径发挥抗癌作用,目前研究报道〔4,5〕了一些关于PTEN蛋白表达与食管癌关系的研究,而关于PTEN基因突变频率与食管癌的关系研究较少。HIF-1α是介导细胞对缺氧微环境进行适应性反应的关键性转录调控因子,于振涛等〔6〕研究表明HIF-1α不仅促进VEGF转录,也增强VEGF mRNA的稳定性,最终导致增加肿瘤血管生成。Mizokami等〔7〕研究表明,肿瘤抑制基因PTEN即具有抑制HIF-1α表达和降低HIF-1α稳定性的作用,肿瘤细胞中如果PTEN失活将不能阻断 HIF-1α的表达。故文献〔8〕显示HIF-1α在肺癌组织中表达特点是:与病理分期有关,分期越高表达越多;与淋巴转移是否转移无相关性;PTEN蛋白表达均与HIF-1α蛋白表达呈负相关。这与本文研究结果相符。VEGF是血小板源性生长因子(PDGF)家族的一个成员,也是迄今所发现的最重要的促血管生成因子。VEGF基因的表达受缺氧、多种细胞因子,类固醇激素,瘤基因,抑瘤基因产物及一些小分子物质等因素的调控。目前关于VEGF和HIF-1α共同表达的关系及相关性在胃癌、肝癌、子宫内膜癌、乳腺癌等研究〔9,10〕中有相关报道。
本研究发现,PTEN、VEGF与HIF-1α基因在所有食管鳞癌患者组织中的表达量与肿瘤分期具有显著相关性,预示这三种蛋白的表达可能与食管鳞癌的治疗和预后具有显著关系,为开发新的抗食管癌药物、寻找新的基因治疗靶位提供理论依据,同时为临床治疗食管癌提供新的思路。
1 Vasudevan KM,Burikhanov R,Goswami A,et al.Suppression of PTEN expression is essential for anti-apoptosis and cellular transformation by oncogenic ras〔J〕.Cancer Res,2007;67(21):10343-50.
2 Gao P,Wange RL,Zhang N,et al.Negative regulation of CXCR4-mediated chemotax is by the lipid phosphatase activity of tumor suppressor PTEN〔J〕.Blood,2005;106(8):2619-26.
3 Huang J,Kontos CD.PTEN modulates vascular endothelial growth factormediated signaling and angiogenic effects〔J〕.J Biol Chem,2002;277(13):10760-6.
4 朱 红,周龙明.肝癌组织PTEN基因及其相关因子HIF-1α表达的研究〔J〕.交通医学,2010;24(4):369-74.
5 戴珍珍,丛玲华.PTEN和HIF-1α蛋白在肺癌组织中的表达及相关性研究〔J〕.全科医学临床与教育,2011;9(1):8-10.
6 于振涛,赵华锋,尚晓滨,等.鳞癌中缺氧诱导因子-1α、血管生成因子在食管鳞癌中的表达及临床病理意义〔J〕.中华医学杂志,2008;88(35):2465.
7 Mizokami Y,Li J,Zhang X,et al.Hypoxia-inducible factor-1 independent regulation of vascular endothelial growth factor by hypoxia in colon caneer〔J〕.Cancer Res,2004;64(5):1765-72.
8 沈承澜,沈振斌.血管内皮生长因子、缺氧诱导因子-1α在胃癌中的表达及其对预后影响的研究〔J〕.中国全科医学,2010;13(8A):2460-6.
9 郑青平,陈龙华.肝癌组织VEGF、HIF-1α和MMP-2表达的临床研究〔J〕.广西医药,2008;30(3):301-10.
10 孟晓云,陈 跃.Glut1、VEGF、HIF-1α在乳腺癌中的表达和临床意义〔J〕.中国现代医学杂志,2008;18(11):1557-64.
