艾司洛尔对脓毒症大鼠心肌细胞β肾上腺能受体及血流动力学的影响
2014-12-03刘德红刘映峰孟新科徐志伟南方医科大学珠江医院心血管内科广东广州50280
刘德红 刘映峰 孟新科 徐志伟 (南方医科大学珠江医院心血管内科,广东 广州 50280)
脓毒症是指由感染引起的失控性全身炎症反应综合征(SIRS),是临床常见的危重症,主要表现为血流动力学不稳定和组织细胞氧代谢障碍,其病死率已经超过心肌梗死,成为重症监护病房内非心脏病人死亡的主要原因〔1〕。近年来,尽管抗感染治疗和器官功能支持技术取得了长足的进步,脓毒症的病死率仍高达30%~70%。脓毒症治疗花费高,医疗资源消耗大,严重影响人类的生活质量,已经对人类健康造成巨大威胁。艾司洛尔作为一种超短效高选择性的β1肾上腺素能受体阻断药,临床上常用于防治严重的心律失常,同时通过减少氧自由基生成,抑制中性粒细胞浸润等机制对心肌起到保护作用。本研究通过观察艾司洛尔对脓毒症大鼠β肾上腺能受体及心脏血流动力学的影响,旨在探讨艾司洛尔改善重度脓毒症血流动力学异常的可行性。
1 材料与方法
1.1 实验动物与分组 7~8周龄的雄性清洁级SD大鼠60只(购自北京华阜康生物科技股份有限公司,许可证号为SCXK(京)2009-0004),体重(250±25)g,随机分为假手术组、脓毒血症组、艾司洛尔组,每组20只。
1.2 实验药物及仪器 盐酸艾司洛尔注射液(山东齐鲁制药有限公司,批号04120042,规格0.2 g/2 ml),血流动力学数据由MedLab生物信号采集处理系统(南京美易科技有限公司)采集处理。
1.3 动物模型制备 实验前12 h禁食,自由饮水,依照文献〔1,2〕行盲肠结扎穿孔术(CLP)复制脓毒症动物模型。10%水合氯醛腹腔注射麻醉,固定后沿中下腹正中线切口2 cm,暴露腹腔脏器,探查并找到盲肠。假手术组找到盲肠后即刻缝合腹壁切口,术后经股静脉滴注生理盐水10 ml/kg;脓毒血症组采用7号丝线距盲肠根部1.5 cm,血管弓内结扎盲肠,采用CLP复制脓毒症模型,术后同样经股静脉滴注生理盐水10 ml/kg。艾司洛尔组同样复制脓毒症模型,术后经股静脉滴注艾司洛尔0.2 mg/kg体重。记录各组手术后相关指标至18 h止。
1.4 指标检测 各大鼠腹腔麻醉后行股动脉插管,通过压力传感器连接于MedLab生物信号采集处理系统,观察并记录术后6、12、18 h平均动脉压(MAP);行左心室插管,通过该系统记录左室收缩曲线;并记录心电图。计算左室舒张末压(LVEDP)、左心室收缩压(LVSP),左心室最大收缩速率(+dP/dt),左室最大舒张速率(-dP/dt)和心率(HR)。分别于术后0.5、2、4、6 h,采用放射配基法测定心肌细胞β肾上腺能受体活性。
1.5 统计学方法 应用SPSS13.0软件进行单因素方差分析。
2 结果
2.1 术后各组大鼠MAP比较 与假手术组比较,脓毒症大鼠手术后6 h始即出现MAP的明显下降(P<0.01)。艾司洛尔组的MAP 6 h时与脓毒血症组大鼠有提高,随着时间延长,差异逐渐增大,12 h时为P<0.01。见表1。
表1 术后各组大鼠平均动脉血压比较(s,n=20,mmHg)
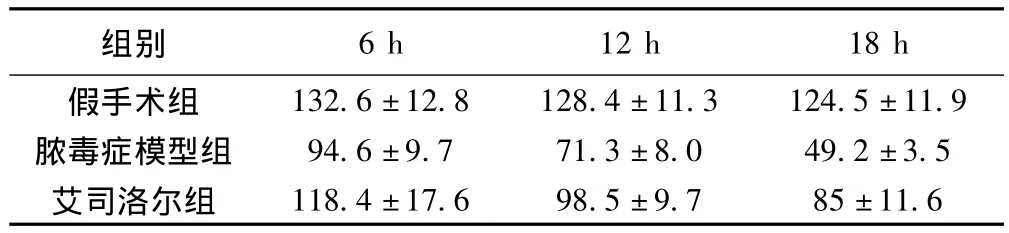
表1 术后各组大鼠平均动脉血压比较(s,n=20,mmHg)
132.6 ±12.8 128.4 ±11.3 124.5 ±11.9脓毒症模型组 94.6 ±9.7 71.3 ±8.0 49.2 ±3.5艾司洛尔组6 h 12 h 18 h假手术组组别118.4 ±17.6 98.5 ±9.7 85 ±11.6
2.2 术后各组大鼠HR变化 脓毒症组大鼠手术后6 h HR较假手术组略有增高,12 h时HR即开始明显降低(P<0.01),而艾司洛尔组6 h时HR与脓毒症组差异无统计学意义(P>0.05),但自12 h开始HR较脓毒症组明显提高(P<0.05)。
2.3 术后各组大鼠心功能比较 与假手术组比较,脓毒症大鼠的LVEDP、LVSP、+dP/dt及-dP/dt自6 h始即出现均降低,而艾司洛尔组各项指标比脓毒症组显著提高(P<0.01)。见表2~表4。
表2 术后6 h各组大鼠心脏血流动力学指标比较( s,n=20)

表2 术后6 h各组大鼠心脏血流动力学指标比较( s,n=20)
组别HR(次/min)LVEDP(mmHg)LVSP(mmHg)49脓毒症模型组498±51 3.68±0.8473.44±5.212 459±147 3 111±186艾司洛尔组 476±34 4.74±0.4979.48±1.652 756±304 3 344±129+dP/dt -dP/dt假手术组 452±36 5.69±0.2386.68±5.482 827±247 3 627±1
表3 术后12 h各组大鼠心脏血流动力学指标比较( s,n=20)

表3 术后12 h各组大鼠心脏血流动力学指标比较( s,n=20)
组别HR(次/min)LVEDP(mmHg)LVSP(mmHg)46脓毒症模型组357±29 3.01±0.5167.72±8.412 240±124 2 627±420艾司洛尔组 398±29 4.08±0.5474.05±6.412 547±189 3 119±124+dP/dt -dP/dt假手术组 449±38 5.43±0.2482.42±5.692 789±421 3 562±2
表4 术后18 h各组大鼠心脏血流动力学指标比较( s,n=20)

表4 术后18 h各组大鼠心脏血流动力学指标比较( s,n=20)
组别HR(次/min)LVEDP(mmHg)LVSP(mmHg)80脓毒症模型组278±30 2.45±0.1960.51±1.282 001±210 2 339±162艾司洛尔组 412±51 3.76±0.4769.98±4.872 299±421 2 974±148+dP/dt -dP/dt假手术组 436±48 5.42±0.4578.94±8.172 664±340 3 498±4
2.3 术后各组大鼠心肌细胞β肾上腺能受体活性变化 假手术组和脓毒症模型组各时间点β肾上腺能受体活性均无明显变化;对应时点脓毒症模型组合艾司洛尔组β肾上腺能受体活性明显较假手术组低(P<0.05);0.5 h艾司洛尔组β肾上腺能受体活性明显高于脓毒症模型组(P<0.05)。见表5。
表5 不同时间点术后各组大鼠心肌细胞β肾上腺能受体活性变化( s,fmol/mgpr,n=20)

表5 不同时间点术后各组大鼠心肌细胞β肾上腺能受体活性变化( s,fmol/mgpr,n=20)
.77 ±10.19脓毒症模型组 89.15 ±7.36 87.64 ±6.93 91.22 ±8.38 89.67 ±7.49艾司洛尔组 147.43 ±8.73 92.36 ±8.33 93.81 ±9.09 87.78 ±7.90 0.5 h 2 h 4 h 6 h假手术组 197.27 ±11.56 196.36 ±10.79 198.18 ±12.03 196组别
3 讨论
脓毒症本质是多种因素引起的全身性炎症反应所导致的复杂的多系统的临床动态变化过程,其发病率和死亡率一直保持着较高的水平。近年来,随着对其发病机制和病理生理变化研究的深入,发现脓毒症患者血清肌钙蛋白-I(cTnI)、血清肌酸激酶同工酶水平明显升高,表明脓毒症时有心肌损伤存在,Ammann等〔3〕证实,脓毒症和脓毒性休克能引起血清cTnI升高。感染性休克犬在休克1 h后血清cTnI升高达50%,在脓毒症、脓毒性休克患者中血清 cTnI升高31% ~80%〔4,5〕。临床上认为cTnI的升高即意味着心肌的损伤或坏死,并且cTnI升高的幅度常反映心肌细胞损伤的程度。同时有数据表明脓毒症诱导的心肌功能障碍是造成脓毒症预后不良的重要原因之一,约40%~50%的脓毒症患者可并发心功能不全,出现严重心衰者约7%〔6〕。因此,如何有效预防和治疗脓毒症诱导的心肌功能障碍是脓毒症治疗方案中的重要组成部分。艾司洛尔是一种超短效高选择性β1受体阻滞剂,分布半衰期约为2 min,消除半衰期约为9 min,停药后20~30 min内临床作用基本消失。本研究结果说明脓毒症大鼠出现心肌细胞β肾上腺能受体活性降低;艾司洛尔能提高脓毒症大鼠β肾上腺能受体活性,且起效快,2 h及以后作用不明显。
另外,在本实验中,脓毒症模型大鼠手术后出现动脉压的下降,而艾司洛尔组能增高其MAP,提示艾司洛尔有提高脓毒症大鼠MAP的作用;而术后6 h,各组大鼠均出现不同程度的HR增快,考虑系应激反应代偿所致,而12 h开始,由于失代偿出现心脏抑制,HR减慢,同样,艾司洛尔能调节大鼠HR,使代偿期大鼠HR减慢,而失代偿期大鼠HR增快。重要的是,艾司洛尔对心功能的改善非常明显。LVSP主要反映心肌的收缩能力,LVEDP代表左心室前负荷,间接反映心室的舒张顺应性,+dP/dt及-dP/dt在一定程度上反映室壁张力的变化速度,是反映左心室收缩和舒张期心肌功能的敏感指标。本研究发现艾司洛尔能显著改善上述指标,提示其能改善脓毒症模型大鼠的心脏收缩和舒张功能失常,在预防和治疗脓毒症诱导的心肌功能障碍中能起到重要的作用。
多项研究显示,艾司洛尔具有明显的心肌保护作用〔7〕,可能机制有:通过其β1受体阻滞作用减少心肌细胞内ATP的消耗;降低蛋白激酶A的活性;减少钙离子内流;减轻缺血再灌注引起的细胞内钙超载;抑制血小板聚集等〔8〕。Simon等〔9〕观察到用非选择性β受体阻断剂普萘洛尔预处理的心肺复苏后大鼠心肌损伤程度明显减轻,心功能改善。在心脏手术中,儿茶酚胺浓度在血液循环和心肌局部剧增,引起心肌β肾上腺素能受体-环磷酸腺苷(β-AR-cAMP)系统失敏,从而影响心脏血流动力学,影响心脏功能的恢复。作为超短效的选择性β1-受体阻滞剂,艾司洛尔在心肌中,通过竞争儿茶酚胺结合位点而抑制β1-受体,预防β-AR-cAMP系统失敏,达到减缓静息和运动心率,降低血压,降低心肌耗氧量的作用,从而改善心脏血流动力学,改善心功能。
综上,艾司洛尔用于辅助治疗脓毒症可有助于稳定HR,改善心脏血流动力学从而起到改善心功能,保护心肌细胞的作用,但是据报道其产生的β受体阻滞作用呈剂量依赖性〔10〕,因此改变不同的艾司洛尔的剂量是否会对其保护作用产生影响以及其对脓毒症模型大鼠的预后等数据尚需进一步的研究。
1 Hubbard WJ,Choudhry M,Schwacha MG,et al.Cecal ligation and puncture〔J〕.Shock,2005;1:52-7.
2 Iskander KN,Craciun FL,Stepien DM,et al.Cecal ligation and punctureinduced murine sepsis does not cause lung injury〔J〕.Crit Care Med,2013;41(1):159-70.
3 Ammann EM,Tanasijevic M,Thompson R,et al.Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute cornoary syndrome〔J〕.N EngI J Med,1996;335(18):1342-9.
4 Ammann P,Fehr T,Minder EI,et al.Elevation of troponin I in sepsis and septic shock〔J〕.Int Care Med,2001;27(6):965-9.
5 Ver Elst KM,Spapen HD,Nguyen DN,et al.Cardiac troponins I and T are biological markers of left ventricular dysfunction in septic shock〔J〕.Clin Chem,2000;46(5):650-7.
6 Jeanneret S,Sanchez B,Liaudet L.Pathophysiological mechanisms and treatment of septic shock-induced vasoplegia〔J〕.Rev Med Suisse,2011;7(321):2435-8.
7 Rousseaux J,Grandbastien B,Dorkenoo A,et al.Prognostic value of shock index in children with septic shock〔J〕.Pediatr Emerg Care,2013;29(10):1055-9.
8 Wiest DB,Haney JS.Clinical pharmacokinetics and therapeutic efficacy of esmolol〔J〕.Clin Pharmacokinet,2012;51(6):347-56.
9 Simon F,Giudici R,Duy CN,et al.Hemodynamic and metabolic effects of hydrogen sulfide during porcine ischemia/reperfusion injury〔J〕.Shock,2008;30(4):359-64.
10 Moon YE,Hwang WJ,Koh HJ,et al.The sparing effect of low-dose esmolol on sevoflurane during laparoscopic gynaecological surgery〔J〕.J Int Med Res,2011;39(5):1861-9.
