Osx基因活化技术促进种植体周围骨再生的实验研究
2014-12-02黄国倩李大鲁李肇元
黄国倩,李大鲁,李肇元
(济南市口腔医院,济南250001)
经典的组织工程骨由种子细胞、成骨因子和支架材料组成,通过填充骨缺损、发挥骨传导和骨诱导作用来完成骨的修复与重建。但是体外组织工程骨的构建步骤繁琐,费用高,操作周期长,对患者损伤大;而且老年患者的骨髓间充质干细胞占骨髓细胞的比例相应减少,细胞增殖率下降且体内成骨能力明显减低;同时外源性成骨因子在体内易流失和失去活性,作用持续时间短,效价低,成本高,可能会诱发机体免疫反应。2010年6月~2011年3月,我们通过基因技术将编码与骨组织再生相关的生长因子基因片段转移至种子细胞中,使种子细胞持续高效表达促骨生长因子,促进骨的形成。
1 材料与方法
1.1 材料 实验动物:选用健康雄性12个月龄Beagle犬(山东省医药工业研究所提供,符合国际实验动物要求)15只,体质量9~12 kg。犬均采用笼中独立圈养的方法,定时、定量摄食,自由饮水,适应性饲养2周后进行实验。实验过程中对动物处置符合2006年科学技术部发布的《关于善待实验动物的指导性意见》。主要药品及器材设备:质粒pcDNA3.1 flag-Osx、大肠杆菌 E.coli DH5α 感受态、Biogide可吸收性胶原骨膜。
1.2 方法
1.2.1 质粒 pcDNA3.1flag-Osx的扩增 使用 Qiagen质粒大提试剂盒从大肠杆菌E.coli DH5α中纯化提取质粒 pcDNA 3.1 flag-Osx。
1.2.2 动物实验
1.2.2.1 术前准备 制备Osx基因活化材料倍骼生+冻干质粒,在无菌操作台上将0.5 g倍骼生准备好,使用冻干机24 h冻干质粒备用,每个骨缺损处放置1.2 mg质粒。
1.2.2.2 手术过程 实验犬下肢外侧区域备皮,局部消毒后行静脉注射戊巴比妥钠溶液麻醉(戊巴比妥钠与0.9%氯化钠注射液配成浓度为1%~3%的溶液),麻醉注射剂量为30 mg/kg;待麻醉起效后,将实验犬卧位固定于手术台上,开口器固定。每只动物拔除左侧下颌第2前磨牙(标记为部位A)及右侧下颌第2前磨牙(标记为部位B),在拔牙创周做梯形切口,翻瓣,用超声骨刀于拔牙创颊侧制备颊舌向5 mm、近远中向5 mm、垂直高度10 mm的骨缺损,分别植入直径3.3 mm、长度13 mm的奥齿泰 GSII种植体,A处骨缺损区填入倍骼生+空载体pcDNA3.1flag(为A组);B处骨缺损区填入倍骼生+pcDNA3.1flag-Osx(为 B组)。应用GBR技术,在材料表面覆盖Bio-gide胶原膜,严密缝合牙龈。
1.2.2.3 CT 扫描 分别于术后 4、8、12 周各处死5只动物,取含种植体近远中向至少6 mm的下颌骨,包括颊舌侧牙龈及软组织,制备成约15 mm×6 mm×20 mm的组织块。用生理盐水冲洗标本,固定于4%甲醛48 h。将标本置于GE公司Explore Locus Micro-CT标本检测台上并牢固固定,注意保持种植体长轴与扫描室切面垂直,沿标本的长轴方向扫描,获取连续的Micro-CT图像。选定兴趣区域(ROI),CT值高于1 000定为骨组织。距离骨缺损上下缘2 mm,骨缺损左、右侧1 mm处分别选定2 mm×1 mm×1 mm大小的组织2块,记为ROI1、ROI2。进行扫描图像的三维重建后,采用直接法和间接法计算评估。检验参数包括:骨小梁体积(BV)、骨体积分数(BVF)、骨小梁间隙(TbSp)、骨小梁厚度(TbTh)、骨小梁数目(TbN)、结构模型指数(SMI)。
1.2.3 统计学方法 应用 SPSS17.0统计软件,计量资料以±s表示,组间比较进行配对t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 动物一般情况 术后各观察时期内实验动物均健康存活,创口愈合良好,无炎症反应,经术后3 d的抗生素肌注,术后1周炎症反应基本消退予以拆除缝线。术区无感染、无生物膜暴露、无软组织裂开等并发症。
2.2 两组CT扫描数据比较 两组术后4、8、12周TbSp、TbTh 、TbN、SMI、BVF、BV 比较见表 1。
表1 两组术后 4、8、12 周 TbSp、TbTh 、TbN、SMI 、BVF、BV 比较(±s)
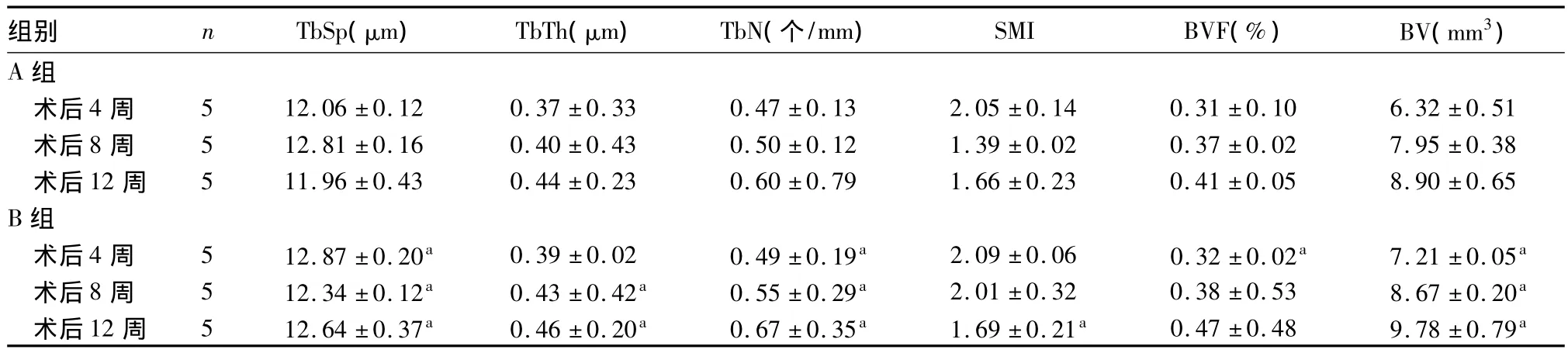
表1 两组术后 4、8、12 周 TbSp、TbTh 、TbN、SMI 、BVF、BV 比较(±s)
注:与A组同时间比较,aP<0.05
组别 n TbSp(μm) TbTh(μm) TbN(个/mm) SMI BVF(%) BV(mm3)A 组术后4 周 5 12.06 ±0.12 0.37 ±0.33 0.47 ±0.13 2.05 ±0.14 0.31 ±0.10 6.32 ±0.51术后8 周 5 12.81 ±0.16 0.40 ±0.43 0.50 ±0.12 1.39 ±0.02 0.37 ±0.02 7.95 ±0.38术后12 周 5 11.96 ±0.43 0.44 ±0.23 0.60 ±0.79 1.66 ±0.23 0.41 ±0.05 8.90 ±0.65 B组术后4 周 5 12.87 ±0.20a 0.39 ±0.02 0.49 ±0.19a 2.09 ±0.06 0.32 ±0.02a 7.21 ±0.05a术后8 周 5 12.34 ±0.12a 0.43 ±0.42a 0.55 ±0.29a 2.01 ±0.32 0.38 ±0.53 8.67 ±0.20a术后12 周 5 12.64 ±0.37a 0.46 ±0.20a 0.67 ±0.35a 1.69 ±0.21a 0.47 ±0.48 9.78 ±0.79a
3 讨论
3.1 Osx基因及其表达和调控 Osx[1]是近年发现的成骨细胞分化和骨形成过程中所必需的转录因子,尤其在成骨细胞终末分化成熟过程中发挥重要作用。人Osx基因编码产物为特异蛋白7(SP7),是含有428个氨基酸的蛋白质,羧基末端有3个连续的Cys2-His2锌脂结构,该锌脂结构可与真核细胞启动子结合调控基因的转录[2]。Bowman 等[3]比较了Osx基因和其他SP家族成员序列后发现,Osx具有一个独立的蛋白序列谷氨酸转导活化区,而且在锌脂结构外有一个富含脯氨酸区域。脯氨酸富含区是BMP信号通路中重要的结合区,对成骨细胞的分化非常重要。有人认为Osx基因是核结合因子(Cbfal)的下游基因,Cbfal是成骨细胞分化最关键的作用因子。在Osx基因剔除小鼠胚胎中,成骨细胞的分化受到阻碍,各种成骨分化标志的表达水平也严重降低或缺如。其中骨钙素作为一种高度特异性的晚期成骨细胞标志物的表达缺失,说明成骨细胞的分化、成熟被完全阻断[4]。染色发现,Osx(-/-)小鼠胚胎中无矿化反应、完全丧失骨形成能力,新生的Osx(-/-)小鼠出生后即因呼吸困难死去。由此可见,Osx是成骨细胞分化和骨发育不可缺少的调节因子[5,6]。
3.2 基因活化技术 基因治疗本质上是向细胞导入特异性的基因信号,合成和分泌一种基因产物(蛋白质)的过程[7]。干细胞在转染成骨基因后,可以出现自分泌和旁分泌现象[8]。在这个过程中,细胞介导的生长因子合成与细胞本身的靶受体更加紧密地联系在一起,增强了机体对基因治疗的反应强度和持续性[9]。加上转染的修饰作用,基因转染的干细胞所分泌的生长因子可能具有更高的生物学活性。基因活化材料是专为组织工程设计的转基因材料。基因活化技术是一种直接的基因转移技术,也可以看成是组织工程概念的延伸。一个基因活化材料包含一个三维的转基因载体和生物可降解结构基质[10],载体作为一种保存原位 DNA的支架持续发挥作用至内源性的修复细胞到达。与载体联合的携带编码细胞因子和生长因子基因的DNA会表达所需要起治疗作用的基因。当基因活化材料植入组织缺损区时,其中的DNA随着材料的溶胀、降解而释放出来,材料内的种子细胞或周边组织细胞与释放出来的基因成分结合,或黏附在材料表面,通过内吞方式获取治疗基因片段,表达、合成治疗因子并作用于周围细胞。这样即可持续的使细胞因子少量表达,引起局部修复应答,以实现组织再生。
基因活化基质采用体内被动方式转染基因,操作简单,能节约费用和减少对患者的损伤,在促进局部组织尤其是骨组织损伤修复方面有明显的优势。种植体周围骨缺损的修复是一个长期的过程,生长因子在局部长期表达有利于骨的重建,而且质粒DNA在血液中的高分解率使其不会造成全身中毒。这种直接将基因传递到靶细胞的方法在临床应用的可能性很大,因此我们采用基因活化材料来修复犬种植体周围的骨缺损,并观察其疗效。通过CT检查发现[11],本研究中Osx植入种植体颊侧骨缺损处的A组与无Osx植入的B组比较,TbSp、TbN、BVF、BV均有统计学差异。显示应用Osx基因激活基质可有效促进种植体颊侧骨缺损处新骨的形成。目前应用基因治疗促进种植体周围新骨形成的研究尚少,本实验结果可以为进一步研究Osx基因在临床的应用打下基础。
[1]Nakashima K,Zhou X,Kunkel G,et al.The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J].Cell,2002,108(1):17-29.
[2]Gao Y,Jheon A,Nourkeyhani H,et al.Molecular cloning,structure,expression,and chromosomal localization of the human Osterix(SP7)gene[J].Gene,2004,341:101-110.
[3]Bowman P,PhiliPsen S.Regulation of the activity of sp1-related transcription facotrs[J].Mol Cell Endocrinol,2003,195(1-2):27-38.
[4]Saito Y,Yoshizawa T,Takizawa F,et al.A cell line with characteristics of the periodontal ligament fibroblasts is negatively regulated for mineralization and Runx2/CbfaI/Osf2 activity,part of which call be overcome by bone morphogenetic protein-2[J].J Cell Sci,2002,115(pt 21):4191-4200.
[5]Ohyama Y,Nifuji A,Maeda Y,et al.Spaciotemporal association and bone morphogenetic protein regulation of sclerostin and osterix expression during embryonic osteogenesis[J].Endocrinology,2004,145(10):4685-4692.
[6]孟国林,胡蕴玉.基因治疗在骨科疾病治疗中的探索性应用[J].中华矫形外科杂志,2000,7(10):1005-1007.
[7]Nussenbaum B,Teknos TN,Chepeha DB.Tissue engineering:the current status of this futuristic modality in head neck reconstruction[J].Curr Opin Otolaryngol Head Neck Surg,2004,12(4):311-315.
[8]Morizono K,De Ugarte DA,Zhu M,et al.Multilineage cells from adipose tissue as gene delivery vehicles[J].Hum Gene Ther,2003,14(1):59-66.
[9]Einhorn TA.Clinical applications of recombinant human BMPs:early experience and future development[J].J Bone Joint Surg Am,2003,85A(Suppl 3):82-88.
[10]Evans CH,Ghivizzani SC,Robbins PD.Orthopedic Gene Therapy in 2008[J].Mol Ther,2009,17(2):231-244.
[11]Butz F,Ogawa T,Chang TL,et al.Three-dimensional bone-implant integration profiling using micro-computed tomography[J].Int J Oral Maxillofac Implants,2006,21(5):687-695.
