紫草多糖的提取、纯化及药理作用研究进展
2014-12-02朱沛沛李涛涛赵伟龙袁磊线梦瑶
朱沛沛,李涛涛,赵伟龙,袁磊,线梦瑶
(陕西理工学院化学与环境科学学院,陕西 汉中723001)
紫草(Lithospermumerythrorhizon),又名茈草,紫丹,地血,红石根,是紫草科草本植物紫草的根,国内分布广泛,以新疆所产紫草品质最佳。紫草味甘、性寒、归心包络,有凉血、活血、清热解毒等功效[1],作为中草药在我国已经有几千年的应用历史,其根药用,始载于《神农本草经》。 紫草中含有萘醌类、单萜苯醌、苯酚类、酚酸类以及多糖类等多种具有生物活性的物质[2]。
多糖是一类非特异性免疫增强化合物,能提高机体的免疫功能,具有抗衰老、抗癌、抗病毒等作用,受到人们的普遍重视,进行了相关的研究和开发。我国十分重视糖类药物的开发,国家科技部已经把“糖生物学与重大疾病发生发展的机制研究” 列入了未来十年对生物经济起引领作用的重大生命科学的应用基础研究课题。 近年来的研究成果表明,紫草多糖具有抗病毒、调节免疫力、抗肿瘤、抗辐射及降血糖降血脂等功能[3],已经逐步应用到日化、医药及保健食品等领域。本文系统介绍紫草多糖的研究进展,旨在为紫草多糖的研究及应用提供有益的参考。
1 紫草多糖含量的测定
目前紫草多糖含量的测定方法包括高效液相色谱法(HPLC)、紫外分光光度法及薄层扫描法。在测定紫草多糖含量之前,要进行显色反应,显色方法包括苯酚-硫酸法、 蒽酮-硫酸法、3,5-二硝基水杨酸法、斐林法,其中苯酚-硫酸法重现性好,精确度高,受实验温度及时间的影响最小,是紫草多糖含量测定最常用的显色方法。 其原理是利用多糖或寡糖被浓硫酸在适当高温下水解,产生单糖,并迅速脱水成糠醛或其衍生物,然后再与α-萘酚、间苯二酚或苔黑酚(orici-nol,即5-甲基-1,3-间苯二酚)等酚类缩合或胺类化合物缩合。其中苯酚-硫酸法可用于甲基化的糖、戊糖和多聚糖的测定,依据糖经浓硫酸处理后脱水产生糠醛或糠醛衍生物,再与苯酚缩合生成橙黄色物质,于490.00 nm 处比色。 其化学反应过程如图1 所示。
第一步:糖类遇浓硫酸脱水:
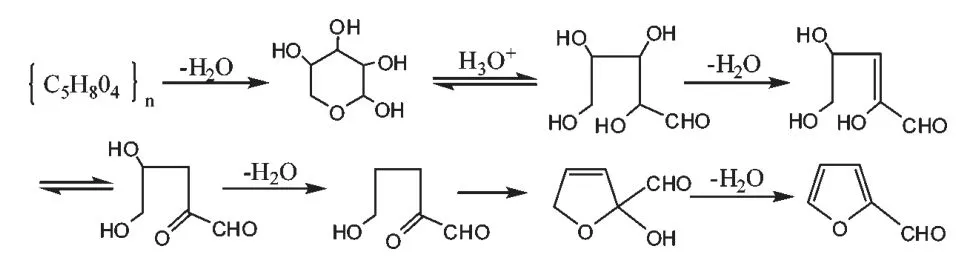
第二步:糠醛与苯酚缩合显色:
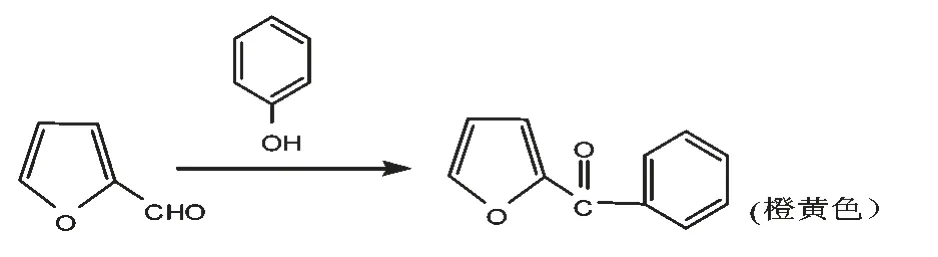
图1 苯酚-硫酸法测定还原性糖原理
紫外分光光度法由于其方便快捷在紫草多糖的定量分析测定中应用较广泛,但其测定的多糖纯度低,易受外界实验条件的影响,准确性难以保障。 高效液相色谱法选择性高并且可以排除多糖中与蒽酮-硫酸反应时反应的杂质,得到紫草样品多糖的绝对含量。 薄层扫描法(TLCS)系指用一定波长的光照射在薄层板上对薄层色谱中有紫外或可见光吸收的斑点或经照射能激发产生荧光的斑点进行扫描,将扫描得到的图谱及积分值用于药品质量检查的方法。 该方法所需溶剂较少,样品分离效果较好。 在实际应用中可以根据实验要求、合理性及准确性选择合适的方法测定紫草多糖含量。
2 紫草多糖的提取及纯化
2.1 紫草多糖的提取
有关紫草多糖的研究报导不多,主要集中在紫草多糖的提取方面。 目前使用的提取方法主要包括超声波提取、溶剂提取、酶提取、微波提取及各种提取方法联用提取。 提取大多采用水作为提取剂,安全环保且提取经济价值高。其他提取方法的适用性及经济性还有待研究者探索。
2.1.1 超声波提取法
超声波提取法是应用超声波对媒质产生的机械振动和空化作用进行物理破碎,强化天然产物的提取的一种新兴的生物提取技术。 超声波振动产生并传递强大的能量,使媒质的运动加速继而使结构发生变化,促使有效成分进入溶剂中。同时超声波还具有热效应、乳化、扩散、击碎、化学效应、生物效应、凝聚效应等许多次级效应,可加快提取物的溶解及扩散速度。
李芳等[4]运采用超声技术辅助水提醇沉法从新疆紫草中提取多糖并用酚-硫酸比色法测定多糖含量,结果表明多糖含量达2.267%,RSD=0.48%(n =6)。 实验结果表明,超声波提取技术反应速度快,收率高。
超声波提取技术因其操作简便、时间短、产率高、 能耗低及产物易分离提纯等优点而得到广泛应用,用于紫草多糖的提取优势明显,是近年来紫草多糖提取领域的研究热点,也是今后工业化生产的发展趋势。此外,超声波还具有一定的杀菌作用,同时其絮凝作用使得浸出液易澄清过滤,有利于后期产品的精制纯化。 但其大功率的发生器产生的噪音对人体健康有一定的潜在危害,如需大规模工业化生产还需进一步改善。
2.1.2 溶剂提取法
溶剂提取法作为植物多糖常用的提取方法,首先要考虑选择何种溶剂才能将目标产物完全提取,选择时一般都遵循相似相溶原则。多糖属极性大分子化合物,水和醇等极性强的溶剂有利于其提取。水是典型的强极性溶剂,对植物组织的穿透力强,提取效率高,使用安全且提取成本低,是植物多糖提取的首选溶剂。
用水作溶剂提取植物多糖时,可采用热水浸煮提取,也可以用冷水浸提。水提取的多糖多数是中性多糖。一般植物多糖提取多数采用热水浸提法,该法所得多糖提取液可直接或离心除去不溶物,减少了纯化工段的程序。 朱艳红等[5]以水作为提取剂对紫草多糖进行提取,并采用正交实验对工艺进行优化,得到最佳提取工艺:煎煮3 次,加水15 倍量,煎煮1 h,优选得到的工艺经济、简单、稳定、可行。
溶剂提取是传统的提取方法,具有操作简单、不需特殊设备、成本低等优点,是目前紫草多糖广泛应用的提取方法。 但此法提取率低、 费时,而且提取物纯度差,因此有逐渐被淘汰的趋势。
2.1.3 酶提取法
酶技术能够降低提取条件,在比较温和的环境下分解植物组织,加速多糖的渗出,有助于提取,同时还能够有效地保护提取成分,可用于紫草多糖的工业化生产。 常用的酶有蛋白酶、 纤维素酶、果胶酶等。
虽然酶法提取紫草多糖的应用起步较晚,但高效的提取效果及低能耗等优点使得其推广较快,备受关注。同时酶法和其他提取方法联用能够更好地提高提取率。 李倩等[6]研究了超声波复合酶法提取软紫草多糖,采用正交实验优化得到超声波复合酶法提取软紫草多糖的最佳工艺: 超声处理时间40 min,料液比1∶12,功率160 W,酶解时间40 min,酶解温度55 ℃,pH =5.5,纤维素、果胶酶、蛋白酶添加量均为2%,多糖的提取率达4.46%,表明超声波复合酶法双重处理可显著提高软紫草多糖的提取率。
酶解法提取工艺简单、条件温和、节能环保,符合21 世纪可持续发展战略的要求,还可以保护提取物有效组分,提高目标产物的药用价值,但单独使用酶解法提取紫草多糖提取效果不理想,所以今后的研究应主要集中在与多种高效的提取方法结合联用的方向,结合各提取方法的优点提高紫草多糖的提取率。
2.1.4 微波提取法
微波辐射过程产生的高频电磁波能够穿透萃取介质,到达物质的内部,由于吸收微波能,细胞内迅速升温,细胞壁压力增大膨胀破裂,细胞内有效成分流出,溶解到提取剂中,通过进一步过滤和分离,即得到萃取物质。 此外,微波所产生的电磁场能加速被萃取成分向萃取剂界面的扩散速率。该法提取时间短,提取率高,是强化固液提取过程颇具发展潜力的一项新型辅助提取技术。
曲晓兰等[7]研究了水提醇沉法提取紫草多糖的工艺条件,采用苯酚-硫酸比色法于490 nm 波长处测定其多糖含量。 结果测得紫草中多糖含量为2.93%,平均回收率为99.28%,RSD=1.22(n=5)。 杨秀芳[8]以水为介质进行了微波场协同提取紫草多糖的研究,得到了微波场协同提取紫草多糖的最佳工艺参数:水和紫草质量比15∶1,时间8 min,微波功率320 W,提取2 次,合并滤液,浓缩,用无水乙醇沉淀,水洗滤饼干燥后即得粗产品,紫草多糖含量为6.46%。
微波辅助提取技术一般只需数分钟就能达到其他提取技术的提取效果,具有萃取时间短、产率高、能耗低、溶剂用量少等优点,使其在各个领域广泛应用。但微波升温迅速、较难控制且易破坏多糖分子结构,造成一定程度的分解失活,影响提取物产品质量,如何更好地调节时间及温度的平衡显得非常重要。
2.2 紫草多糖的纯化
初步提取所得多糖杂质含量较多,必须经过进一步的纯化才能得到高纯度多糖。 通过水提所获得的紫草粗多糖常含有较多的蛋白质和非糖成分。 纯化是为了除去粗活性多糖中的杂质而获得单一活性多糖组分的过程。 纯化的第一步就是将粗活性多糖中的非活性多糖组分除去,一般的程序是先除去蛋白后除去其它小分子杂质,再进行脱色去离子等步骤即得到纯度较高的紫草多糖。
2.2.1 除蛋白
传统的除蛋白方法有三氯乙酸法、 鞣酸法、Sevag e 法、Sevage 加蛋白酶、BECM 法等[9]。 酸沉淀法可以造成某些多糖的降解,使多糖得率受到影响;Sevage 法是用氯仿和正丁醇按5∶1 的比例混合后,加入粗多糖溶液中,在剧烈震动后,离心除去蛋白质,但该法使用氯仿和正丁醇作为试剂毒性较大,容易造成多糖活性下降和溶剂残留,而且效率也不高。 Sevage 加蛋白酶的方法是在Sevage 方法的基础上,加入蛋白酶进行分离的方法,该法虽然安全,但通常酶解不够充分,细化程度低。郭代英[10]采用了传统的Sevag e 法和3%三氯乙酸法除去无花果多糖提取物中蛋白类成分,结果显示,Sevag e 法蛋白质清除率稍低于3%三氯乙酸法,多糖损失率大于3%三氯乙酸法。 采用BECM 法除去蛋白,即将正丁醇、乙醇、氯仿、甲醇、NaCl 按一定比例混合制成一种特殊的试剂,然后加到多糖溶液中。 BECM 法[11]脱蛋白的结果表明,杂蛋白的去除率为99.98%,且工艺简单,无需大的动力和设备,大大降低了运转成本。
2.2.2 脱色
植物多糖的提取物大多含有酚类化合物,在提取过程中容易氧化生成其他色素,这类色素大多呈负性离子,它的存在会影响多糖的色谱分析和性质测定。活性炭吸收剂脱色应用于此类色素效果差,可用离子交换柱DEAE-纤维素、氧化剂(H2O2)、吸附剂(纤维素、硅藻土、活性炭等)或Duolite A-7 来吸附色素。树脂也是一种吸附性质的脱色剂,它的理化性质稳定,不溶于酸、碱及有机溶剂,对有机物选择性较好,不受无机盐类及强离子低分子化合物存在的影响,可以通过物理吸附从水溶液中有选择地吸附有机物质。 若糖与色素是结合的,易被DEAE 纤维素吸附,不能被水洗脱,这类色素可进行氧化脱色,一般以浓氨水或NaOH 液调至pH =8.0 左右,50℃以下滴加H2O2至浅黄色,保温2 h。陈祥娜[11]采用活性炭、DEAE-纤维素和DEAE-纤维素+1 mol/L NaCl 进行脱色实验比较。 从色泽变化来看,活性炭脱色效果最差,为棕黑色;DEAE-纤维素脱色效果最好,为棕黄色;DEAE-纤维素+1 mol/L NaCl 脱色效果次之,为深棕色。 由于DEAE-纤维素脱色后多糖的损失最大,DEAE-纤维素+1 mol/L NaCl 的脱色效果和DEAE-纤维素相差不大,综合考虑,DEAE-纤维素是一个相对较好的脱色材料,与1mol/L 的NaCl 配合使用效果最佳。
2.2.3 去离子
去离子是为进一步纯化及色谱分析做准备,也就是除去小分子杂质,如无机盐、脱蛋白残留溶剂、低聚糖等。 常用的方法有透析法、柱离子交换法和纤维滤器透析法。 透析法是最传统的去离子方法,它是利用一定孔目的膜,使无机盐或小分子糖透过,而将大分子的多糖截留下来,从而达到纯化多糖的目的。 在透析前要选择一种规格适宜的透析膜,以免样品损失。 纤维膜孔径为2 ~3 nm,可使单糖分子通过,分离效果较好,透析时常需要多次换水,溶液的pH 值维持在6.0 ~6.5 范围内。该法操作简单、技术成熟,但周期长,往往需要2 d ~3 d,常温下操作有可能造成多糖的霉变,必要时需加入少量防腐剂或需在低温条件下进行。 提取液除去蛋白后,分别通过阴阳离子交换树脂,也可以用G-25 以达到去离子作用,该法比较简单,但是增大了溶液的体积,影响多糖的沉淀结果。 纤维滤器透析法根据膜分离技术利用不同孔径的膜使大小不同的分子分级,以这种方式对大多数样品进行浓缩,速度很快,可缩短生产周期,而且条件温和,是多糖脱除杂质的一条新途径。
3 紫草多糖的药理作用
3.1 抗病毒作用
紫草在试管实验中发现,对京科68-1 病毒有抑制作用。 紫草水煎剂能延缓和减轻单纯疱疹病毒对乳兔肾细胞致病变作用的产生,紫草多糖在乳兔细胞上对单纯疱疹病毒Ⅰ型(HSV21)有明显的抑制作用,其抗病毒机制是在宿主细胞内抑制HSV21 的复制,同时紫草多糖亦有抗疱疹病毒地方株的作用。应静芝[12]对1 例14 个月的疱疹性口炎患者应用紫草等中药,水煎服,连用5 剂,口内疱疹痊愈。 疱疹性口炎是由单纯疱疹病毒引起的感染性疾病,该例治疗在银翘散疏风解表清热的基础上,重用紫草抗炎抗病毒,收效满意,表明紫草多糖具有一定的抗病毒功效。
3.2 免疫调节作用
从紫草的根中分离得到的咖啡酸四聚体单钠和单钾盐具有明显的抗人类免疫缺陷病毒活性,表明紫草具有一定的免疫调节作用。 罗学娅等[13]发现从紫草根水煎剂中提取出的有效成分紫草多糖可促进腹腔巨噬细胞吞噬功能,增加脾脏中T淋巴细胞计数和T 淋巴细胞功能,促进迟发性变态反应,说明紫草多糖对机体具有增强特异性和非特异性免疫的作用。此外,紫草复方在一定剂量范围内,体内体外试验中均能提高自然杀伤细胞(natural killer cell ,NK 细胞)杀伤靶细胞的活性,提高机体免疫功能,发挥对淋巴细胞的调节功能。张秀娟[14]研究了紫草多糖对S180 荷瘤小鼠红细胞膜磷脂脂肪酸含量及脂肪酸组分的影响。 与阴性对照组比较,紫草粗多糖低、中、高给药组小鼠红细胞膜中,C16∶1、C18∶1、C18∶2、UFA/TFA 的比例有不同程度的升高,其中C18∶2、UFA/TFA 的中剂量组有显著性差异(P <0.01);而紫草粗多糖低、中剂量组C16∶0 与阴性对照组比较有所降低,其中中剂量组有显著性差异(P <0. 01);同时紫草粗多糖组C18∶0 的百分含量较阴性对照组稍有降低,但无差异。紫草多糖通过影响荷瘤动物红细胞膜磷脂脂肪酸的含量与组分,增强了膜的流动性,从而调整红细胞的免疫功能。
3.3 抗肿瘤活性
紫草多糖具有一定的肿瘤抑制活性,在体外对肿瘤细胞有直接的杀伤作用。 陈祥娜等[15]采用MTT 法检测紫草多糖对淋巴细胞增殖及对HepG2、SPC-A-1 肿瘤细胞的杀伤作用。通过比较紫草多糖对HepG2 和SPC-A-1 肿瘤细胞的细胞毒作用显示,紫草多糖对HepG2 和SPC-A-1 肿瘤细胞都有抑制作用,但相同浓度下对两种肿瘤细胞的抑制效果不同,与对SPC-A-1 细胞的抑制作用相比,高剂量浓度对HepG2 细胞的抑制作用明显强,显示出更大的剂量依赖性。分析推测紫草多糖的肿瘤杀伤作用可能是由于改变了肿瘤细胞膜的生化特性,从而起到直接抑制肿瘤细胞生长的效果,同时还对肿瘤细胞具有一定的细胞毒作用。 张秀娟[16]观察紫草多糖对S180 荷瘤小鼠瘤重、红细胞膜流动性和带3 蛋白含量的影响,采用荧光探针DPH 标记法测定红细胞膜的荧光偏振度P,计算微黏度与膜脂流动性;电泳法测定红细胞膜带3 蛋白含量。结果表明:紫草多糖中剂量组抑瘤率达43.05%; 且各剂量组对红细胞膜膜脂流动性、 带3 蛋白均有影响,以中剂量组效果最佳,与对照组相比P <0.01,P <0.05。 紫草多糖通过影响荷瘤小鼠红细胞膜流动性和带3 蛋白,恢复红细胞的正常功能,发挥其抗肿瘤作用。
4 结语
我国紫草资源丰富,为紫草多糖的研究提供了保障。目前紫草多糖的提取工艺已经趋向成熟,重点在于开发新型的提取技术和工艺的优化。 紫草多糖的研究难点及热点聚焦在药理研究及生物活性上,多糖结构的复杂性赋予了其多样的生物活性,同时也在一定程度上限制了糖类药物的深入研究,因此多糖结构与相应的活性之间的关系即构效关系的研究,对定向设计药物结构,研发新药具有重要的指导意义。此外,还应该加强紫草多糖的安全性能研究,以期早日在医药、日用化工及食品等领域发挥重大作用,全面提升紫草多糖的应用价值。
[1]杨晓笛,卢锋,黄美充,等.中药紫草有效成分的提取[J].汕头大学学报(自然科学版),2002,17(4):67-70.
[2]徐新刚,王宝珍,孙志蓉,等.新疆紫草的主要化学成分[J].吉林大学学报(理学版),2010,48(2):319-322.
[3]陈详娜.紫草多糖的提取分离与活性研究[D].杭州:浙江大学,2008.
[4]李芳,储继红,赵文彬. 新疆紫草多糖的超声提取及含量测定[J].时珍国医国药,2006,17(7):1216-1217.
[5]朱艳红,邓远辉弘,王海兰. 紫草多糖提取工艺参数优选及其分子量测定 [J]. 中国实验方剂学杂志,2010,16(1):6-8.
[6]李倩,田春芳,刘雯霞,等.超声波复合酶法提取软紫草多糖的工艺优化[J].中国现代应用药学,2012,29(6):498-502.
[7]曲晓兰,苏延友,高红莉.紫草多糖的微波提取及含量测定[J].泰山医学院学报,2005,26(6):550-551.
[8]杨秀芳. 微波协同法提取紫草多糖工艺参数的研究[J].陕西科技大学学报(自然科学版),2006,24(3):58-61.
[9]朱月,李彩霞,毕晓丹.猪苓多糖分级纯化及对羟自由基清除作用的研究[J].安徽农业科学,2011,39(30):18553-18555.
[10]郭代英.无花果多 糖分离、纯化[J].食品工业科技,2009,30(10):270-272.
[11]陈祥娜.紫草多糖的提取工艺研究[M].杭州:浙江大学出版社,2012:8-9.
[12]应静芝.紫草在儿科临床应用举隅[J].浙江临床医学,2002,4(10):729-730.
[13]罗学娅,李明辉,吕莉,等.紫草的药理作用与应用研究进展[J].2004,25(2):80-84.
[14]张秀娟,秦睿. 紫草多糖对S180 小鼠红细胞膜磷脂脂肪酸的影响[J]. 哈尔滨商业大学学报(自然科学版),2009,25(6):652-656.
[15]陈祥娜,阮红,紫草多糖的免疫调节和肿瘤抑制活性研究[J].浙江大学学报,2008,35(6):674-677.
[16]张秀娟,穆坤,杨姗姗,等.紫草多糖对S180 荷瘤小鼠红细胞膜流动性与带3 蛋白的影响[J]. 亚太传统医药,2007,3(9):30-33.
