向日葵叶中绿原酸微波辅助提取及抗氧化性研究
2014-12-02钟姣姣李万林刘军海
钟姣姣,李万林,刘军海
(陕西理工学院化学与环境科学学院,陕西汉中723001)
向日葵是菊科属植物,又名葵花、向阳花等[1]。它喜阳,耐旱。 其叶子形状为心状卵形或卵圆形。向日葵叶可分为子叶和真叶,其中真叶在茎下部1~3 节,常为对生,以上则为互生[2]。 向日葵叶子中含有新绿原酸、异绿原酸、绿原酸等化学成分,在中草药中具有重要的药用价值,对金黄色葡萄球菌有抑菌作用,也可作为抗疟药,同时还是治疗高血压、头痛、头晕、胃脘胀满、腹痛等症状的有效原料。
绿原酸又名咖啡鞣酸,化学名为3-O-咖啡酰奎尼酸,分子式为C16H18O9,分子量为345.30。研究表明,绿原酸药理活性很强,具有利胆、抗菌、降压、增加白血球、兴奋中枢神经系统、抗肿瘤、降脂、清除自由基等多种药理作用,对消化系统、血液系统和生殖系统疾病均有显著疗效[3]。 它在医药、食品、化妆品、农业等领域有广泛的应用。目前绿原酸的提取方法已有水提法、醇提法等,但对混合溶剂提取方法的研究还较少。 采用微波辅助提取法,操作简单,可缩短生产周期,利用微波具有穿透能力强、选择性高、加热效率高等特点[4-5],可使向日葵叶细胞内的有效成分快速溶出。 本实验可为建立一种有效提取向日葵叶中绿原酸的方法及抗氧化性的研究,并为向日葵叶总绿原酸的提取提供理论和实践依据。
1 材料与方法
1.1 材料
向日葵叶:采摘于汉中市镇巴县某山区,需洗净、55 ℃烘干、粉碎。
绿原酸标准品:西安小草植物科技有限公司;乙醇、丙酮、PBS 缓冲液(pH =7.4)、硫酸亚铁、邻二氮菲、Vc(抗坏血酸)、过氧化氢等,均为市售分析纯。
1.2 仪器
Cary-50 紫外分光光度计 (美国瓦里安公司); DGG-9140B 型电热恒温鼓风干燥箱 (上海森信公司);FW-177 型中草药粉碎机 (天津市泰斯特公司);GR-200 型电子天平 (日本AND 公司);HH-2 型电热恒温水浴锅 (北京科伟兴汉有限公司);YC7134 油泵(温岭市速力电机厂)。
1.3 实验步骤
1.3.1 绿原酸标准对照品最大吸收波长及标准曲线制作
1.3.1.1 绿原酸标准品的最大吸收波长
准确称取绿原酸标准品1 mg,用无水乙醇定容至50 mL 容量瓶中。 以无水乙醇作参比液,在250 ~500 nm 范围内扫描,测定吸光度,筛选最大波长。以绿原酸吸收波长为横坐标,以不同波长下的吸光度为纵坐标,制作绿原酸标准品的吸收波长光谱(图1)。 由图1 可知,绿原酸在329.9 nm处有最大吸收峰。 因此,应该选用329.9 nm 为绿原酸的最大吸收波长。
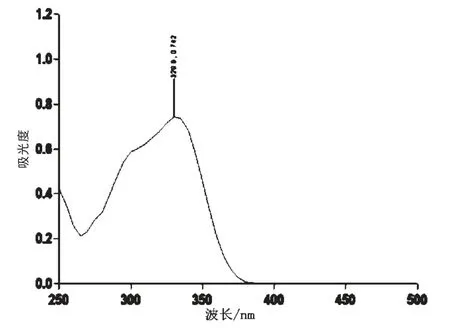
图1 绿原酸标准品的吸收波长光谱
1.3.1.2 绿原酸标准曲线的绘制方法[6]
准确称取经55 ℃干燥至恒重的绿原酸标准品1 mg,置于50 mL 的容量瓶中,加适量的无水乙醇,使其充分溶解,再用无水乙醇定容至刻度线处,摇匀,即可得浓度为20 μg/mL 的绿原酸标准对照品。精确移取绿原酸标准品溶液1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mL 分别置于10 mL的容量瓶中,分别用乙醇定容至刻度线处,摇匀,以无水乙醇为参比液,按分光光度法,在最大吸收波长329.9 nm 处测定其吸光度。
1.3.1.3 标准曲线的绘制
以吸光度A 为纵坐标,以绿原酸浓度C 为横坐标绘制绿原酸标准曲线,得到吸光度A 与绿原酸 浓 度C 之 间 满 足A =0.0394C+0.1125 (R2=0.9995)的标准曲线(图2)。
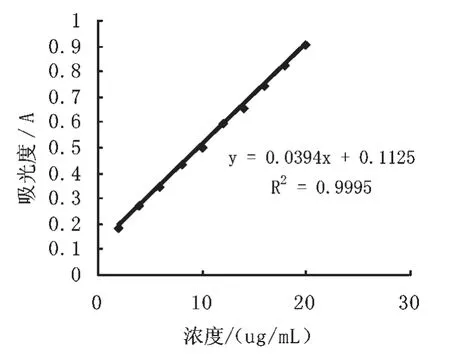
图2 绿原酸标准曲线
1.3.2 向日葵叶中绿原酸的提取工艺流程
向日葵叶恒温干燥→粉碎处理→过60 目筛→设定参数浸泡→微波辅助处理→过滤→抽滤→收集滤液。
1.3.3 绿原酸提取率的计算公式
取锥形瓶中滤液,将其稀释后测量吸光度并带入下式计算向日葵叶中绿原酸的提取率。

上式中:
W:向日葵叶中绿原酸提取率;
A:所测的吸光度;
N:绿原酸溶液稀释倍数;
V:绿原酸滤液体积/mL;
M:向日葵叶粉末的质量/g。
1.3.4 正交实验设计
在单因素的试验基础上,以提取率为指标,选择L16(45)设计表进行正交试验。 正交试验因素水平见表1。

表1 L16(45)正交试验因素水平表
1.3.5 向日葵叶提取物抗氧化性的测定[7]
采用邻二氮菲-Fe2+氧化法,在10 mL 具塞试管中依次加入0.2 mL 浓度为7.5 mmol·L-1的邻二氮菲溶液,2.0 mL pH =7.4 的PBS 缓冲液,0.2 mL 浓度为7.5 mmol·L-1的FeSO4和2 mL 绿原酸提取物不同浓度的样品溶液,最后再加入1.0 mL 0.1%H2O2,每次加入试剂均需摇匀,使溶液充分混合,于40 ℃水浴中静置反应60 min 后,在329.9 nm 处测定吸光度值。 根据测定的吸光度值按下式计算羟自由基的清除率:
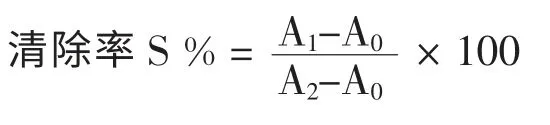
式中:
A0:不含样品,只含H2O2时的吸光度值;
A1:不含样品,只含蒸馏水代替H2O2时的吸光度值;
A2:含样品的吸光度值。
2 结果与分析
2.1 提取溶剂的比较
选取水、乙醇、丙酮、乙醇-丙酮四种溶剂作为提取剂,浓度都为99%,配制乙醇:丙酮体积比为1∶1,在料液比1∶15(向日葵粉末与体积分数为65%的乙醇配比)、 微波功率300 W、 微波温度60 ℃、 浸泡时间120 s 的微波处理条件下分别进行实验。按照1.3.3 测其吸光度,并计算提取率。研究了提取溶剂对向日葵叶中绿原酸提取率的影响,如图3。
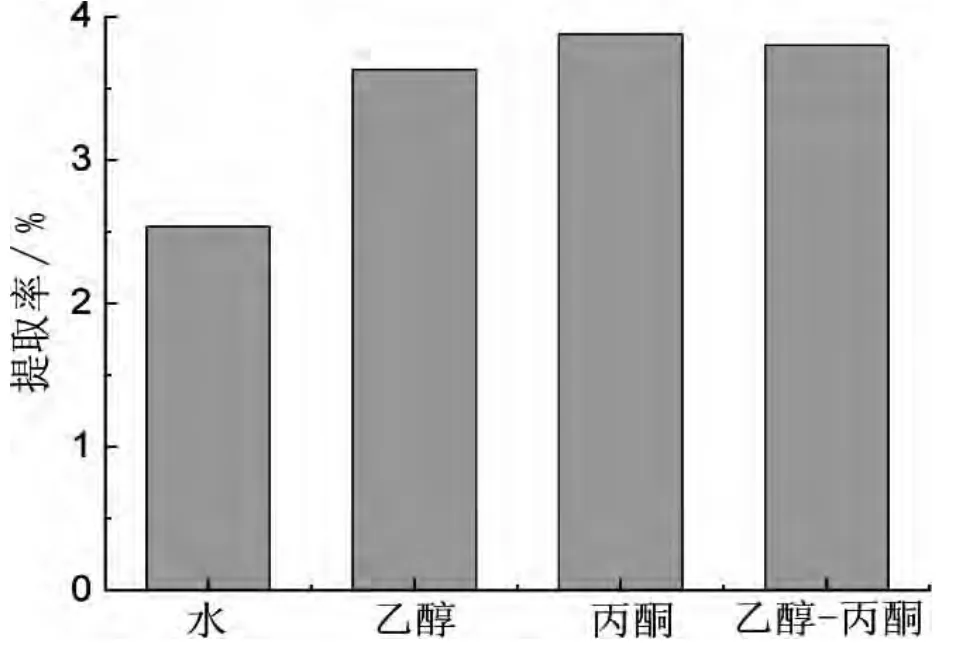
图3 不同溶剂提取向日葵叶中绿原酸的比较
如图3 可知,水提法提取向日葵叶中绿原酸提取率最低,乙醇提取法提取率次之,丙酮、乙醇-丙酮混合溶剂提取法提取率相近,都相对较高。水提法提取率低,可能是由于水的温度较高使其他物质溶出较多,且给分离带来了困难;醇提法提取率相对高,可能是由于在醇溶液中,酶催化分解绿原酸作用受到抑制,使向日葵叶中绿原酸提取率降低。绿原酸更易溶于丙酮,考虑到试剂的价格较高,故采用乙醇溶剂为宜。
2.2 单因素结果与分析
2.2.1 乙醇体积分数对向日葵叶中绿原酸提取率的影响
准确称取3 g 向日葵叶粉末,在微波处理时间为5 min、pH 值为7 的恒定条件下,控制微波功率为300 W、微波温度为60 ℃、料液比为1∶15、浸泡时间为120 s,分别研究在乙醇体积分数为55%、60% 、65%、70%、75%时对向日葵叶中绿原酸提取率的影响。

表2 不同乙醇体积分数对向日葵叶中绿原酸提取率的影响
由表2 可知,乙醇体积分数小于65%时,随着乙醇体积分数的增加,向日葵叶的绿原酸提取率有显著的提高,因为向日葵叶中绿原酸的极性更接近体积比为65%乙醇溶剂的极性; 超过乙醇体积分数65%时,提取率反而降低,可能是由于此时的乙醇中溶解了其他的物质导致绿原酸提取率下降,故选择乙醇体积分数65%为宜。
2.2.2 微波功率对向日葵叶中绿原酸提取率的影响
准确称取3 g 向日葵叶粉末,在微波处理时间为5 min、pH 值为7 的恒定条件下,控制乙醇体积分数为65% 、微波温度为60 ℃、料液比为1∶15 g/mL、浸泡时间为120 s,分别研究在微波功率为100 W、200 W、300 W、400 W、500 W 时对向日葵叶中绿原酸提取率的影响。

表3 不同微波功率对向日葵叶中绿原酸提取率的影响
由表3 可知,微波功率小于300 W 时,向日葵叶中绿原酸的提取率随微波功率的升高而增加,这可能是由于强大的内压及分子间的摩擦力使向日葵叶细胞膜破裂绿原酸溶解速度加快,提取率增大;当微波功率超过300 W 时,提取率随功率的升高反而下降,这可能是由于微波功率过大产生的局部过热现象使绿原酸变性,从而使提取率下降。 故选择微波功率300 W 为最佳。
2.2.3 微波温度对向日葵叶中绿原酸提取率的影响
准确称取3 g 向日葵叶粉末,在微波时间为5 min、pH 值为7 的恒定条件下,控制乙醇体积分数为65% 、微波功率为300 W、料液比为1∶15 g/mL、浸泡时间为120 s,分别研究在微波温度为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃时对向日葵叶中绿原酸提取率的影响。

表4 不同微波温度对向日葵叶中绿原酸提取率的影响
由表4 可知,微波温度小于60 ℃时,向日葵叶中绿原酸的提取率随微波温度的升高而加速上升,因为温度升高,分子运动加快,使得细胞破裂,进一步导致向日葵叶中绿原酸的溶解及扩散速度加快,提取率显著提高。微波温度继续增加时提取率反而下降,可能是因为向日葵叶中绿原酸随着温度的升高一部分有效成分被分解。 故选择微波温度60 ℃为宜。
2.2.4 料液比对向日葵叶中绿原酸提取率的影响
准确称取3 g 向日葵叶粉末,在微波处理时间为5 min、pH 值为7 的恒定条件下,控制乙醇体积分数为65%、 微波功率为300 W、 微波温度为60 ℃、浸泡时间为120 s,分别研究在料液比为1∶5 g/mL、1∶10 g/mL、1∶15 g/mL、1∶20 g/mL、1∶25 g/mL 时对向日葵叶中绿原酸提取率的影响。

表5 不同料液比对向日葵叶中绿原酸提取率的影响
由表5 可知,随着料液比的增加,向日葵叶中绿原酸提取率不断增加,当溶剂用量达到1∶20 g/mL 时,向日葵叶中绿原酸已基本溶出,再增加溶剂用量,提取率的增加幅度不大,考虑到成本问题,选择料液比1∶20 g/mL 为宜。
2.2.5 浸泡时间对向日葵叶中绿原酸提取率的影响
准确称取3 g 向日葵叶粉末,在微波处理时间为5 min、pH 值为7 的恒定条件下,控制乙醇体积分数为65%、微波功率为300 W、微波温度为60℃、料液比为1∶20 g/mL,分别研究在浸泡时间为60 s、90 s、120 s、150 s、180 s 的条件下对向日葵叶中绿原酸提取率的影响。

表6 不同浸泡时间对向日葵叶中绿原酸提取率的影响
由表6 可知,浸泡时间对向日葵叶中绿原酸提取率有一定的影响,浸泡时间过短时,则绿原酸还未完全溶解,提取率低;浸泡时间过长,提取溶剂挥发,使提取率变低;当浸泡时间为150 s 时,绿原酸的溶解基本达到平衡,提取率最高。故选择浸泡时间以150 s 为宜。
2.3 正交试验对向日葵叶中绿原酸提取工艺的优化
在单因素的基础上,选择乙醇体积分数(A)、微波功率(B)、微波温度(C)、料液比(D)、浸泡时间(E)为影响因素,以提取率为指标,选择L16(45)进行正交试验,正交结果见表7。
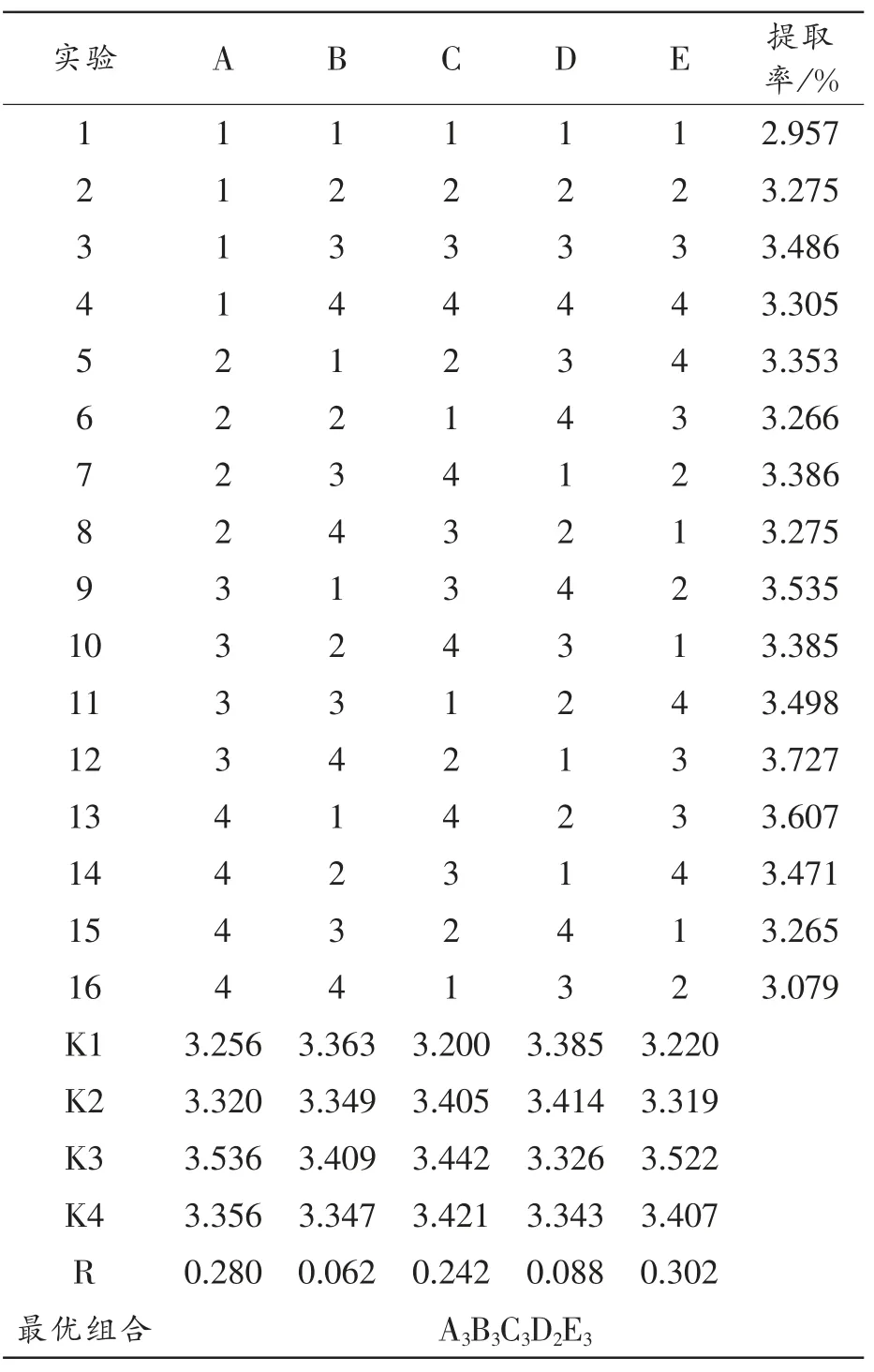
表7 正交试验结果
由直观分析图可知,各因素对向日葵叶中绿原酸微波提取工艺的影响顺序为浸泡时间>乙醇体积分数>微波温度>微波功率>料液比,最佳提取工艺条件为A3B3C3D2E3,即浸泡时间为150s,微波温度为60 ℃,微波功率为300 W,乙醇体积分数为65%,料液比为1∶15 g/mL 时,在最佳因素组合的条件下进行三次平行实验,提取率分别为3.802%、3.801%、3.804%,取其平均值,得最优组合的提取率为3.802%。
2.4 向日葵叶提取物抗氧化性测定
称取向日葵叶粉末5 g 置于圆底烧瓶中,配制乙醇体积分数为65%,在料液比为1∶15 g/mL 时,浸泡150 s,设温度60 ℃条件下微波处理5 min(最佳工艺条件),趁热过滤,抽滤得绿原酸提取液,配制成不同浓度的样品溶液,以相同浓度的Vc 作阳性对照品。 用邻二氮菲-Fe2+氧化法测定向日葵叶提取液清除·OH 的能力。 重复上述步骤,结果如图4。
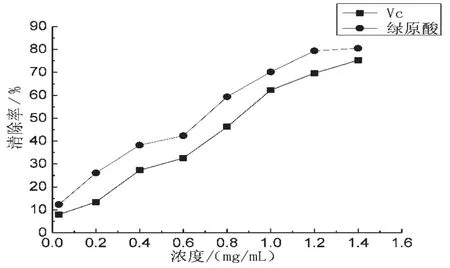
图4 Vc、向日葵叶中绿原酸提取液对·OH 的清除率
测定得向日葵中绿原酸提取液和Vc 对·OH的最大清除率分别为74.30%、 80.49%,且随着浓度的增加,清除率也不断增加。 结果表明,绿原酸提取液对向日葵叶有较强的抗氧化性,且比Vc的抗氧化能力强。
3 结语
(1)向日葵叶中富含绿原酸,是一种可利用的绿原酸资源。通过单因素实验、正交实验及响应面优化提取工艺得出最优组合为浸泡时间150 s,微波温度60 ℃,微波功率300 W,乙醇体积分数65%,料液比1∶15 g/mL 时,可达到最佳提取效果。在此最佳工艺组合下,向日葵叶中绿原酸的提取率可达3.802%。
(2)用邻二氮菲-Fe2+氧化法测定了最佳工艺条件下向日葵叶中绿原酸提取液对·OH 的清除率为80.49%,结果表明,向日葵叶中绿原酸提取液具有较好的抗氧化性,为绿原酸及其功能性成分的进一步开发利用奠定了基础。
[1]索金玲,彭秧,朱然.向日葵花盘水溶性多糖提取工艺及抗氧化研究[J].生物技术,2010,20(2):74-77.
[2]李晓丽,张边江.油用向日葵的研究进展[J].安徽农业科学,2009,37(27):13015-13017.
[3]张英峰,张立艳,马子川,等.植物绿原酸的研究进展[J].化学教育,2011,(4):1-3.
[4]刘梅,米莹.微波提取在中药领域的应用进展[J].天津药学,2009,25(5):62-64.
[5]李万林. 金银花中微波辅助提取绿原酸工艺条件研究[J].江西饲料,2013,(3):3-6.
[6]李万林. 向日葵花盘中绿原酸的微波辅助提取工艺条件研究[J].皮革与化工,2013,30(03):14-18.
[7]冯文婕.雪莲果中绿原酸的提取及其抗氧化性测定[J].广州化工,2011,39(17):47-49.
