重组鲑鱼降钙素结肠黏附缓释微球的制备*
2014-12-02宋益民范鸣浩张学成
宋益民,范鸣浩,杨 青,张学成
(1.青岛科技大学制药工程系,山东 青岛 266042;2.中国海洋大学生命学院,山东 青岛 266003)
降钙素(Calcitonin,CT)是由32个氨基酸组成的一种多肽类激素[1],由脊椎动物的后腮体和哺乳动物的甲状腺C细胞分泌,且后腮体来源的降钙素活性高于甲状腺C细胞分泌的降钙素[2]。鲑鱼降钙素通过抑制破骨细胞的活性,减少骨钙丢失,从而降低血钙含量[3],同时有明显的镇痛作用。在临床上可以被广泛地用于高血钙症、Paget氏综合症、骨质疏松症等疾病的预防和治疗,并且对急性胰肠炎、胃溃疡、糖尿病也具有辅助治疗的作用。
在不同种属来源的降钙素中,以鲑鱼降钙素活性最高,但由于其相对分子质量小,容易被胃肠道内存在的大量多肽及蛋白质水解酶降解,还有胃肠道内的低PH值环境和肝脏的首关效应,导致鲑鱼降钙素口服给药的生物利用度较低(一般小于10%)[4]。目前临床应用的鲑鱼降钙素以肌肉内注射为主,但病人用后,存在血药浓度波动大,依从性差等缺点。而且预防和治疗骨质疏松等症时需要长期、频繁注射给药,使用十分不便,极大地限制了其临床应用。因此,为了解决这些问题,现将其制成每颗50mg的结肠黏附缓释胶囊,并使其达到12h缓释效果。结肠定位黏附缓释微球可以使药物与结肠黏膜表面直接接触,从而提高药物的局部浓度,同时还能增加药物与结肠的接触时间,提高药物的生物利用度,降低毒副作用[5]。
由于在自然生物中仅存在极微量的鲑鱼降钙素,而人工合成的造价又十分昂贵,所以极大地限制了它的广泛应用。2000年,Blanquet提出了建立以酿酒酵母为载体的多肽类药物口服给药体系,该方法所制得的药物被称为“biodrug”[6]。张学成实验室利用酵母表面展示载体pyd1构建了在表面表达鲑鱼降钙素的转基因酵母(yAGA2-r-sCT),并具有明显的降血钙活性[7]。本实验以重组(酵母)鲑鱼降钙素为原料,通过喷雾干燥法制备重组(酵母)鲑鱼降钙素微球,并以市售的结肠溶空心胶囊为定位载体。以微球的释药特性为质量评价指标,通过单因素考察和正交试验设计优化微球的最佳处方和工艺。
1 材料
鲑鱼降钙素转基因酵母(yAGA2-r-sCT)由中国海洋大学生命学院遗传学实验室提供;鲑鱼降钙素标准品,纯度≥97.0%,Sandoz公司产品;阿拉伯胶(Gum arabic powder),天津市博迪化工有限公司;β-环糊精(β-Cyclodextrin),天津市博迪化工有限公司;可溶性淀粉(Tragantine),天津科密欧化学试剂有限公司;明胶(Gelatin),天津科密欧化学试剂有限公司;羟丙基甲基纤维素(HPMC),上海晶纯试剂有限公司,批号:16706;卡波姆(Carbomer934P),北京鑫洲科技有限公司;结肠溶空心胶囊,广东省潮州市强基制药厂;ELISA试剂盒,Peninsula Laboratories Inc,批号06154,包括降钙素标准品、分析缓冲液、多肽抗体、96孔酶标板(已包被抗体)、标准稀释液、辣根过氧化物酶、生物素化多肽、底物(TMB和 H2O2)、终止液(2mol·L-1盐酸)等。
高速离心喷雾干燥机(01S-5,无锡市富超喷雾干燥机械厂);智能药物溶出仪(ZRS-8A,天津大学精密仪器厂);空气压缩机(ZB-0.1/8型,浙江台州鑫磊工贸有限公司);双向磁力加热搅拌器(79-2,黄骅市亚龙仪器仪表厂);酶标仪(CLINBIO 128,Australia),系列加样器(上海精密仪器厂)。
2 方法
2.1 重组鲑鱼降钙素的制备
为了从转基因酵母微球中获得重组鲑鱼降钙素蛋白rsCT,将10mg微球溶解到500μL缓冲液当中。缓冲液含50mmol/L Tris-HCl(pH5.6),5mmol/L CaCl2。与1Uenterokinase在21℃下作用24h。酶切产物在5 000×g转速下离心10min,取上清液,得重组鲑鱼降钙素溶液。
2.2 重组鲑鱼降钙素的测定[7]
样品采用鲑鱼降钙素酶免分析试剂盒[8]进行定量分析,每孔加入标准品溶液或样品溶液50μL、抗体25 μL、生物素化的多肽25μL,室温下温育过夜;每孔加入分析缓冲液300μL,清洗酶标板5次;每孔加入辣根过氧化物酶100μL,室温下温育1h;每孔加入分析缓冲液300μL,清洗酶标板5次;每孔加入TMB溶液100 μL,室温下温育1h;每孔加入2mol·L-1盐酸100 μL,终止反应;20min内在490nm波长处测定光密度,并计算结果。用ELISA法检测样品时均扣除了空白溶液样品本底。
2.3 鲑鱼降钙素标准曲线的制备[7]
取空白溶液0.2mL,分别加入鲑鱼降钙素标准品适量,使其浓度分别为5,10,20,40,80,120,160,200 μg·L-1;按2.2中所述方法,进行分析测定,每一浓度进行5个样本分析,记录光密度,以浓度(C)对光密度(OD)做四参数非线性回归分析,得回归方程为:OD=-7.8×10-7C3+3.1×10-4C2+6.2×10-3C-0.069 5,r=0.986 7。
鲑鱼降钙素浓度测定方法的检测范围为5~200 μg·L-1,最低检测浓度为5μg·L-1(见图1)。
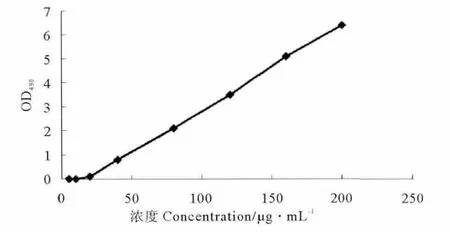
图1 鲑鱼降钙素标准曲线Fig.1 The standard regressive curve of sCT
2.4 释放度的测定方法
2.4.1 释放条件 采用转篮法,设定转速为100 r·min-1,温度为(37±0.5)℃,因为市售结肠溶空心胶囊在胃与小肠中完全不溶,所以只考察载药胶囊在250mL的人工结肠液(pH=7.8的磷酸盐缓冲液PBS)中的释放[9]。
2.4.2 测定方法 取6粒载药胶囊,放在转篮中。控制释放条件,在12h以内,每间隔2h取样5mL(同时补充同温同体积的新鲜介质),立即用滤膜滤过,然后精密量取续滤液1mL稀释10倍。依次按2.1和2.2中所述方法操作,以标准曲线方程求算对应药物浓度和累积释放率。
2.5 工艺设计
壁材→40℃溶解→搅拌5min→加入芯材(表达重组鲑鱼降钙素的酵母)、适量HPMC和CP→二次搅拌10min→喷雾干燥。
2.6 正交试验设计
以进风温度(A)、进料速度(B)、雾化压力(C)为试验因素,设计L9(33)正交试验表(见表1),确定最优组合,优化喷雾干燥工艺(出风温度80~90℃)。
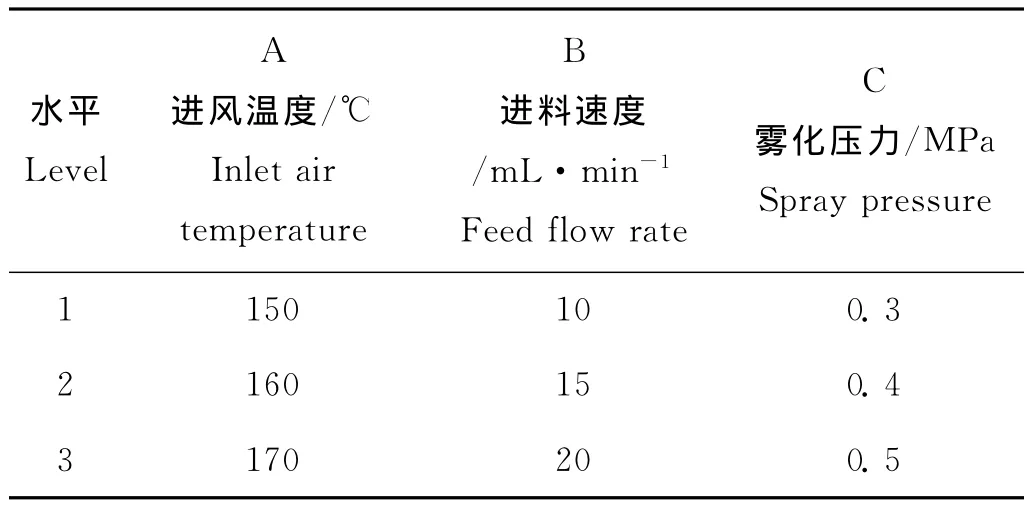
表1 正交试验因素和水平表Table 1 Factors and levels of orthogonal experiment
3 结果与讨论
3.1 最佳壁材的选择
选择阿拉伯胶/明胶、β-环糊精/阿拉伯胶、可溶性淀粉/阿拉伯胶、β-环糊精/明胶4种壁材,按照壁材浓度为15%、芯材比为1∶3、HPMC/CP为4∶1进行喷雾干燥,通过测定各个样品不同时间点的累积释药率,以确定最佳的壁材(见图2)。
从图2可以看出,微球的壁材不同,其体外溶出的累积释放率存在较大差异。阿拉伯胶/明胶、可溶性淀粉/阿拉伯胶、β-环糊精/明胶3种壁材所制微球,其12h累积释放率低于β-环糊精/阿拉伯胶所制微球。阿拉伯胶/明胶和β-环糊精/明胶作壁材时所得产品的12h累积释放率低于70%,而可溶性淀粉/阿拉伯胶作壁材时所得产品的12h累积释放率低于60%。说明β-环糊精/阿拉伯胶对于鲑鱼降钙素的保护作用较强,故实验以β-环糊精/阿拉伯胶作为壁材。

图2 不同壁材对药物释放的影响Fig.2 Effects of different wall material on durg release
3.2 壁材组分比例对药物释放的影响
采用β-环糊精/阿拉伯胶作为壁材,选择质量比为15∶1、10∶1、5∶1、2∶1,在壁材浓度为15%、芯材比为1∶3、HPMC/CP为4∶1的条件下喷雾干燥,通过测定各样品不同时间点的累积释药率,以确定最佳壁材组分比例(见图3)。
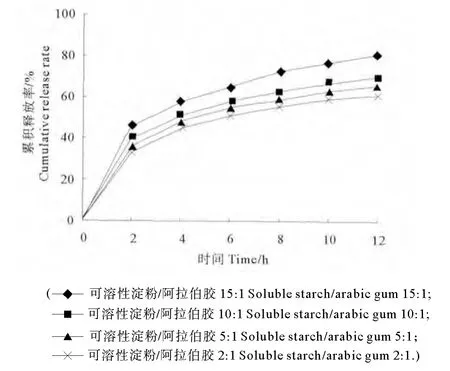
图3 壁材组分比例对药物释放的影响Fig.3 Effects of the proportion of wall material composition on durg release
从图3中可以看出,β-环糊精比例越大,微球的12h累积释放率越高,对鲑鱼降钙素的保护作用越强。当继续加大β-环糊精的用量时,由于其溶解度较低,需要提高溶液温度,为了保护鲑鱼降钙素,本实验温度控制在40℃以内,所以实验选择壁材组分质量比例为15∶1。
3.3 壁材浓度对药物释放的影响
采用10%、15%、20%3种不同浓度的β-环糊精/阿拉伯胶作为壁材,在芯材比为1∶3、HPMC/CP为4∶1的条件下进行喷雾干燥,通过测定各个样品不同时间点的累积释药率,以确定最佳的壁材浓度(见图4)。

图4 壁材浓度对药物释放的影响Fig.4 Effects of the concentration of wall material on durg release
壁材浓度为10%时,作为壁材的β-环糊精/阿拉伯胶用量过少,不足以将囊心物完全包裹,微球释放过快。当β-环糊精/阿拉伯胶的浓度为20%时,溶液黏度也变大。在喷雾干燥过程中喷头出现冰凌,由于冰凌与空气的阻力阻碍了喷头的转速,产品黏连为絮状物,外观不好,而且微球释放速度过慢,不符合要求,当浓度再大时由于黏度原因还可能使喷头转动不起来。当β-环糊精/阿拉伯胶的用量在15%时所得微球外观较好,符合12h缓释要求,而且喷雾过程中喷头也不会出现冰凌,因此选定壁材浓度为15%。
3.4 壁材和芯材比例对药物释放的影响
采用浓度为15%的β-环糊精/阿拉伯胶作为壁材,HPMC/CP(4∶1)为生物黏附剂,在芯材比为1∶1、1∶2、1∶3、1∶4 4种不同的条件下进行喷雾干燥,通过测定各个样品不同时间点的累积释药率,以确定最佳的芯材比(见图5)。

图5 芯材比对药物释放的影响Fig.5 Effects of core material on durg release
芯材比为1∶1、1∶2时,壁材用量过少,突释效应明显,不符合缓释要求,而芯材比为1∶4时,芯材比例过小,微球释放速度过于缓慢,2h累积释放率明显低于40%。当芯材比为1∶3时,微球外观较好,符合12h缓释要求,喷头在喷雾过程中不产生冰凌,故选择芯材比为1∶3。
3.5 微球中HPMC/CP的比例对药物释放的影响
采用HPMC和CP作为生物黏附剂,在质量比为10∶1,4∶1,2∶1,1∶1,1∶2,其他处方成分用量不变的条件下喷雾干燥,通过测定各个样品不同时间点的累积释药率,确定HPMC/CP的最佳比例(见图6)。

图6 微球中HPMC/CP的比例对药物释放的影响Fig.6 Effects of the ratio of HPMC to CP on durg release in microspheres
由图6可见,当HPMC比例增大时,微球释放速率减慢;而当CP比例增大时,微球释放速率增快。然而当CP比例超过一半以上时,微球易溶胀形成凝胶状,所以依据12h缓释要求,HPMC/CP比例为4∶1时缓释效果最佳,故选取HPMC/CP为4∶1进行下一步试验。
3.6 喷雾干燥最佳工艺条件的确定
按照表1因素水平表,通过正交试验,以微球的累积释放因子S为主要评价标准,确定最优组合,优化喷雾干燥工艺。正交设计试验的方案和结果见表2。
累积释放因子S=|Q2-30|+|Q6-70|+|Q12-85|,Q2、Q6、Q12分别代表2、6、12h时药物的累积释放率。S值越低,表明所定的标准(中华人民共和国药典2005年版二部附录XD释放度测定法中缓释制剂的释放标准)越接近,因素的水平数越佳[10]。表2结果显示,因素对释放影响的顺序为:进风温度>进料速度>雾化压力。综合评价标准,各因素最优水平组合为:A2B1C3,即:进风温度160℃,进料速度10mL·min-1,雾化压力0.5MPa。
3.7 重现性
3批缓释微球最优处方释药曲线(见图7)。按相似因子f2判断自制品与参比制剂体外释放行为的相似程度(f2=50×lg[[1+1/nΣ(Rt-Tt)2]-0.5×100],Tt和Rt分别为受试制剂和参比制剂在t时刻的释放度)。通过计算得出:3批样品与参比制剂的f2平均值为75,表明3批样品之间具有良好的批间释放度重现性,微球制作处方和工艺较为稳定[5]。

表2 正交设计试验的方案和结果Table 2 Programs and results of orthogonal experiment
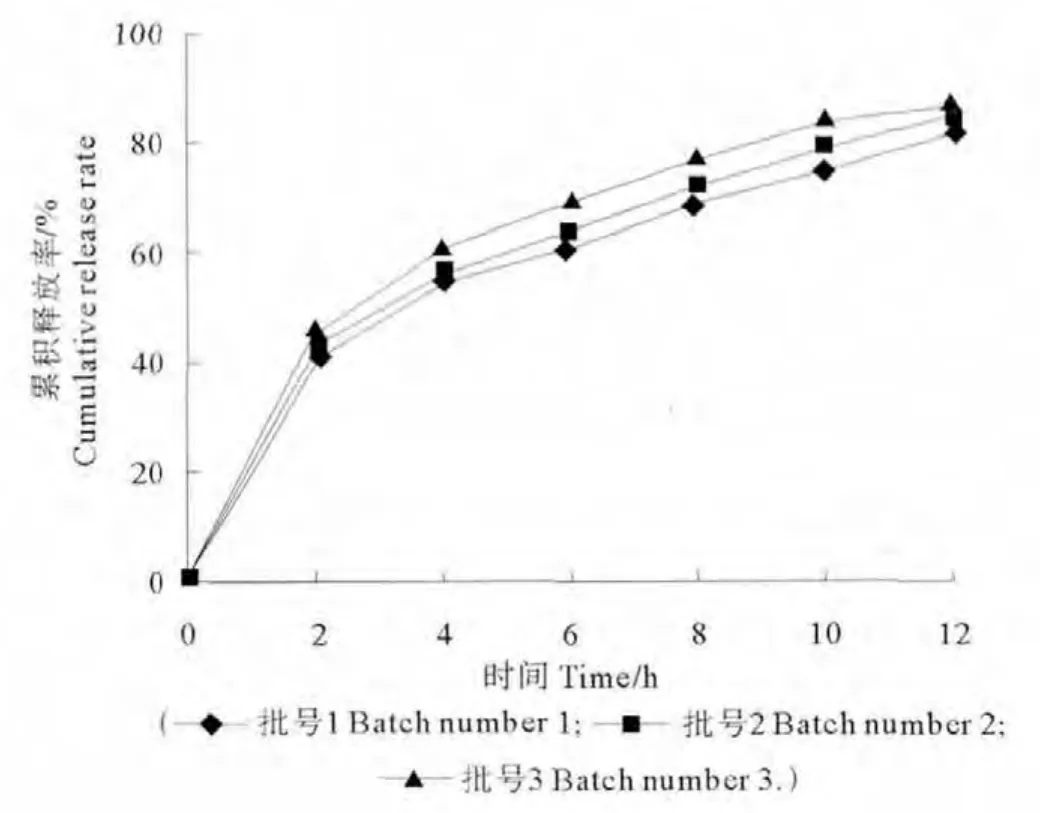
图7 批缓释微球优化处方释药曲线Fig.7 The release curves of the optimized prescription of three groups of sustained release microspheres
4 结论
(1)在4种壁材中,优选β-环糊精/阿拉伯胶进行喷雾干燥,并且当β-环糊精/阿拉伯胶的组分比例为15∶1,壁材浓度为15%,芯材比为1∶3时微球缓释效果最好。
(2)HPMC是纤维素的衍生物,CP系丙烯酸与丙烯基蔗糖交联的高分子聚合物,两者都具有一定的生物黏附性。CP黏附力较强,且随介质pH的升高,羧基游离,黏附力增强,因此在结肠pH环境下仍能保持较强的黏附力[11]。但卡波姆干颗粒水化易溶胀形成凝胶,容易从组织脱落,影响其黏附力,而HPMC相对溶胀性较低,因此本实验将两者混合使用能达到更好的黏附效果[12]。当HPMC/CP为4∶1时,缓释作用明显,与空白酵母胶囊相比,能显著延长药物在结肠停留时间,使药物缓慢释放。
(3)喷雾干燥试验因素中,进风温度对微球体外释放影响最显著,其次是进料速度,最后是雾化压力。以进风温度160℃、进料速度10mL·min-1、雾化压力0.5 MPa、出风温度85~95℃条件下喷雾干燥,所得微球能达到缓释12h的试验设计要求。
(4)运用单因素考察和正交试验确定的微球制备最佳处方和工艺合理可靠,重现性良好,与复乳-液中干燥法制备鲑鱼降钙素微球相比,本法不仅制得的微球具有良好的缓释效果,还可以直接应用于工业化生产[13]。
[1]Reginster J Y.Calcitonin for prevention and treatment of osteoporosis[J].Am JM ed,1995,95(Sup):44.
[2]Madeline T L,Peppas N A.Transmucosal delivery systems for calcitonin:a review[J].Biomaterials,2000,21:1191.
[3]Austin L A,Hunter H.Calcitonin:physiology and pathophysiology[J].N Engl JM ed,1981,304(5):269.
[4]Takahashi K I,Liu Y C,Hayashi N,et al.Production of bioactive salman calcitonin from the nonendocrine cell line COS27and CHO[J].Peptides,1997,18(3):439.
[5]刘阳,张志荣,韩静,等.6-巯基嘌呤结肠黏附缓释微丸的处方筛选及体外释放的研究[J].中国新药杂志,2008,17(17):1515-1518.
[6]Blanquet S,Marol-Bonnin S,Beyssac E,et al.The biodrug concept:an innovative approach to therapy[J].Trends Biotechnol,2001,19:393.
[7]宋益民,杨青,苏传东,等.酵母表达鲑鱼降钙素的降血钙活性和药动学研究[J].药物分析杂志,2010,30(5):775-779.
[8]Kohno T,Murasugi N,Sakurai H,et al.A sandwich transfer enzyme immunoassay for salmon calcitonin:determination of the bioavailability of internasal salmon calcitonin in human[J].J Clin Lab Anal,1997,11:380.
[9]Vishal K,Thomas E,James C,et al.A novel pH-and time-based multi-unit potential colonic drug delivery system [J].Int J Pharm,2001,213(1):83-91.
[10]陈大为,张彦青.灯盏花素缓释微丸制备工艺与处方优化的研究[J].中草药,2003,34(11):990-993.
[11]魏纪鲁,毕云生.生物粘附给药系统进展概况[J].药学实践杂志,2002,20(2):77-81.
[12]张正全,陆彬.药用生物黏附材料进展[J].中国药学杂志,2001,36(6):363-366.
[13]王永辉,冯前进,牛欣,等.鲑鱼降钙素微球的制备及其性质的研究[J].世界中西医结合杂志,2008,3(8):457-459.
