山东荣成天鹅湖大叶藻形态和生长的季节性变化研究
2014-12-02李文涛张秀梅
李 勇, 李文涛, 聂 猛, 张秀梅
(中国海洋大学 水产学院, 山东 青岛 266003)
海草(seagrass)属大型沉水被子植物, 具有高等植物的一般特征, 在水中完成生活史[1], 全球共有72种, 隶属13属, 6科[2]。大叶藻(Zostera marina L.)是北半球温带海域海草的典型代表, 通常在沿海潮间带和潮下带较浅的水域形成广大的海草床[3]。海草床是一种重要的滨海生态系统, 具有极其重要的生态功能: 是初级生产力最高的生态系统之一, 据估计其平均初级生产力的年净生产量(干质量)可达 1 012 g/m2[3];是众多海洋动物的栖息地、产卵场、庇护场及食物来源地[4]; 是附生生物群落的附着基, 以海草为附着基的各种附着生物的生物量可以达到海草地上部分生物量的 50%以上[5]; 降低水流速度[6], 改善水质;在近海碳氮循环以及平衡方面发挥着重要作用。但20世纪以来, 由于自然因素和人类活动的影响, 全球各地海草床面积大量减少。近年来, 全球海草床以每年 7% (110km2) 的速率在减少, 到目前为止已有高达近29%的海草床消失[7]。因此, 海草研究正成为世界各国海洋生态学家们关注的热点。
国外研究者对海草生态学的研究起步较早, 并取得了很多成果。包括海草的空间分布[8]、形态特征[9-11]、生产力[12]、降解[13]、种群和群落动力学[14]、环境因子和营养盐对海草生长的影响[15]、海草生态系统中的动物种类和数量[12]等。国内学者对海草的研究起步晚, 进展缓慢, 层次较低。杨宗岱等[16]对中国海草场的分布、生产力进行了研究, 范航清等[17-18]对广西沿海海草床作了较为系统的研究, 叶春江[19]对盐分胁迫对大叶藻生理功能的影响做了研究, 张沛东[20]、李文涛[5]等对山东沿海大叶藻移植、生态功能等做了较为详细的研究。许战洲[21]等综述了海草的生物量和生产力, 讨论了生产力的影响因素。目前国内对海草初级生产力的研究开展较少, 尚未见有对海草初级生产力进行连续监测的相关报道。天鹅湖海草场是山东半岛沿海面积最大的海草场, 刘炳舰[4]、刘旭佳等[22]曾对其中大叶藻的生态学特征进行了调查, 张晓梅[23]曾对其中矮大叶藻种群的生态特征进行了研究,然而到目前为止, 尚未见海草场中大叶藻初级生产力的相关研究报道。2012年8月至2013年7月, 作者逐月监测了山东荣成天鹅湖大叶藻的形态特征、植株密度、生物量和生产力, 比较了大叶藻形态和生长在不同时间的特征, 分析了这些指标在不同时间的差异与环境因子(水温, 冬季冰的刨蚀作用等)的关系, 以期为深入了解山东半岛沿岸大叶藻的形态和生长特征, 以及为我国海草生物学和生态学研究提供重要基础数据。
1 材料与方法
1.1 调查地点与时间
调查地点为山东省荣成市天鹅湖(37°20.3′~37°21.6′N, 122°33.2′~122°35.0′E)。天鹅湖位于成山镇东南部, 面积约 4.8 km2, 有外伸的沙坝与黄海相隔, 仅有约86 m的流口与大海相通, 是一个天然潟湖, 湖底为细沙或沙泥质, 年平均水温 14.7℃, 平均盐度30.6, 平均pH8.27, 潮汐为不正规半日潮[4]。天鹅湖里有大叶藻(Zostera marina L.)和矮大叶藻(Zostera japonica)两种海草分布, 其中大叶藻为优势种, 主要分布在潮间带和潮下带区域, 分布面积占天鹅湖面积的 40%左右[4], 由连续的海草床和海草斑块构成, 而矮大叶藻只分布在部分潮间带区域。2012年8月至2013年7月, 作者逐月监测了天鹅湖大叶藻的形态特征、植株密度、生物量和生产力。
1.2 实验方法
潮间带的大叶藻在冬季容易受到海冰的刨蚀和天鹅啮食的影响, 因此在潮下带的连续海草床区域设置调查站点(37°21.0′N, 122°34.7′E)。在每月低潮时段到大叶藻海草场调查采样, 测量大叶藻生长环境的水温。为研究大叶藻的形态和单株生物量, 在调查站位随机采集10株完整大叶藻(至少保留6个地下茎节间); 为研究大叶藻草场植株密度和单位面积生物量, 随机选取3个大小为25 cm×25 cm的样方, 将样方内的大叶藻连同地下茎一起采集, 样品均放入自封袋带回实验室。
为研究大叶藻的生产力, 逐月随机选取 10~15株大叶藻进行针孔标记[24], 1个月左右后采回, 计算新长出的叶片数, 并将新生长的叶以及一节成熟茎(一般为第4茎节[25-26])放入50℃的烘箱中烘干, 直至恒质量。新长出一片叶对应新长出一个茎节[27], 故地下部分生产力为新长出叶片数乘以一节成熟茎的干质量。
1.3 样品分析与数据处理
1.3.1 样品分析
用于研究形态和单株生物量的大叶藻带回实验室后, 用刀片将叶片上的附着生物刮净, 并用清水将植株冲洗干净。一些叶片上钙质结壳较多, 用稀盐酸将其溶解[28]。每株大叶藻的叶片数从叶鞘的上端进行记数; 叶鞘的长度为自分生组织至叶鞘的顶端,植株高度自分生组织至最长叶片的顶端; 大叶藻的叶鞘和叶片宽度分别在叶鞘和最新长出的成熟叶片(一般为第2片叶)的中间位置测量。切取地下茎第一到第6节间部分(从分生组织算起), 然后测量每个节间的长度、直径(取每个节间中间部位的值)[27]。嫩茎、成熟茎和老茎的节间长度和直径分别为第 1-2, 3-4和5-6节间的节间长度和直径的平均值。测量结束后置于烘干箱内烘至恒质量, 并称量大叶藻各部分的干质量。
用于研究植株密度和单株生物量的大叶藻带回实验室后, 将大叶藻分为顶枝、侧枝和生殖枝, 并记数, 测量密度, 然后将每个样方中的大叶藻分为地上部分和地下部分, 放入 50℃的烘箱中烘干, 直至恒质量, 并称量其干质量。
1.3.2 数据处理
采用Excel 2007以及SPSS19.0对实验数据进行统计学分析, 对叶片长度、叶鞘高度和株高、叶宽和叶鞘宽度、地下茎和根以及大叶藻的生物量和生产力等在不同月份的监测值进行单因素方差分析, 观测值以平均值±标准误差(± SE)表示, 以P<0.05作为差异显著水平。
2 结果
2.1 水温
天鹅湖表层海水水温呈现明显的季节变化, 春季开始升高, 夏季升到最高, 秋季开始下降, 冬季降至最低。水温在0.7~27.8℃之间, 最高水温27.8℃出现在8月, 最低水温0.7℃出现在1月(图1)。

图1 天鹅湖水温的周年变化Fig.1 Annual changes of water temperature in Swan Lake
2.2 形态特征
2.2.1 叶片数、叶鞘高和株高
大叶藻叶片数呈现明显的季节变化(P<0.05), 春季和秋季多于冬季和夏季。春季4月叶片数最多, 为6.4片±0.4片, 随后开始下降, 夏季7月叶片数最少,只有 3.1片±0.1片, 初秋有所上升, 随后又开始下降, 冬季保持较低值(图2)。
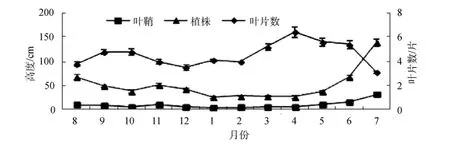
图2 大叶藻叶片数、叶鞘高和株高的季节变化Fig.2 Seasonal variations in the number of leaves, sheath and shoot height of eelgrass
大叶藻叶鞘高度和株高均显现出明显的季节变化(P<0.05), 春季开始不断升高, 最高值 32.4 cm±1.1 cm和139.0 cm±7.1 cm均出现在7月, 随后开始下降, 冬季降至最低, 最低值5.4 cm±0.3 cm和27.4 cm±2.3 cm均出现在1月(图2)。
2.2.2 叶和叶鞘的宽度
大叶藻叶和叶鞘的宽度均呈现明显的季节变化(P<0.05), 春季开始不断升高, 4月因大量侧枝的出现, 导致大叶藻叶和叶鞘的宽度的平均值较低, 夏末开始降低, 冬季降至最低。最大值6.58 mm±0.25 mm和6.75 mm±0.27 mm均出现在7月, 随后开始不断降低(11月数据出现非正常变动可能是因为实际采样的原因), 冬季降至最低值, 最小值4.00 mm±0.14 mm和4.37 mm±0.18 mm均出现在2月(图3)。
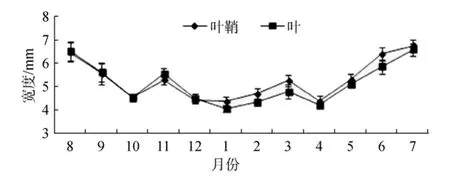
图3 大叶藻叶和叶鞘宽度的季节变化Fig.3 Seasonal variations in sheath and leaf width of eelgrass
2.2.3 地下茎
大叶藻地下茎的节间长度随着大叶藻地下茎节间的龄级而变化。一般第1节间长度最小, 通常在第3~4节间达到最大值。嫩茎、成熟茎和老茎的节间长度均随季节变化显著(P<0.05)。春季水温开始升高,嫩茎开始加快生长, 此时嫩茎节间长度大于成熟茎和老茎, 秋季和冬季嫩茎生长减慢, 嫩茎节间长度小于成熟茎和老茎。嫩茎、成熟茎和老茎的节间长度最大值分别出现在9月、11月和1月, 分别为1.31 cm±0.11 cm、1.68 cm±0.17 cm和1.66 cm±0.19 cm, 最小值分别出现在2月、4月和5月, 分别为0.60 cm±0.11 cm、0.72 cm±0.04 cm和0.39 cm±0.04 cm。10月、11月和 1月, 嫩茎的长度显著小于成熟茎和老茎, 2月和3月嫩茎和成熟茎的节间长度显著小于老茎, 而5月则显著大于老茎(P < 0.05)(图4A)。
嫩茎、成熟茎和老茎的节间直径均随季节变化显著(P<0.05), 春季随着水温的升高, 嫩茎生长加快,此时嫩茎的节间直径长于成熟茎和老茎, 秋季和冬季嫩茎生长减慢, 嫩茎的节间直径小于成熟茎和老茎。嫩茎、成熟茎和老茎的节间直径的最大值均出现在9月, 分别为3.22 cm±0.12 cm、3.27 cm±0.21 cm和3.21 cm±0.12 cm, 最小值分别出现在10月、6月和6月, 分别为2.44 cm±0.22 cm、2.21 cm±0.14 cm和1.88 cm±0.18 cm。10月和11月老茎的节间直径显著长于嫩茎和成熟茎, 而5月和6月老茎和成熟茎则显著小于嫩茎(P < 0.05)(图4B)。

图4 大叶藻地下茎节间长度(A)和直径(B)的季节变化Fig.4 Seasonal variations in the rhizome internode length(A) and diameter(B)of eelgrass
2.3 植株密度和生物量
大叶藻顶枝和侧枝密度随季节变化明显(P <0.05, 图5)。顶枝密度在春季开始升高, 最高出现在夏季 6月, 为 384 株/m2±91株/m2, 随后开始下降,初秋有所升高, 随后继续下降, 冬季降至最低, 最小值出现在1月, 为138 株/m2±19 株/m2。侧枝密度在春季也开始上升, 最高出现在春季4月, 为523 株/m2±56 株/m2, 随后开始下降, 最小值出现在 8月, 为91 株/m2±11 株/m2。1~5月和 7月间大叶藻侧枝密度高于顶枝, 而其他月份顶枝密度高于侧枝。花枝出现在 4~7月, 5月密度达到最大, 为 223 株/m2±23 株/m2。
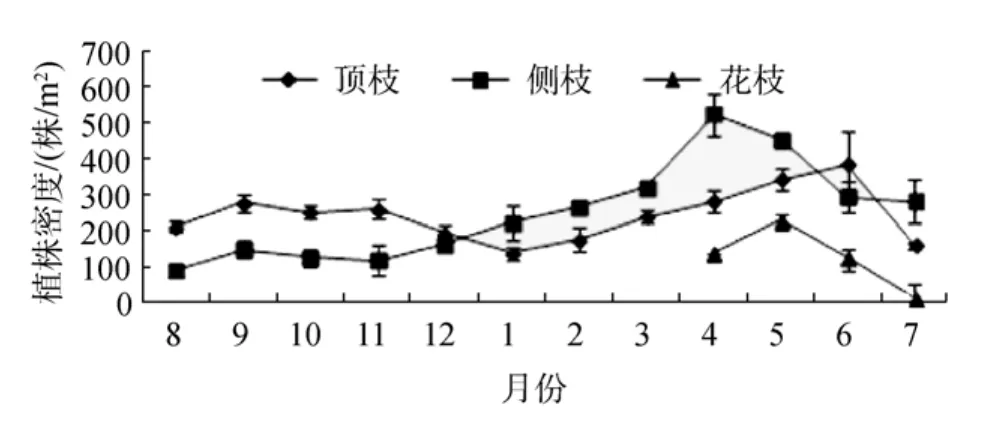
图5 大叶藻顶枝、侧枝以及生殖枝密度的季节变化Fig.5 Seasonal variations in terminal, lateral and reproductive shoot densities
大叶藻单株生物量随季节变化显著(P< 0.05),春季开始迅速上升, 最大值出现在7月份, 干质量为1.19 g /株±0.12g /株, 夏末开始降低, 冬季降至最低值, 最小值出现在1月份, 为0.25 g /株±0.03 g /株;大叶藻地上部分生物量也随季节变化显著(P < 0.05),春季开始上升, 最大值出现在7月份, 为1.07 g /株±0.11 g /株, 随后开始降低, 冬季降至最低值, 最小值出现在1月份, 为0.13 g /株±0.01 g /株; 大叶藻地下部分生物量随也季节变化显著(P < 0.05), 最大值出现在10月份, 为0.23 g /株±0.05 g /株, 最小值出现在 3 月份, 为 0.08 g /株± 0.01 g /株(图 6)。
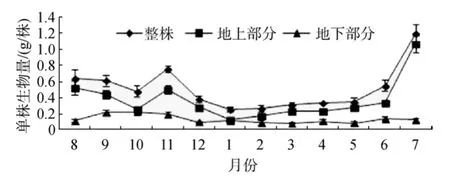
图6 大叶藻单株生物量的季节变化Fig.6 Seasonal variations in shoot biomass of eelgrass
大叶藻单位面积(整株)生物量也呈明显的季节变化(P<0.05)(图 7), 春季开始快速上升, 夏末开始降低, 冬季降至最低值。单位面积生物量最大值和最小值分别出现在7月和1月, 干质量分别为378.64 g /m2±38.08 g /m2和 63.47 g /m2±7.52 g /m2; 单位面积地上部分生物量最大值和最小值也分别出现在 7月和 1月, 分别为 338.79 g /m2±34.91 g/m2和 33.42 g /m2±2.51 g/m2; 单位面积地下部分生物量的最大值和最小值分别出现6月和12月, 分别为94.85 g /m2±13.17 g /m2和26.87 g /m2±2.75 g /m2。大叶藻地上部分与地下部分生物量的比例也随季节变化显著(P<0.05)(图 7),春季和夏季地上部分与地下部分生物量的比例高于秋季和冬季, 最大值和最小值分别出现在7月和10月, 分别为 8.15±0.90 和 1.43±0.33 (图 7)。
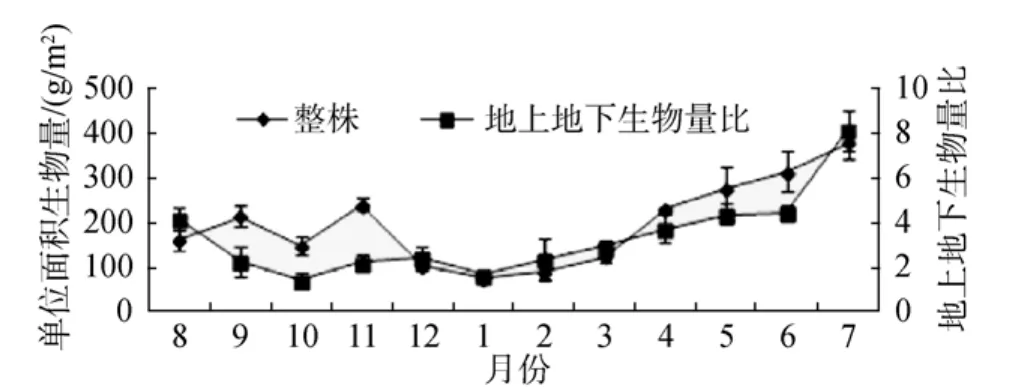
图7 大叶藻草场生物量和地上部分与地下部分生物量比例的季节变化Fig.7 Seasonal variations in the biomass and above-/below-ground biomass ratio of eelgrass
2.4 初级生产力
大叶藻单株地上部分和地下部分生产力均随季节变化显著(P<0.05, 图8A)。单株地上部分和地下部分生产力在春季均不断升高, 最高值均出现在夏季6月, 干质量分别为 16.62 mg/ (株·d)±1.59 mg/(株·d) 和2.72 mg/(株·d)±0.50 mg/ (株·d), 随后开始降低, 冬季1 月和 2 月最低, 分别为 0.67 mg/ (株·d)±0.09 mg/ (株·d)和 0.50 mg/ (株·d)±0.19 mg/ (株·d)。
大叶藻单位面积地上和地下生产力也随季节变化明显(P<0.05, 图 8B)。单位面积地上生产力在春季不断升高, 最高值出现在夏季 6月, 为 8.82 g/(m2·d)±0.84 g/(m2·d), 夏末开始降低, 冬季 1月最低, 为0.20 g/(m2·d)±0.03 g/(m2·d); 单位面积地下生产力大小依次为: 春季, 夏季, 秋季, 冬季, 在6月和2月达到最大值和最小值, 分别为 1.44 g/(m2·d)±0.26 g/(m2·d)和 0.17 g/(m2·d)±0.06 g/(m2·d)。
2.5 形态特征和生长随水温的变化
2.5.1 株高和植株密度随水温的变化
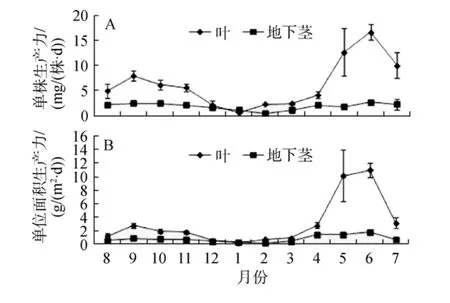
图8 大叶藻草场单株(A)和单位面积生产力(B)的季节变化Fig.8 Seasonal variations in the shoot(A) and unit area productivity(B) of eelgrass meadow
大叶藻株高从春季开始随水温的升高而升高,在7月达到最大值, 此时水温为23.5℃, 随着水温的继续升高, 大叶藻株高下降。株高从秋季到冬季随水温的降低而降低, 在 1月降至最低值, 此时水温为0.7℃(图 9A)。
大叶藻植株密度在春季随水温的升高而不断升高, 在5月达到最大值, 此时水温为16.9℃。随着水温的继续升高, 侧枝大量减少, 植株密度开始下降,从秋季到冬季随着水温的不断下降, 植株密度呈下降的趋势(图9B)。
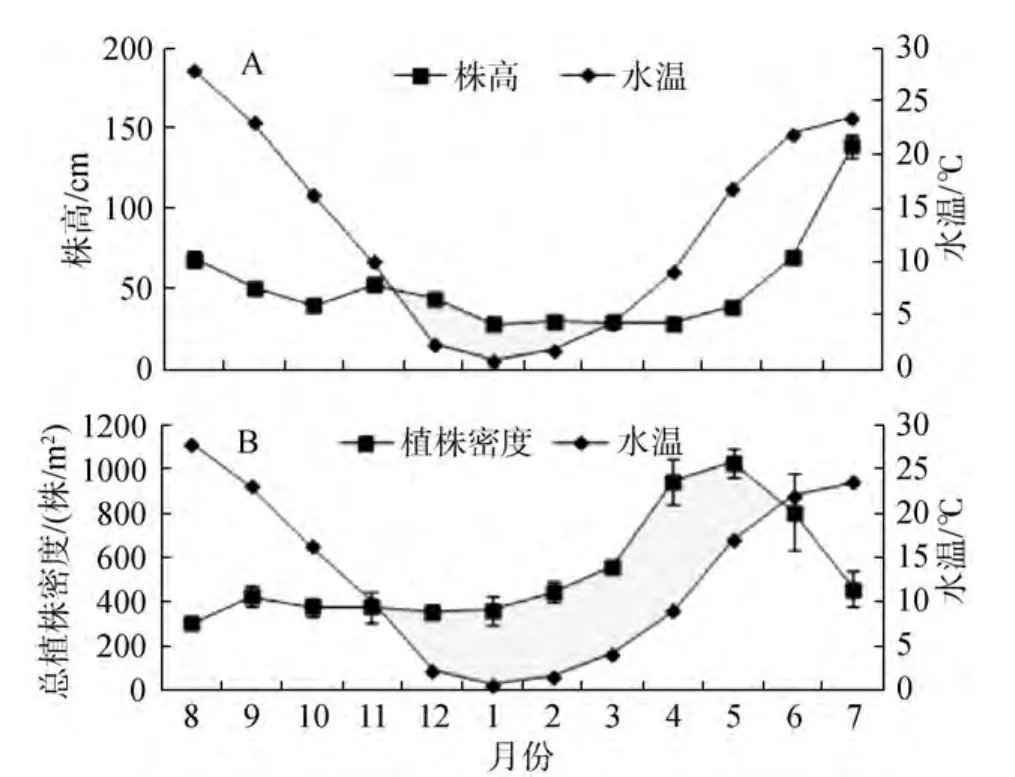
图9 大叶藻株高(A)和植株密度(B)随水温的变化Fig.9 Changes in the height (A) and shoot density (B)of eelgrass with water temperature
2.5.2 单位面积生物量和叶片生产力随水温的变化
大叶藻单位面积生物量从春季开始随水温的升高而升高, 在7月份达到最大值, 此时水温为23.5℃。随着水温继续升高, 大叶藻单位面积生物量开始下降, 从秋季到冬季随着水温的降低, 大叶藻生物量呈下降趋势, 在1月份降至最低值, 此时水温为0.7℃(图 10A)。
大叶藻叶片生产力从春季开始也随水温的升高而升高, 在6月份达到最高值, 此时水温为21.9℃。随着水温继续上升, 叶片生产力开始降低, 从秋季到冬季随水温的降低而降低, 在 1月份降至最低值,此时水温为0.7℃(图10B)。
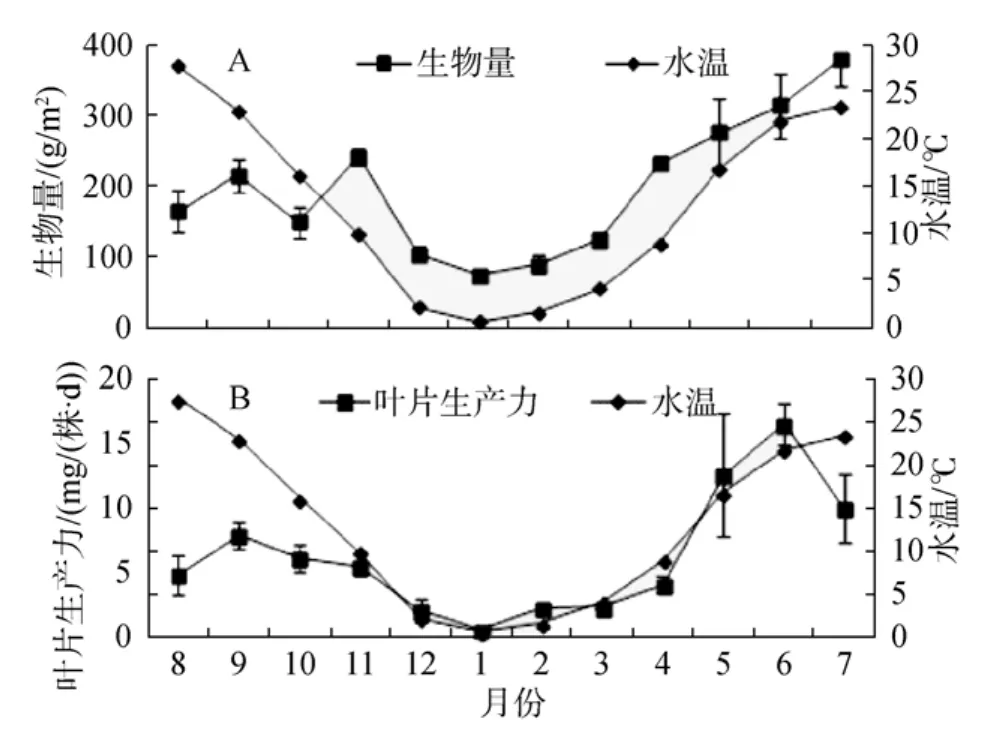
图10 大叶藻生物量(A)和生产力(B)随水温的变化Fig.10 Changes in biomass (A) and productivity(B) of eelgrass with water temperature
3 讨论
3.1 大叶藻形态特征的季节变化
大叶藻地上部分一年四季不断更新, 每新长出一片叶子, 则会对应一个新生出的地下茎节间, 而脱落的叶片的地下茎原连接点就成为地下茎节[25]。虽然大叶藻一年四季都会生长, 但其生长受到温度、光照等条件的影响[29], 而由于天鹅湖水深较浅, 所以水下光照变化不大, 水温是影响大叶藻生长的主要因子。春季大叶藻生长迅速, 每长出一片新叶所需时间间隔(间隔期, Plastochron)短, 故叶片数量很大,而夏季虽然生产力也很高, 但连续叶片出现的间隔期较长, 叶片长度和宽度数值显著增大[30], 其株高与位于山东半岛南端的青岛湾、汇泉湾以及山东半岛东北端的双岛湾大叶藻相似[22,31], 但高于同处山东半岛东端的桑沟湾大叶藻[32]。而夏季较高的水温可能导致天鹅湖大叶藻较多的衰老叶脱落, 故叶片数量较小, 而冬季水温很低, 大叶藻生长缓慢, 叶片数量也较少。研究表明, 当水温超过20℃时, 大叶藻的生长就会受到限制[29]。大叶藻叶片长度、叶鞘长度、株高、叶鞘宽度、叶宽以及地下茎节间长度等在8月份明显降低, 这可能是因为8月份天鹅湖水温过高(约 28℃), 退大潮时部分海草甚至直接暴露在强光下, 抑制了大叶藻的生长。而冬季过低的水温导致大叶藻生长缓慢, 加上冰层的刨蚀作用以及天鹅的摄食作用, 大叶藻叶片长度等形态特征值明显降低, 其株高变得低于青岛湾、汇泉湾以及双岛湾大叶藻[22,31], 但略高于位于山东半岛东端的桑沟湾大叶藻[32]。
3.2 大叶藻密度和生物量的季节变化
在春季, 大叶藻生长迅速, 长出大量侧枝, 大叶藻侧枝的密度远远大于主枝的密度, 从而导致大叶藻密度迅速提高; 而夏、秋季的高温抑制了大叶藻的生长, 再加上大量开花植株死亡脱落, 导致大叶藻密度迅速降低, 而高温也抑制了侧枝的萌出, 从而导致主枝的密度高于侧枝的密度。总的来说, 天鹅湖大叶藻的植株密度较高, 其周年平均总密度大于青岛湾、桑沟湾和朝鲜半岛南部的巨济湾等海域[22,33]。
由于天鹅湖水深较浅, 冬季天文大潮时大叶藻能露出水面, 所以大叶藻容易受到极寒天气的影响,在水温最低时其生物量达到最低值, 其单位面积生物量低于青岛湾和汇泉湾大叶藻, 而夏季天鹅湖大叶藻单位面积生物量达到最大值, 与青岛湾和汇泉湾大叶藻接近[22]。天鹅湖大叶藻地下部分与地上部分生物量的比例在秋季达到最高值, 这与朝鲜半岛南部巨济湾等海域大叶藻一致[33], 大叶藻地下部分在秋季保持较高的生物量, 有利于大叶藻为冬天以及第二年春天的生长储存能量。
研究表明, 大叶藻叶片生长的光饱和强度低于地下茎, 在光照较弱时, 叶片可以继续生长, 而地下茎重量甚至会减轻, 而在较强的光照下, 叶片和地下茎重量都会增加[34]。本研究中, 大叶藻地下部分生物量与地上部分生物量比例最大值出现在秋季, 可能是因为地下茎部分从冬季到秋季生物量的增加率高于地上部分同期的增加率。
3.3 大叶藻生产力的季节变化
虽然春季有适合大叶藻生长的水温和光照, 但春天大叶藻单株地上生物量较小, 夏天大叶藻单株地上生物量远远大于春天, 所以大叶藻单株地上生产力最高值出现在夏天的6月份。因为6月份大叶藻密度较高, 大叶藻单位面积地上生产力最大值也出现在6月份, 而到了8月份, 水温过高, 光照过强,抑制了大叶藻叶片的生长, 地上单株生产力显著降低, 而到了1月份水温降到最低, 加上冰层的刨蚀以及天鹅的摄食, 大叶藻地上生产力降到最低。天鹅湖大叶藻地上部分生产力低于朝鲜半岛南部近岸海域以及丹麦厄勒海峡大叶藻[33,35], 略高于美国北卡罗来纳州近岸海域大叶藻[36]。
大叶藻单株地下生产力最高值出现在秋季, 可能是因为大叶藻地下部分生长具有较高的光饱和点[37],加之秋季大叶藻地上部分生长较慢, 克隆生长也很慢, 大叶藻可以将更多的能量用于地下茎的生长。大叶藻单位面积地下部分生产力最大值出现在春季,可能是因为春季大叶藻生长迅速, 而且密度较大。
大量研究表明, 众多因素中, 水温是控制大叶藻生长的主要因素[38-39]。温度影响有机体的生物化学过程, 大叶藻的净光合速率随水温而变化, 当水温达到最适水温时, 净光合速率达到最大值, 温度超过海草的最适生长水温后, 光合速率下降, 呼吸速率升高, 净光合速率降低。大叶藻的生长受高温的抑制比低温更剧烈[40], 夏末大叶藻生长速度降低可能是高温对大叶藻生长抑制造成的, 因此天鹅湖大叶藻生长呈现的明显的季节性变化与水温的季节性变化密切相关。
[1] 许战洲, 黄良民, 黄小平, 等. 海草生物量和初级生产力研究进展[J]. 生态学报, 2007, 27(6): 2594-2602.
[2] Short F T, Polidoro B, Livingstone S R, et al. Extinction risk assessment of the world’s seagrass species [J].Biological Conservation, 2011, 144: 1961-1971.
[3] Duarte C M, Chiscano C L. Seagrass biomass and production: a reassessment [J]. Aquatic Botany, 1999,65: 159-174.
[4] 刘炳舰. 山东典型海湾大叶藻资源调查与生态恢复的基础研究[D]. 青岛: 中国科学院海洋研究所,2012.
[5] 李文涛, 张秀梅. 海草场的生态功能[J]. 中国海洋大学学报, 2009, 39(5): 933-939.
[6] Bos A R, Bouma T J, de Kort G L J, et al. Ecosystem engineering by annual intertidal seagrass beds:Sediment accretion and modification[J]. Estuarine,Coastal and Shelf Science, 2007, 74: 344-348.
[7] Waycott M, Duarte C M, Carruthers T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Ecology, 2009, 106: 12377-12381.
[8] Short F, Carruthers T, Dennison W, et al. Global seagrass distribution and diversity: A bioregional model[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350: 3-20.
[9] Eichler A W. Blutendiagramme.I[M]. Leipzig: Verlag Wilhelm Engelmann: 348.
[10] De Cock A. Flowering, pollination and fruit development in Zostera marina L.[J]. Aquatic Botany,1980, 9: 201-220.
[11] De Cock A. Development of the flowering shoot of Zostera marina L. under controlled conditions in comparison to the development in two different natural habitats in the Netherlands[J]. Aquatic Botany, 1981,10: 99-113.
[12] Hemminga M A, Duarte C M. Seagrass Ecology[M].Cambridge: Cambrige University Press, 2000: 20-22.
[13] Godshalk G L, Wetzel R G. Decomposition of aquatic angiosperms .Ⅲ. Zostera marina L. and a conceptual model of decomposition[J]. Aquatic Botany, 1978, 5:329-354.
[14] Thorhaug A, Roessler M A. Seagrass community dynamics in a subtropical estuarine lagoon[J]. Aquaculture, 1977, 12: 253-277.
[15] Lee K S, Park S R, Kim Y K. Effects of irradiance,temperature, and nutrients on growth dynamics of seagrasses: a review[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1): 144-175.
[16] 杨宗岱, 吴宝玲. 中国海草床的分布、生产力及其结构与功能的初步探讨[J]. 生态学报, 1981, 1(1):84-89.
[17] 范航清, 彭胜, 石雅君, 等. 广西北部湾沿海海草资源与研究现状[J]. 广西科学, 2007, 14(3): 289-295.
[18] 范航清, 郑杏雯. 海草光合作用研究进展[J]. 广西科学, 2007, 14(2): 180-185, 192.
[19] 叶春江, 赵可夫. 盐分胁迫对大叶藻某些胞内酶耐盐性及其生理功能的影响[J]. 植物学报, 2002, 44(7):788-794.
[20] 张沛东, 曾星, 孙艳, 等. 海草植株移植方法的研究进展[J]. 海洋科学, 2013, 37 (5): 100-107.
[21] 许战洲, 黄良明, 黄小平, 等. 海草生物量和初级生产力研究进展[J]. 生态学报, 2007, 27(6): 2594-2602.
[22] 刘旭佳. 山东近岸海域大叶藻的生态学初步研究[D].青岛: 中国海洋大学, 2011.
[23] 张晓梅. 山东沿海矮大叶藻基础生物学与生态恢复研究[D]. 青岛: 中国科学院海洋研究所, 2013.
[24] Short F T, Coles R G. Global Seagrass Research Methods[M]. Amsterdam: Elsevier Science, 2001:160-168.
[25] Gaeckle J L, Short F T. A plastochrone method for measuring leaf growth in eelgrass, Zostera marina L.[J].Bulletin of marine science, 2002, 71: 1237-1246.
[26] Jacobs R. Distribution and aspects of the production and biomass of eelgrass, Zostera marina L., at Roscoff,France. Aquatic Botany[J]. 1979, 7: 151-172.
[27] 李文涛, 张秀梅. 移植大叶藻的形态、生长和繁殖的季节性变化[J]. 中国水产科学, 2010, 17(5): 977-986.
[28] Bandeira S O. Dynamics, biomass and total rhizome length of the seagrass Thalassodendron ciliatum at Inhaca island, Mozambique[J]. Plant Ecology, 1997,130: 133-141.
[29] Lee K S, Park S R, Kim Y K. Effects of irradiance,temperature, and nutrients on growth dynamics of seagrasses: A review[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350: 144-175.
[30] Shinya Hosokawa. A model for measuring leaf growth rate of vegetative shoot in the seagrass, Zostera marina[J]. Ecological Modelling, 2011, 222: 105-111.
[31] 郑凤英, 韩晓弟, 张伟, 等. 大叶藻形态及生长发育特征[J]. 海洋科学, 2013, 37(10): 39-46.
[32] 刘炳舰, 周毅, 刘旭佳, 等. 桑沟湾楮岛近岸海域大叶藻生态学特征的基础研究[J]. 海洋科学, 2013,37(1): 42-48.
[33] Lee K S, Park S R, Kim J B. Production dynamics of the eelgrass, Zostera marina in two bay systems on the south coast of the Korean peninsula[J]. Marine Biology,2005, 147(5): 1091-1108.
[34] Olesen B. Seasonal acclimatization of eelgrass Zostera marina growth to light[J]. Marine Ecology Progress Series, 1993, 94: 91-99.
[35] Borum J, Kaas H, Wium-Andersen S. Biomass variation and autotrophic production of an epiphytemacrophyte community in a coastal Danish area: II.Epiphyte species composition, biomass and production[J]. Ophelia, 1984, 23(2): 165-179.
[36] Penhale P A. Macrophyte-epiphyte biomass and productivity in an eelgrass (Zostera marina L.) comm-unity[J]. Journal of Experimental Marine Biology and Ecology, 1977, 26(2): 211-224.
[37] Macauley J M, Clark J R, Price W A. Seasonal changes in the standing crop and chlorophyll content of Thalassia testudinum Banks ex König and its epiphytes in the northern Gulf of Mexico[J]. Aquatic botany,1988, 31(3): 277-287.
[38] Tutin T G. Zostera L.[J]. Journal of Ecology, 1942,30(1): 217-226.
[39] Phillips R C, McMillan C, Bridges K W. Phenology of eelgrass, Zostera marina L., along latitudinal gradients in North America[J]. Aquatic Botany, 1983, 15(2):145-156.
[40] Zharova N, Sfriso A, Voinov A, et al. A simulation model for the annual fluctuation of Zostera marina biomass in the Venice lagoon[J]. Aquatic Botany, 2001, 70: 135-150.
