利用叶绿素荧光方法检测东海浮游植物的营养盐限制
2014-12-02沙相宇齐红菊王昭玉谭丽菊王江涛
沙相宇, 齐红菊, 王昭玉, 谭丽菊, 王江涛
(中国海洋大学 化学化工学院, 山东 青岛 266100)
东海是我国典型的陆架边缘海, 受到气候变化和人类活动的双重影响, 长江口及东海海域海洋生态环境一直发生着变化。20世纪末以来, 随着近海养殖业及沿岸工业的发展, 长江径流和海上污染物的排放向东海海域输入了大量有机态和无机态的营养物质, 导致东海海域营养盐浓度升高, 形成了其特有的富营养环境[1-4]。丰富的营养盐是微藻生长及赤潮暴发的物质基础, 东海海域目前已经成为我国赤潮发生严重的区域。
营养盐在时间和空间分布上是动态变化的, 而且浮游植物对氮、磷等营养元素的吸收、储存能力以及利用细胞内的营养元素进行生存的潜力是不同的, 如徐宁等[5]发现裸甲藻虽然比柔弱海链藻和角毛藻对DIN、DIP的需求量较高, 低P的环境下一样可以暴发甲藻的赤潮。因此, 通过传统的、重复性的营养盐测定来判断一个海区的营养水平, 尤其是评估该海域浮游植物的光合作用等生理状况已经不再是一个易行、有效的方法。本研究试图通过叶绿素荧光变化来评估浮游植物的光合作用效率的高低,进而快速(24 h)、简便的检测海水中营养盐对浮游植物生长的影响。
1 调查区域及站位分布
2011年6月10日- 6月27日利用“科学3号”科考船, 对长江口及东海陆架(120.8333°~126.0000°E,32.5000°~25.3450°N)海域进行了现场调查, 调查区域及站位如图 1所示。大面站水样由内附聚四氟乙烯涂层的采水器进行采集, 现场培养所用的海水为DH2-3站和 DH6-2站采集的表层海水, 分别为图 1中上、下方框标出的站位。
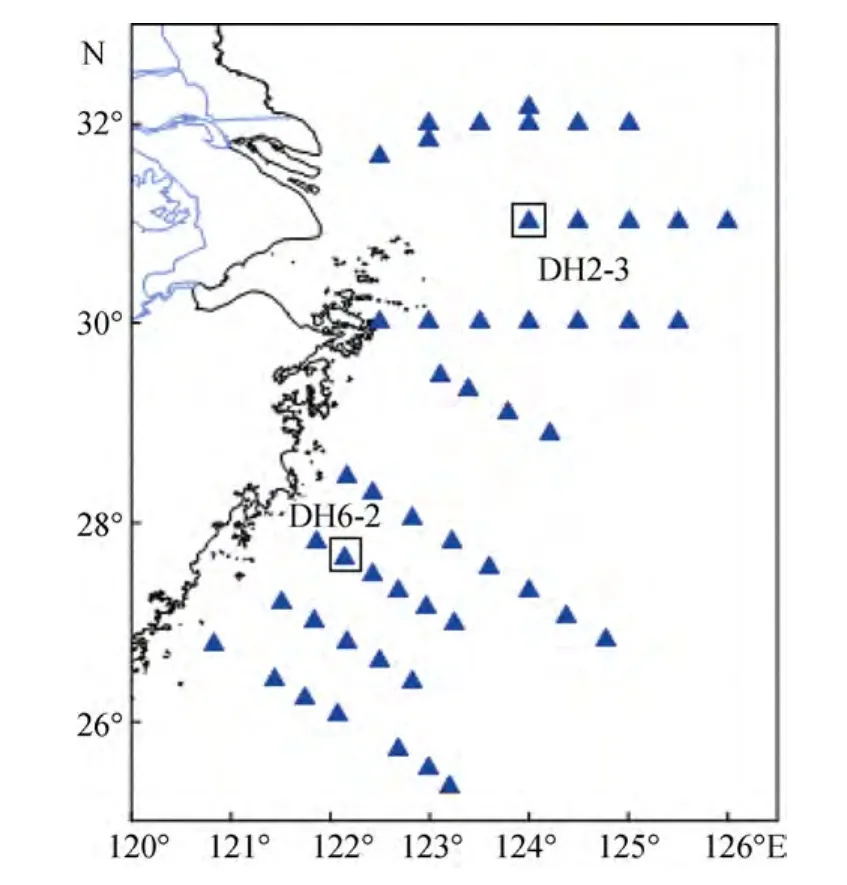
图1 长江口及东海陆架大面调查站位图Fig.1 Sampling stations in the East China Sea
2 样品分析
2.1 现场培养实验
现场培养实验所用的海水为 DH6-2、DH2-3站位采集的表层海水。培养所用容器为透明聚乙烯材料塑料桶, 培养容器的体积约为 5L。将上述培养容器置于两侧凿有进出水孔的塑料箱中。为保持培养实验的水温与现场海水一致(现场水温维持在 18℃左右), 实验过程中用水泵将现场海水抽入塑料箱作为循环水, 并调整进出水口的大小使进出水的流量平衡。整套培养装置固定于“科学3号”科考船后甲板。
实验设计了8种不同的营养盐添加方式, 分别为加N组; 加P组; 加Si组; 加N, P组; 加N , Si组; 加P , Si组; 加N , P , Si组和对照组, 实验中添加的NO3-N、PO4-P、SiO3-Si营养盐浓度如表1所示。

表1 现场培养实验中添加的营养盐浓度(μmol/L)Tab.1 The concentration of nutrient added in the microcosm experiment ((μmol/L))
实验共设两组, 每组8个培养桶。每个桶中加入过滤后混匀的4 L现场海水(200 μm筛绢过滤, 去除大体积的生物), 然后分别加入营养盐, 使浓度和表1一致。营养盐添加完毕后将培养桶放入塑料箱中进行水浴培养。实验开始前取培养基, 测定水样初始的Fv/Fm。同时取样并固定, 带回实验室进行生物种类及生物量分析。培养24 h后测定各培养组的Fv/Fm,同时取样进行营养盐和生物量的分析。
2.2 分析方法
营养盐水样现场用 GF/F 玻璃纤维滤膜过滤后存于冰柜冷冻保存, 带回实验室用营养盐自动分析仪(Bran+Luebbe, Germany)测定。活体荧光叶绿素和Fv/Fm在现场由 bbe藻类分析仪(bbe cuvette fluorometer, bbe Moldaenke, Germany)测定。该海域暗适应1 h基本上可以消除昼夜变化带来的影响, 因此测定 Fv/Fm前都通过暗适应消除光对该方法的影响。浮游植物用鲁戈试剂固定后在倒置显微镜下鉴定计数。水浴温度由温度计现场测定。
3 实验结果及讨论
3.1 调查海域叶绿素、Fv/Fm的平面分布
从叶绿素分布(图2)可以看出, 0 m层叶绿素浓度范围为0~22 μg/L; 10 m层叶绿素浓度范围为0~10 μg/L,叶绿素高值区与 0 m层高值区分布一致, 但总体浓度略微偏低; 20 m层叶绿素浓度范围为0~5 μg/L, 为三个调查层次叶绿素浓度最低的层。
Fv/Fm的平面分布与叶绿素的平面分布较为一致, 呈现出明显的近岸高, 外海低的趋势。
3.2 现场营养盐加富培养实验
本次现场培养所用海水为DH2-3站和DH6-2站采集的表层海水。
由图 3可知, DH2-3站初始水样中, 硅藻约占60%, 为优势藻, 经过24 h培养后, 优势种未发生明显变化, 因此可以排除群落结构对方法造成的影响[6]。DH6-2站, 初始水样中, 硅藻甲藻所占比例相似, 分别为35%、40%。经过24 h培养后, 比例未发生明显变化。
DH2-3站和 DH6-2站营养盐加富培养过程中,Chl和Fv/Fm的变化如图4所示。
从图4可以看出, DH2-3站水样的Chl 初始浓度为4.00 μg/L, Fv/Fm初始值为0.40。与初始Chl浓度相比, 加N组; 加N、P组; 加N、Si组和加N、P、Si组24 h内叶绿素浓度增大; 而加P组、加Si组、加P、Si组和对照组24 h内浓度降低。与初始Fv/Fm相比, 加N组; 加N、P组和加N、P、Si组24 h内参数值增大; 而加P组、加Si组和对照组24 h内参数值降低; 加N、Si组和加P、Si组Fv/Fm24 h内没有变化。
DH6-2站水样的 Chl 初始浓度为 2.80 μg/L,Fv/Fm初始值为0.40。与初始Chl浓度相比, 加N组;加N、P组; 加N、Si组和加N、P、Si组24 h内浓度增大; 而加 P组; 加 Si组; 加 P、Si组和对照组24 h内浓度降低。与初始Fv/Fm相比, 加N组; 加N、P组; 加N、Si组和加N、P、Si组24 h内参数值增大; 而加P组、加Si组、加P、Si组和对照组24 h内参数值降低。
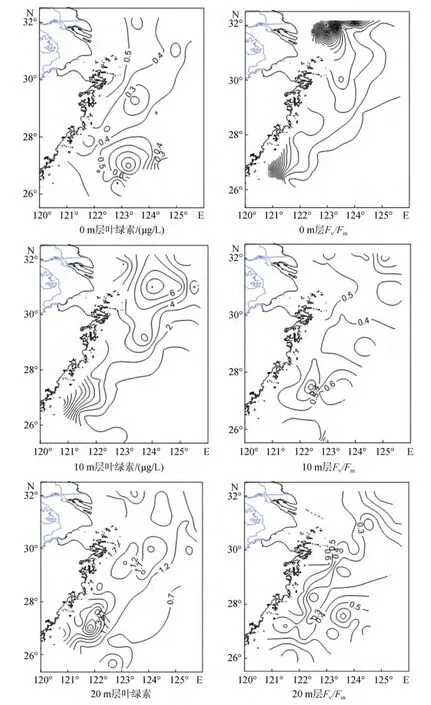
图2 调查海域叶绿素及Fv/Fm的平面分布Fig.2 The horizontal distribution of Chl and Fv/Fm
分析数据可发现, 两个站位普遍表现出培养基中N的添加使得Chl浓度和Fv/Fm数值增大, N的加富使得藻细胞的生长速度和细胞活性增强, 不同加N组的各参数增长幅度不一样, 是因为水样中藻类对不同营养盐比例的反应不同所导致的。而无N添加的加P组和加Si组Chl浓度和Fv/Fm未见增大。另外, 未加N组的Chl浓度和Fv/Fm相比于对照组有所减小, 是因为加入的其他营养盐导致N: P或者N: Si比例进一步减小, 加剧了藻细胞受到N限制的程度。从以上的数据分析都可以推出, 原始水样中N含量不足, N的缺乏限制了藻细胞的生长和生理活性。
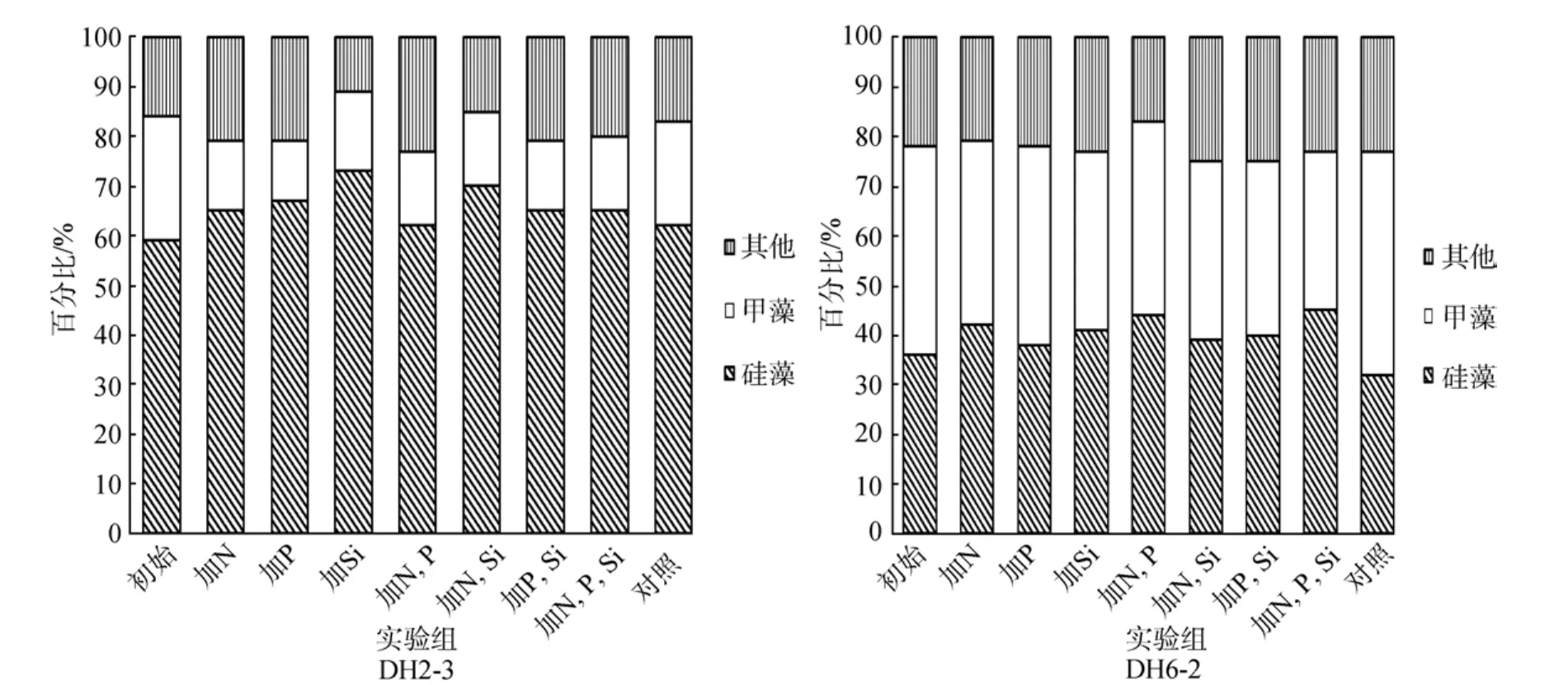
图3 DH2-3和DH6-2站营养盐加富培养24 h后优势种所占比例的变化Fig.3 Changes in the composition of dominant species after 24 hs culture with enriched nutrients at DH2-3 and DH6-2 station
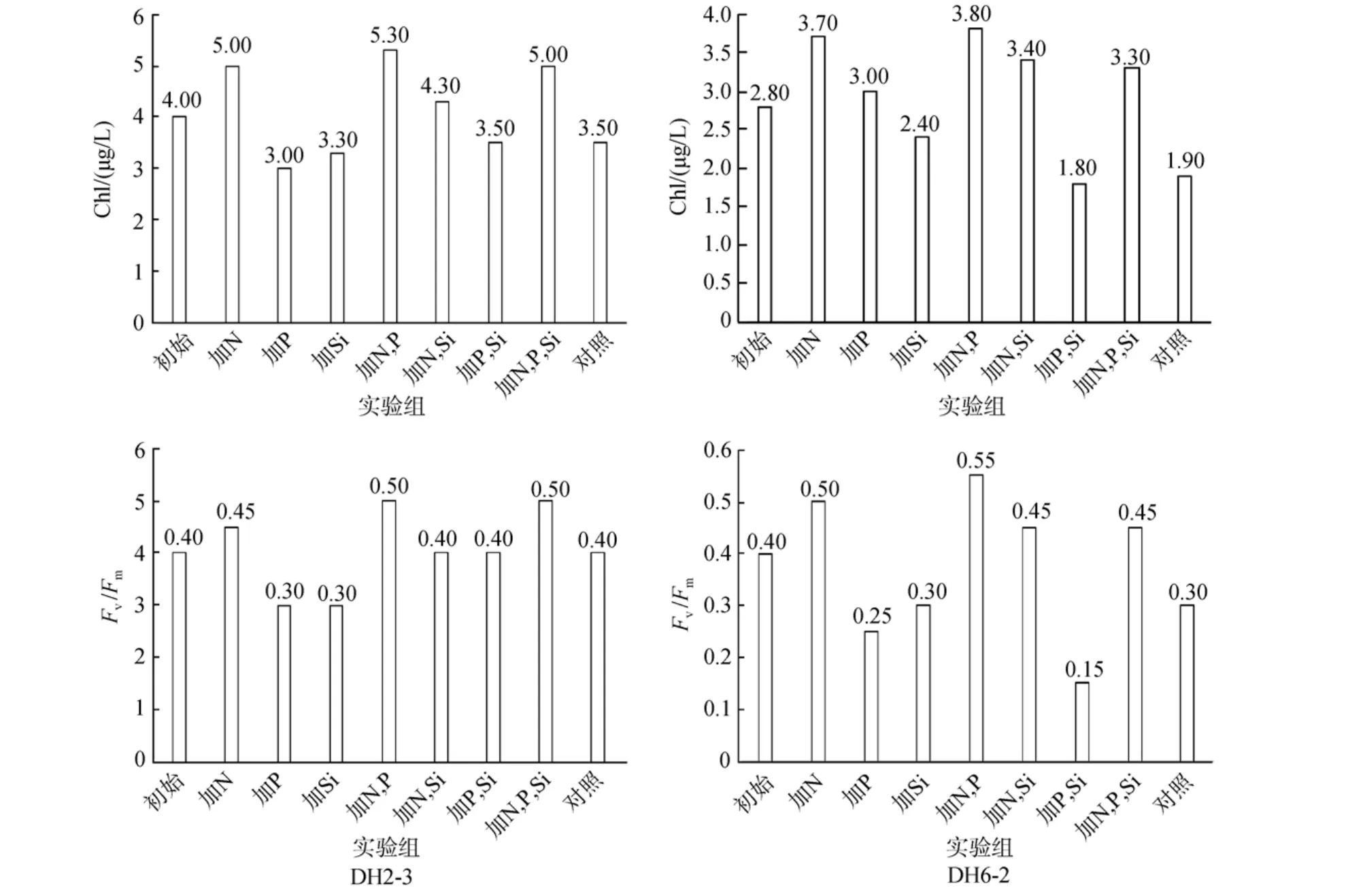
图4 DH2-3和DH6-2站营养盐加富培养24 h后Chl和Fv/Fm的变化Fig.4 Changes in Chl and Fv/Fm after 24hs culture with enriched nutrients at DH2-3 and DH6-2 station
4 讨论
4.1 调查海域叶绿素、Fv/Fm
调查海域叶绿素的平面分布总体呈现近岸高,外海低的趋势。叶绿素高值分布区主要有两块, 分别是长江口海域和浙江、福建沿岸海域。总体浓度0 m层>10 m层>20 m层。Fv/Fm的平面分布与叶绿素的平面分布较为一致。长江口及闽、浙近岸海域Fv/Fm数值在 0.5以上, 表明近岸海域浮游植物的生理活性较高, 光合作用较强。随着离岸距离的增加,Fv/Fm数值明显降低, 大小在 0.4以下, 代表此海域浮游植物生长受到了限制, 光合作用效率下降。营养盐是微藻生长的物质基础, 外海海域浮游植物Fv/Fm数值较低可能是由于较低的营养盐浓度造成的, 而近岸海区微藻生长旺盛、Fv/Fm数值较高也是因为较高的营养盐含量。与叶绿素所不同的是, Fv/Fm在0 m、10 m和20 m水层之间差别不明显, 0~20 m内Fv/Fm在垂直分布上没有明显变化, 浮游植物光和效率在垂直方向上较为相似。
4.2 营养盐加富现场培养实验
目前关于我国东海海域的营养盐限制情况有以下观点: 胡明辉、沈志良等通过生物培养实验和现场加富试验指出长江口海区春夏季的浮游植物生长受P限制[7-8]; 赵卫红等在长江口及邻近海域的现场培养实验表明, 离岸较远的海域, N是潜在的限制因子,而在长江冲淡水影响海域, P为浮游植物生长的潜在限制因子, 两者之间的海域是N、P的潜在限制过渡区[9-10]。DH2-3站位于赵卫红等研究中的N、P潜在限制过渡区。2001年7月赵卫红[11]在该海域进行了盐度、透明度和营养盐的调查, 并进行了浮游植物的营养盐培养实验, 根据实验结果, 将该海域划分为了近河口光限制海区、P潜在限制区、P潜在限制向N潜在限制过渡的海区、N潜在限制区, 并指出盐度31分界线的两侧是浮游植物 N、P限制交替变化较活跃的海区。本次实验的两个站位都位于这一区域,其中DH2-3在P潜在限制向N潜在限制过渡的海区,DH6-2在 N潜在限制区, 因此可以推断, 研究海域10年来营养盐对浮游植物生长的限制情况没有发生变化。营养盐测定结果表明, DH2-3站表层海水的DIN 浓度为 5.60 μmol/L, DIP 浓度为 0.15 μmol/L, Si浓度为4.25 μmol/L。DIN/DIP为37。DH6-2站表层海水的DIN浓度为2.83 μmol/L, DIP浓度为0.13 μmol/L,Si浓度为5.32 μmol/L。DIN/DIP为22, 在Redfield 比附近。
浮游植物营养盐限制的标准主要有以下几种:Fisher等[12]认为 DIN=1 μmol/L、PO4-P=0.5 μmol/L、SiO3-Si=5 μmol/L为浮游植物生长的最低阈值。Justic等[13]根据以下的营养盐浓度和比例来判断限制因子:当 PO4-P<0.1 μmol/L、SiO3-Si/PO4-P>22 且 DIN/PO4-P>22, 则为 P 限制; 当 DIN<1 μmol/L、SiO3-Si/DIN>1且DIN/ PO4-P<10, 则为N限制; 当SiO3-Si<2 μmol/L、SiO3-Si/ PO4-P<10且 SiO3-Si/DIN<1, 则为 Si限制。另外, 如果用 AGP(藻类生长潜力)表示某一水体中浮游植物所能达到的最高生物量。如果缺少某一元素, AGP表示其限制作用的营养元素所能支持的生物量, 缺少某种营养元素的 AGP与全营养的AGP的比值小于50%的则认为该元素为限制元素,因此得到的是各种营养盐对浮游植物生长的潜在限制强度, 潜在营养限制指数定义为: L(X)=0.5×AGP(All)/AGP(All-X), 如果 L(X)大于 1, 则元素 X 为限制因子,数值越大, 限制作用越强[14-17]。不同标准评价考察两个站位所得的结果如表2。

表2 不同标准评价下DH2-3和DH6-2所受限制情况Tab.2 The restricted condition of DH2-3 and DH6-2 with different evaluation standards
由于浮游植物间吸收 DIN/DIP的差异性, 无法仅仅根据 DIN/DIP来断定两个站位的营养盐限制情况。运用不同营养盐限制评价标准得到的结果也不一样。然而, 添加N后Chl浓度和Fv/Fm数值增大的实验结果表明, N的加富会导致该海域浮游植物生物量的增大和细胞活性的上升, 因此, DH2-3站和DH6-2站浮游植物总体生长是受到潜在的N限制。可能是因为站位远离长江口, 基本上不受长江的影响, 导致营养盐浓度相对较低。同时由于台湾暖流和黑潮北上, 携带了较丰富的P, 从而导致P的持续输入, 最终导致该海区微藻受到潜在的N限制。
Moore 和 Almazán-Becerril等[18-19]发现, 在营养盐较低的大洋海域, 加入营养盐后Chl浓度升高, 而Fv/Fm却没有任何响应, 说明研究海域浮游植物的光合活性好、藻细胞的生理状态良好, 因此Fv/Fm判断的是藻类的生理是否受到限制、光合速率是否处于最大水平, 与生物量无关。将7种我国近海常见微藻在缺 N或 P的条件下培养数天, Fv/Fm均显著下降;随着限制性营养盐的重新添加, 恢复过程中Fv/Fm在5~24 h显著升高, 如果在5~24 h内藻类群落结构不发生显著变化, 可运用该方法检测营养盐限制情况[6]。Sylvan等(2007)和 Hassler等(2011)在不同海域进行了营养盐加富实验, 24 h后测定Fv/Fm都得到了浮游植物对营养盐的添加有响应的结果, 因此, Fv/Fm这一参数可以在24 h之内得到准确的实验结果, 简便、高效[20-21]。
5 结论
1) 调查海域叶绿素的平面分布总体呈现近岸高,外海低的趋势。总体浓度0m层>10m层>20m层。Fv/Fm的平面分布与叶绿素的平面分布较为一致, 平面分布呈现出明显的近岸高, 外海低的趋势。
2) DH6-2站和DH2-3站营养盐加富实验结果表明, 培养基中N的添加使得Chl浓度和Fv/Fm数值增大, N的加富使得藻细胞的生长速度和细胞活性增强,而无N添加的实验组Chl浓度和Fv/Fm未见增大。由此可以看出, 在调查时间, 原始水样中 N的缺乏限制了藻细胞的生长和生理活性。实验证明, 通过检测不同的营养盐添加前后 Fv/Fm的变化也可以说明该海域微藻生长受到了N限制, 方法快速(24 h)、简便、快捷。
[1] 周名江, 朱明远, 张经. 中国赤潮的发生趋势和研究进展[J]. 生命科学, 2001, 13(2): 53-59.
[2] 周明江, 颜天, 邹景忠. 长江口邻近海域赤潮发生区基本特征初探[J]. 应用生态学报, 2003, 14(7):1031-1038.
[3] Anderson D M, Garrison D J. Ecology and oceanography of harmful algal Blooms [J]. Limnology and Oceanography, 1997, 42(5): 1009-1035.
[4] Hallegraeff G M. A review of harmful algal blooms and their apparent global increase [J]. Phycologia, 1993, 32:79-99.
[5] 徐宁, 陈菊芳, 王朝晖, 等. 广东大亚湾藻类水华的动力学分析 Ⅱ.藻类水华与营养元素的关系研究[J].环境科学学报, 2001, 4: 400-404.
[6] 王昭玉, 王江涛. 7种海洋微藻叶绿素荧光对N、P限制的响应[J]. 海洋环境科学, 2013, 2: 165-170.
[7] 胡明辉, 杨逸萍, 徐春林, 等. 长江口浮游植物生长的磷酸盐限制[J]. 海洋学报, 1989, 11(4): 339-443.
[8] 沈志良. 长江口海区理化环境对初级生产力的影响[J].海洋通报, 1993, 1: 47-51.
[9] 赵卫红, 李金涛, 王江涛. 夏季长江口海域浮游植物营养限制的现场研究[J].海洋环境科学, 2001, 23(4): 1-5.[10] 周俊丽, 刘征涛, 孟伟, 等. 长江口营养盐浓度变化及分布特征[J].环境科学研究, 2006, 19(6): 139-144.
[11] 赵卫红, 王江涛, 李金涛, 等. 长江口及邻近海域冬夏季浮游植物营养限制及其比较[J]. 海洋学报(中文版), 2006, 3: 119-126.
[12] Fisher E R, Peele J W, Ammerman L B, et al. Nutrient limitation of phytoplankton in Cheaspeake Delaware and Hudson estuaries[J]. Estuatine and coastal shelf science, 1988, 27: 61-93.
[13] Justic D, Rabalais N N, Turner R E, et al. Changes in nutrient structure of river-do minated coastal waters:stoichiometric nutrient balance and its consequences[J].Estuarine, Coastal and shelf Science, 1995, 40:339-356.
[14] Maestrini S Y, Breret M, Berland B R, et al, Nutrients limiting the algal growth potential(AGP) in the Po Riber Plume and an adjacent area, Northweat Adriatic Sea: Enrichment bioassays with the test algae Nitzschia closterium and Thalassiosira pseudonana[J]. Estuaries,1997, 20(2): 416-429.
[15] Louise Schlüter, The influence of nutrient addition on growth rates of phytoplankton groups, and microzooplankton grazing rates in a mesocosm experiment[J].Exp Mar Biol Ecol, 1998, 228: 53-71.
[16] 蒲新明, 吴玉霖, 张永山.长江口区浮游植物营养限制因子的研究(I.秋季的营养限制情况)[J].海洋学报,2000, 22(4): 60-66.
[17] 蒲新明, 吴玉霖, 张永山.长江口区浮游植物营养限制因子的研究(I.春季的营养限制情况)[J]. 海洋学报,2001, 23(3): 57-65.
[18] Almazán-Becerril A, García-Mendoza E. Maximum efficiency of charge separation of photosystem II of the phytoplankton community in the Eastern Tropical North Pacific off Mexico: A nutrient stress diagnostic tool? [J]. Ciencias Marinas, 2008, 34: 29-43.
[19] Moore C M, Mills M M, Langlois R, et al. Relative influence of nitrogen and phosphorus availability on phytoplankton physiology and productivity in the oligotrophic sub-tropical North Atlantic Ocean[J].Limnology and Oceanography, 2008, 53: 291-305.
[20] Hassler C S, Djajadikarta J R, Doblin M A, et al.Characterisation of water masses and phytoplankton nutrient limitation in the East Australian Current separation zone during spring 2008[J]. Deep-Sea Research Ⅱ, 2011, 58: 664-677.
[21] Sylvan J B, Quigg A, Tozzi S, et al. Eutrophicationinduced phosphorus limitation in the Mississippi River plume: Evidence from fast repetition rate fluorometry[J]. Limnology and Oceanography, 2007, 52: 2679-2685.
