点带石斑鱼精子超低温冷冻保存研究
2014-12-02王小刚尹绍武陈国华
王小刚 , 骆 剑 尹绍武, 陈国华
(1. 海南大学 海洋学院 热带生物资源教育部重点实验室, 海南 海口 570228; 2. 海南省农业干部学校, 海南 海口 571100; 3. 南京师范大学 生命科学学院, 江苏 南京 210023)
点带石斑鱼(Epinephelus malabaricus)属鲈形目(Perciformes)、 科(Serranidae)、石斑鱼亚科(Epinephelinae)、石斑鱼属(Epinephelus)。该鱼具有分布广、 生长快 、肉质鲜美等特点, 是中国东南沿海重要的名贵海水养殖经济鱼种, 是海南省海水养殖中数量较大、较普遍的鱼种[1-2]。
鱼类精液超低温保存在水产养殖、遗传育种及种质资源保存中具有很重要意义: 鱼类精液的超低温冷冻保存, 不仅可以实现种质材料的长距离运输,有利于不同区域鱼类的杂交、选育、获得优良性状及基因多样性保护[3]; 还可以为水产养殖业和实验生物学研究长期稳定地提供材料。自1953年Blaxter[4]成功冷冻保存太平洋鲱鱼(Clupea pallasi)精巢以来,鱼类精液的超低温冷冻保存研究已取得了巨大成就。目前, 已有200多种淡水鱼类和40多种海水鱼类的精液成功获得了冷冻保存[5-6]。因海水养殖业的发展迫切需要及对海洋种质资源保护的认识, 中国对于一些具有较高经济价值的鱼类精液进行超低温冷冻保存, 并取得了巨大的研究进展, 如鲷科(Sparidae)[7-8]、大黄鱼(Pseudosciaena crocea)[9]、鲈鱼(Lateolabrax japonicus )[10]、鲆科(Bothidae)[11-12]等。而关于点带石斑鱼的精液冷冻保存的研究报道较少,鉴于点带石斑鱼在中国海水增养殖业中的重要经济地位, 因此有必要建立精子冷冻保存库, 保存优良的种质资源, 这对点带石斑鱼的遗传改良及石斑鱼增养殖业的可持续发展都具有重要的理论和现实意义。因此作者对繁殖季节中3个不同时期的点带石斑鱼精液进行超低温冷冻保存研究, 为建立点带石斑鱼精子冷冻保存库提供基础数据和参考资料。
1 材料与方法
1.1 精子的采集
雄性点带石斑鱼由海南省陵水县新村港养殖基地提供。点带石斑鱼繁殖季节是每年的 3月~9月, 由于点带石斑鱼产卵比较规律, 每月几乎固定在相同的日期开始产卵。采精在亲鱼的产卵前1 d、产卵后1周及繁殖季节末期 9月份等 3个时期中分别取材。3~4月份采集精子的活力较好, 运动时间最长; 5~8月份采集的精子质量下降; 9、10月份只能取到少量稀薄的点带石斑鱼精子, 且质量很差。
从点带石斑鱼雌雄亲本的混养网箱中, 选取健康、无外伤的雄性亲鱼30尾(体质量5~7 kg/尾, 体长0.4~0.5 m/尾)进行实验。亲鱼经麻醉后采用挤压法采集精液, 用干毛巾擦干鱼体生殖孔周围的水分与黏液, 然后轻压腹部, 挤出精液, 用准备好的干净注射器吸取精液置于冰上的1.5 mL离心管中。采精过程中要防止海水溅入和避免粪便、尿液等污染精液。
1.2 冷冻保护液配方筛选
1.2.1 稀释液选择
本实验采用TS-19、TS-2、Hank’s、MPRS (Modified plaice ringer solution)、Cortland和0.75% NaCl 等6种溶液作为冷冻稀释液(稀释 10倍后用于实验), 其组成成分见表1, 以浓度为15% 的DMSO (二甲亚砜)作为抗冻剂, 配置成不同稀释液的冷冻保护液进行最适稀释筛选。比较6种稀释液对精子的保护效果, 筛选出比较适宜的稀释液。精液与冷冻保护液以 1∶30的比例混合, 样品冷冻保存体积为 0.6 mL, 三步法降温冷冻保存, 复温时在液氮蒸汽中平衡10 min后, 直接40℃水浴至完全融化, 显微镜观察和记录冻精复活比例。
冷冻降温-复温过程:
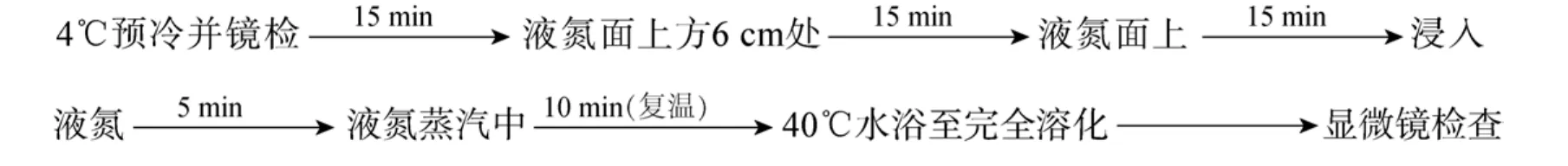
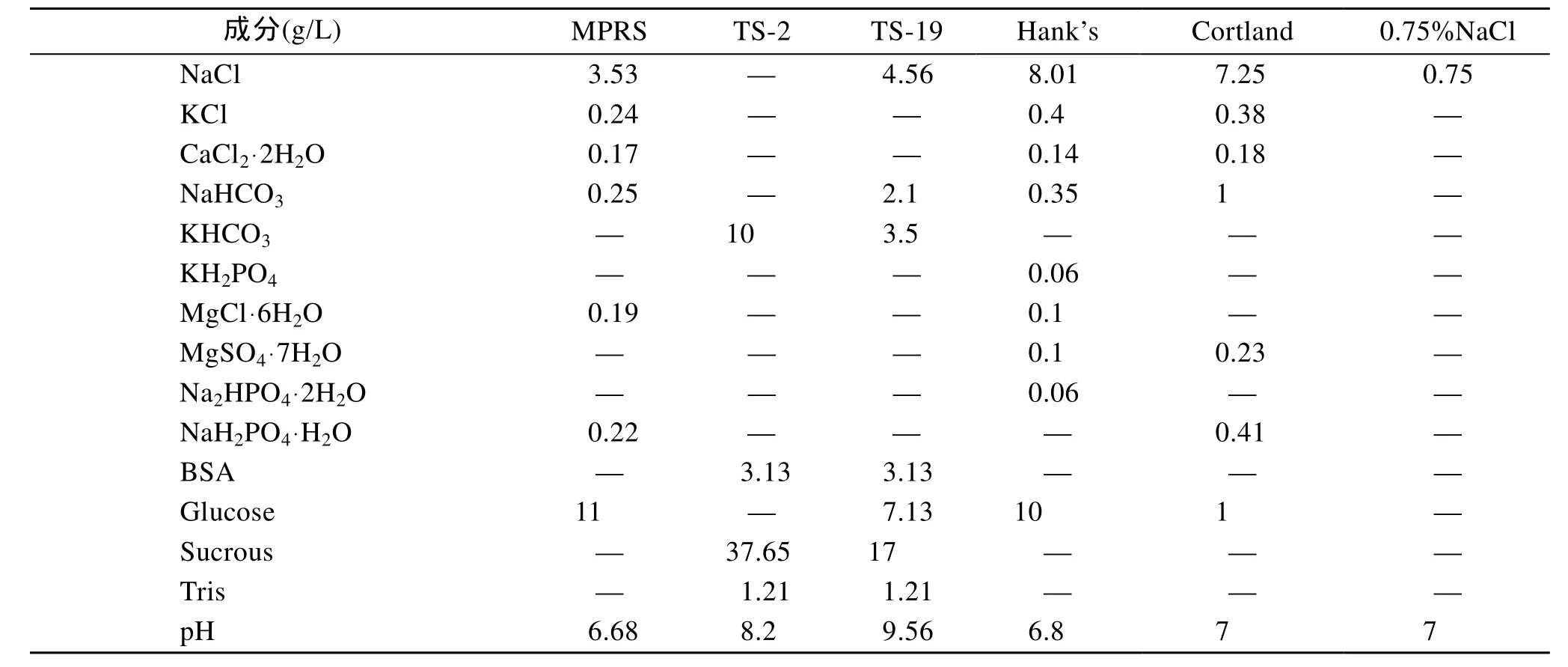
表1 6种不同稀释液的组成成分Tab.1 Constituent of six different extender solutions
1.2.2 抗冻液选择
二甲亚砜(DMSO)、甘油(Gly)和甲醇(MeOH)作为抗冻液, 设置10%, 15%, 20%和25%等4个浓度梯度, 与筛选出的最佳冷冻稀释液组合, 配置成不同浓度的冷冻保护液。比较 3种抗冻液及浓度对点带石斑鱼精子的保护效果, 筛选出最适宜的抗冻液及浓度, 得出最适宜的冷冻保护液组合配方。精液与冷冻保护液以 1∶30的比例混合, 样品冷冻保存体积为 0.6 mL, 三步法降温冷冻保存, 复温时在液氮蒸汽中平衡10 min后, 直接放入40℃水浴至完全融化,显微镜观察和记录冻精复活比例。
全部实验均重复 3次, 结果取平均值, 采用Excel和spss11.0 软件对数据进行作图分析。
2 结果
2.1 点带石斑鱼精子冷冻保护液筛选
2.1.1 稀释液选择
根据图1所示, 点带石斑鱼精液和6种不同稀释液与15% DMSO配置的冷冻保护液以1∶30的比例混合, 经三步法超低温冷冻-复温后, 显微镜观察统计, 其精子复活成活率最高达到 50%以上, 明显差于正常精子激活成活率。其中Hank’s与15% DMSO配置成的冷冻保护液, 对精子的保护效果明显高与其他5种稀释, 而TS-2, TS-19冷冻保护效果依次下降, 但也明显高于MPRS, Cortland和0.75% NaCL的保护效果。可见, Hank’s溶液可以做为点带石斑鱼精液冷冻保存最适的稀释液。
2.1.2 抗冻液选择
用筛选出最适宜的Hank’s溶液作为冷冻稀释液,与 3种不同浓度的抗冻液配置冷冻保护液, 点带石斑鱼精液与冷冻保护液以1: 30的比例混合, 经三步法冷冻-复温后, 其精子复活成活率如表 2所示。其中 MeOH对精子的抗冻保护效果最差, 浓度 10%~25%内变化, 精子成活率均为0%。DMSO和Gly对精子的抗冻保护效果都很好, 其冷冻-复温后的精子成活率可达 50%以上, 精子激活效果均差于正常情况。其中10%、15% DMSO和15%~25% Gly的抗冻保护效果都非常好, 其冷冻-复温的精子成活率高于60%以上。

图1 稀释液对点带石斑鱼精子冻后成活率的影响Fig.1 The effects of extender solutions on spermatozoa survival rate of E.malabaricus
2.2 抗冻液对点带石斑鱼精子的激活作用
3种不同浓度的抗冻液在冷冻前后对点带石斑鱼精子的激活效果影响, 如表3所示。点带石斑鱼精液在超低温冷冻之前, 显微镜下观察, 未加天然海水激活的情况下, 不同浓度的DMSO和MeOH均未能激活精子运动; 而不同浓度的 Gly则都可以激活精子运动, 10%~20% Gly对精子的激活效果接近与正常天然海水的效果, 激活比例达80%以上。但是加入天然海水后, 不同浓度的DMSO和MeOH均被激活精子运动, 激活效果接近与正常天然海水的效果,激活比例达80%以上; 而Gly的激活效果急剧下降至5%以内。精液经超低温保存后, 未加海水情况下, 不同浓度的DMSO和MeOH均未能激活精子运动; 不同浓度的Gly相比冷冻前, 精子激活比例有下降, 15%Gly的激活比例能达60%以上。加海水后, 不同浓度的DMSO对精子激活比例均高于Gly和MeOH, 10%和15% DMSO的激活比例达60%以上; 而Gly和MeOH的效果很差, Gly偶能见到运动的精子, 但不同浓度的MeOH均未看到激活运动的精子, 且冻存管明显出现乳白色的黏稠的絮状物质。同时实验中观察到, 不同浓度的 Gly在未加海水激活的情形下, 精子均能被 Gly激活运动, 加海水激活后, 精子运动激活比例急剧下降。因此, 10%~15%DMSO为最适抗冻液浓度范围。
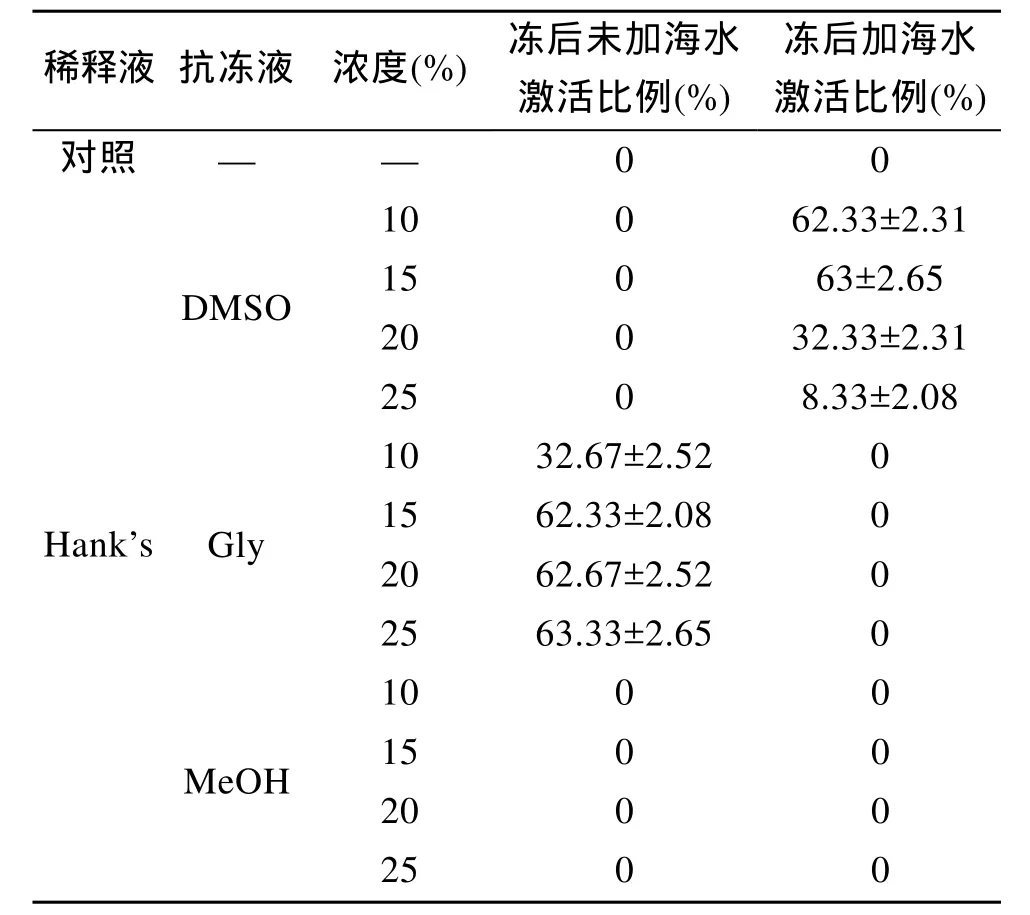
表2 抗冻液对点带石斑鱼冻后精子成活率的影响Tab.2 The effects of cryopreservation on spermatozoa survival rate of E.malabaricus
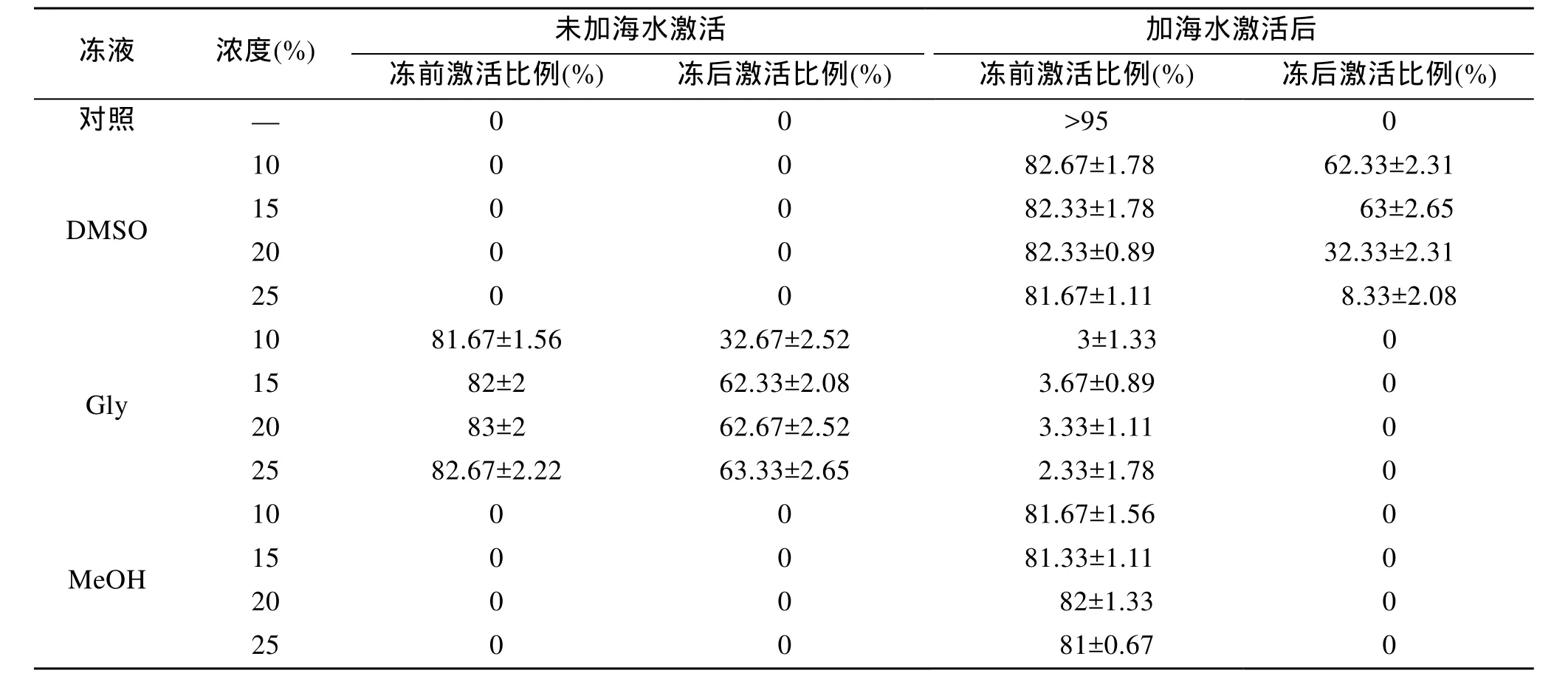
表3 抗冻液对点带石斑鱼精子的激活影响Tab.3 The effects of cryopreservation on spermatozoa activation rate of E.malabaricus
2.3 不同取材时期点带石斑精子冷冻效果比较
在海南地区, 点带石斑鱼的繁殖周期是从每年的 3月份开始, 到10月结束, 通常在每月的特定日期前后亲鱼在培育网箱内发情自发交配。一个繁殖季节不同日期采集的精子样品, 其精子冷冻-复温后的成活率有显著差别。如图2所示, 亲鱼排精前1 d采集的样品, 冻后精子的成活率高达 60%以上; 亲鱼排精后 1周取到的精液样品, 冻后精子的成活率为50%左右; 而每年繁殖季节末期(10月)采集的精液样品, 冻后精子的成活率非常低, 成活率不到 10%。点带石斑鱼每月排精日前后采集到的精液样品的质量明显高于其他日期采集的样品, 而每年繁殖盛期采集的精液样品质量也明显高于繁殖季节末期所采集的精液样品。因此, 为了获得更好冻后精子的成活率,冷冻保存的精液样品采集应在每年繁殖盛期进行, 在亲鱼排精前后采集精子样品可获得质量最好的精子。
3 讨论与结论
3.1 冷冻保护液对点带石斑鱼精子冷冻保存的影响
3.1.1 不同稀释液对点带石斑鱼精子冷冻保存的影响
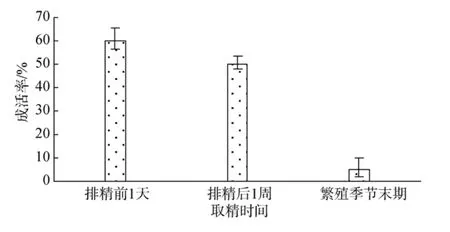
图2 取材时期对点带石斑鱼冻后精子成活率的影响Fig.2 The effects of semen collection period on spermatozoa survival rate of E.malabaricus
鱼类精液等排出鱼体外之后, 由于环境变化不适、营养物质消耗、能量代谢产物积累等, 精子的存活时间大大降低而导致快速死亡。因此需通过配置一种适宜稀释液来延长精子的体外存活时间及活力,使精子在体外也能维持较良好的生理状态, 可以更好地抵抗冷冻降温过程中的各种损伤[6]; 在冷冻过程中, 稀释液不仅在维持精子的正常生理状态方面有重要作用, 还能稀释冷冻抗冻液的浓度, 降低抗冻液对精子毒害强度。适宜的稀释液对精子没有任何毒害作用, 因此, 配置任何稀释液都须具备以下条件: 溶液的等渗性、各成分互不发生化学反应、能为待冻材料提供适应的环境、适宜的pH、不能含有对待冻材料有害的物质及含有抗菌物质[6]。
本实验选用了 6种不同的生理盐溶液作为冷冻稀释液, 均符合稀释液的配置条件。其中TS-2在大菱鲆(Scophthalmus maximus)精子冷冻保存研究中,获得了76.7%的冻精成活率[6]。TS-19在大菱鲆精子短期冷冻保存研究中, 获得 80%以上的冻精成活率[12],MPRS在花鲈精子冷冻保存研究中, 获得了最佳保存效果, 其冻精成活率达 60%±13.22%[6]。Hank’s在大黄鱼精液冷冻保存研究中, 获得了 89.7%±7.5%的冻精成活率[9]。Cortland在真鲷(Pagrosomus major)精子冷冻保存研究中, 与15% DMSO配置成冷冻保护液, 获得81.9%±6.6%的冻精成活率[13]。0.75% NaCl溶液在黑鲷(Sparus macrocephalus )精子冷冻保存研究中, 获得了50%以上的冻精成活率[8]。通过本实验数据分析, 6种稀释液中, Hank’s的保护效果最佳, 与10%~15% DMSO、15%~25%的Gly配置成的冷冻保护液, 并获得了 60%以上的冻精成活率; 其次是TS-2和 TS-19。Hank’s应是点带石斑鱼精子冷冻保存的最适冷冻稀释液。
3.1.2 不同抗冻液及浓度对点带石斑鱼精子冷冻保存的影响
低温冷冻既可以长期保存生物细胞, 也可以产生严重损伤并杀死生物细胞。低温冷冻过程中, 环境的剧烈变化对生物产生过冷休克、冰晶损伤[14-15]、高渗休克[14,16~18]和抗冻液毒性等方面的损伤; 一般来说, 多数冷冻损伤主要发生在0~–60℃[6]。因此利用低温冷冻保存技术进行有效地保存生物细胞, 就必须根据生物材料的性质, 选择相应的冷冻保存方法来降低冷冻对生物材料的损伤程度。
本实验中所选用DMSO、Gly和MeOH作为冷冻抗冻液, 10%~15%的DMSO及15%~25%的Gly都获得了很好的抗冻保护效果, 其冻精成活率达到60%以上, 而10%~25% MeOH的保护效果很差, 冻精的成活率为0%。任何一种抗冻液, 对不同种鱼的精液保护作用差异很大。DMSO、Gly和MeOH都是鱼类精液超低温冷冻保存常用的抗冻液; 5%~20%DMSO在多种海水鱼类精液超低温冷冻保存中都获得了很好的效果, 如细须石首鱼(Micropogon undulatus )[19]、黄鳍鲷(Sparus latus)[20]、大菱鲆[11]等。本文所得到的结果与上述5%~20% DMSO研究的结果相似。Gly 在暗纹东方 鲀(Fugu obscurus)[6]、牙鲆(Paralichthys olivaceus)[21]和大黄鱼[9]的精液冷冻保存研究中, 都获得了很好的冷冻保护效果, 冻精成活率与正常精子活力相近, 但是在圆斑星鲽(Verasper variegatus)的精液冷冻保存研究中, 却未能起到较好的冷冻保护作用[6]。本实验也使用10%~25%Gly做为抗冻液, 也都获得了很好的冷冻保护效果。MeOH在淡水鱼类精子冷冻保存研究中, 获得了比较理想的保护效果, 如黄颡鱼(Pelteobaggrus fulvidraco)[6], 西伯利亚鲟鱼(Acipenser baeri)[22]等, 未见MeOH在海水鱼类精液冷冻保存研究中, 获得很好的抗冻保护效果文献报道。而在大黄鱼精液冷冻保存研究结果表明, 10%~30% MeOH保存的冻精的运动率较差。本实验选用10%~25% MeOH做为抗冻液,均未获得冻精的复活率; 在实验中观察到, 精液经超低温冷冻-复温、40℃水浴中融化后, 冻存管内明显出现乳白色的黏稠絮状物, 与未加任何冷冻保护液的冻精效果相似[15]。关于乳白色的絮状物, 作者未见到有关文献报道, 有可能该絮状物质出现是由于MeOH对精子未起到抗冻保护的作用, 导致精子细胞中的蛋白质因高渗作用产生变性凝固。
3.1.3 抗冻液对点带石斑鱼精子的激活影响
抗冻液对生物材料不但有抗冻保护作用, 而且也会产生一定的毒性作用。因冷冻保护液在溶液中易结合水分子, 发生水合作用, 使溶液的黏性增加,从而弱化水的结晶作用, 减少冰晶的形成, 降低冷冻对生物材料的损伤程度[23]。因此对于低温和超低温冷冻保存不同鱼类精子时所选用的抗冻液的种类组成和浓度是不同的。然而有文献报道表明, 抗冻液对鱼类精子有激活作用: 如黄晓荣等[24]对日本鳗鲡(Anguilla japonica)精子活力研究表明, 4%~24%DMSO、Gly、PG(1, 2-丙二醇)和 EG(乙二醇)都能激活日本鳗鲡的精子, 其中 8%的甘油不仅能激活精子,而且能延长日本鳗鲡精子在体外的存活时间, 存活时间长达154.6 s。
在本实验中也同样观察到抗冻液可激活点带石斑鱼精子, 实验选用10%~25% DMSO、Gly和MeOH作为抗冻液, 其中 Gly明显可以激活点带石斑鱼精子快速运动, 10%~20% Gly的激活效果相似于天然海水激活后的效果; 但加入天然海水后, 其激活效果就急剧下降。一般来说, 各种鱼类精子运动的诱导机制不同, 淡水鱼类精子是由淡水环境的低渗诱发的, 海水鱼类精子则是由海水高渗透所诱发的[23]。与本实验观察结果来看, 不同浓度的 Gly对精子的激活效果, 在加海水前后的变化差异明显, 这种现象也许是甘油在加入海水后导致混合溶液的渗透性大大降低, 导致精子无法获取能运动停止而产生的。
3.2 取材时期对点带石斑鱼精子冷冻保存的影响
在鱼类人工繁育中, 卵子质量一直以来都是研究者最关注的核心问题。然而鱼类受精卵的质量好坏, 不单是与卵子质量的好坏有直接联系, 精子的质量同样也直接影响受精卵的质量[25]。在鱼类精液低温冷冻保存研究中, 精液的质量尤其重要, 一旦获得的精液质量不理想, 就意味着后期冷冻保存也不理想。繁殖季节内, 亲鱼个体大小、养殖温度和模式、季节、营养状况、采精频率及催产素使用情况都会影响鱼类精子的质量[25]。本实验在点带石斑鱼繁殖季节的3个不同时期采取精液, 即排精前1 d、排精后 1周和繁殖季节末期; 通过冷冻保存实验的结果得知, 排精前1 d的精液质量最佳, 排精前1 d和排精后 1周取得精液质量明显优于繁殖季节末期的。这种现象与亲鱼的营养状况、排精次数、催产素使用情况及外界环境因素有关。因此, 为了能获取到更好的冷冻保存点带石斑鱼的精液材料, 最佳精液采集时期应在点带石斑鱼的亲鱼产卵前 1 d进行采集。
[1] 尹绍武, 廖经球, 黄海, 等. 海南近海点带石斑鱼野生和养殖群体微卫星多态分析[J]. 应用与环境生物学报, 2008, 14(2): 215-219.
[2] 陈国华, 张本. 点带石斑鱼人工育苗技术[J]. 海洋科学, 2001, 25(1): 1-4.
[3] Ohta H, Kawamura K, Unuma T, et al. Cry preservation of sperm of the Japanese bitterling [J]. Journal of Fish Biology, 2001, 58: 679-681.
[4] Blaxter T H S. Sperm storage and cross-fertilization of spring and autumn spawning herring [J]. Nature, 1953,172: 1189-1190.
[5] Suquet M, Dreanno C, Fauvel C, et al. Cry preservation of sperm of marine fishes [J]. Aquaculture Research,2000, 31(3): 231-243.
[6] 陈松林. 鱼类精子和胚胎冷冻保存理论与技术[M].北京: 中国农业出版社, 2007.
[7] 李纯, 李军, 薛钦昭. 真鲷精液超低温冷冻保存[J].海洋科学, 2001, 25(12): 6-8.
[8] 李纯, 李军, 薛钦昭. 黑鲷精液超低温冷冻保存[J].海洋科学, 2001 , 25(11): 1-4.
[9] 陈雄芳. 大黄鱼精子和胚胎的超低温冷冻保存研究[D]. 青岛: 中国海洋大学, 2004.
[10] Ji X S, Chen S L, Tian Y S, et al. Cryopreservation of sea perch spermatozoa and feasibility for productionscale fertilization [J]. Aquaculture, 2004, 241: 517-528.
[11] Chen S L, Liu X T, Fu C J, et al. Cryopreservation of sperm from turbot and application to large-scale fertilization[J]. Aquaculture, 2004, 236: 547-556.
[12] 赵燕, 季相山, 陈松林. 大菱鲆精子低温短期保存[J].海洋水产研究, 2006, 27: 48-52.
[13] 刘清华. 真鲷精液超低温保存及其低温损伤研究[D] .青岛: 中国海洋大学, 2005.
[14] 章龙珍, 刘鹏, 庄平, 等. 超低温冷冻对西伯利亚鲟精子形态结构损伤的观察[J]. 水产学报, 2008, 32(4):558-565.
[15] 王小刚, 骆剑, 朱晓平, 等. 点带石斑鱼的精子活力及超低温冷冻前后精子超微结构的比较[J]. 海洋科学, 2013, 37(2): 70-75.
[16] 林丹军, 尤永隆, 陈炳英. 大黄鱼精子冷冻复苏后活力和超微结构的变化[J]. 福建师范大学学报, 2006,22(3): 71-76.
[17] Taddei A R, Barbato F, Abelli L, et al. Is cryopreservation a homogeneous process-Ultra-structure and motility of untreated, prefreezing, and post thawed spermatozoa of Diplodus puntazzo [J].Cryobiology,2001, 42(4): 244-255.
[18] He S, Woods L C. Effects of plasma membranes and mitochondria to striped bass (Morone saxatilis) sperm[J]. Cryobiology, 2004, 48(3): 254-262.
[19] Gwo J C, Strawn K, Longnecker M T, et al. Cryopreservation of Atlantic croaker spermatozoa[J]. Aquaculture, 1991, 94: 355-453.
[20] Gwo J C. Cryopreservation of yellowfin seabream spermatozoa [J]. Theriogenology, 1994, 41: 989-1004.
[21] Zhang Y Z, Zhang S C, Liu X Z, et al. Cryopreservation of flounder sperm with a practical methodology [J].Theriogenology, 2003, 60: 989-996.
[22] 刘鹏, 庄平, 章龙珍, 等. 人工养殖西伯利亚鲟精子超低温冷冻保存研究[J].海洋渔业, 2007, 29(2):120-127.
[23] 汪小锋, 攀延俊. 鱼类精子冷冻保存的研究进展[J].海洋科学, 2003, 27(7): 28-31.
[24] 黄晓荣, 章龙珍, 乔振国, 等. 抗冻剂对日本鳗鲡精子活力及运动时间的影响[J].海洋渔业, 2007, 29(3):193-199.
[25] 季相山, 陈松林, 赵燕, 等. 鱼类精子质量评价研究进展[J]. 中国水产科学, 2007, 6: 1048-1054.
