长牡蛎dpp同源基因的克隆及其在贝壳发生中的功能研究
2014-12-02刘保忠
刘 刚 , 郇 聘 刘保忠
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049)
软体动物是仅次于节肢动物的第二大多细胞动物门, 形态、颜色各异的贝壳是除头足类的大多数软体动物最显著的特征。鉴于贝壳在该类物种中的重要作用, 围绕贝壳发生、钙化机制等的研究一直是热点问题[1-5]。贝壳的发生起始于胚胎发育早期[6-7]。在原肠作用还未开始或刚开始时, 胚胎背部细胞开始变形、内陷, 其范围逐渐扩大。与此同时, 内陷的细胞开始分泌贝壳物质, 形成贝壳。早期贝壳继续扩大,逐渐包裹整个幼虫; 与此同时, 碳酸钙开始沉积, 双壳类中形成铰合部而将贝壳分为两片。至D形幼虫时期, 贝壳发育较完善, 已经完全钙化且可以包裹整个幼虫, 称作Ⅰ期胚壳。
目前的研究表明, 在贝壳发生的过程中 dpp基因发挥了重要的调控作用, 可能调控了新生贝壳的发生时间、形状等关键方面。dpp基因属于转化生长因子β超家族(TGF-β)骨形成蛋白(BMP)家族的分子,在序列上与哺乳动物BMP2/4同源[8]。在模式生物中的研究还表明, dpp基因在体轴决定(背腹轴)和附肢发育中发挥重要作用[9-12]。
作为世界范围内的重要经济贝类, 长牡蛎(Crassostrea gigas)是贝类研究的模式种之一。作者鉴定了一种长牡蛎 dpp基因, 研究了该基因在胚胎发育早期的时空表达情况, 证实了其参与贝壳的发生过程; 同时作者的结果与前人报道亦有差别, dpp在贝壳铰合部发生中的功能可能有待进一步确认。
1 材料与方法
1.1 实验动物与幼虫培养
性成熟的长牡蛎购自青岛市水产市场, 解剖后取精子和卵细胞, 使其在海水中受精。受精卵在25℃水温下发育, 持续充气。分别取卵细胞、胚胎及担轮幼虫等样品, 经 4%多聚甲醛固定后梯度甲醇脱水,保存于–20℃中备用。
1.2 长牡蛎dpp基因的克隆
首先从牡蛎EST数据库搜索得到一条dpp同源序列HS140609。HS140609来自于cDNA克隆的3′测序, 比对到dpp基因的3′端。分别以该cDNA克隆的 5′和 3′EST 序列(HS140608 和 HS140609)设计了引物cgdpp-F1(TACACACGGGATTATTTACT)和cgdpp-R1(CGCAAATAAATAATATCACA), 从长牡蛎幼虫cDNA中成功获得了长牡蛎的 dpp同源基因的全长cDNA序列, 命名为cgdpp。
1.3 序列特征和进化分析
通过生物信息学工具分析了 cgdpp编码的氨基酸序列的一些特征: 利用 Expasy 网站提供的工具(http: //web.expasy.org/compute_pi/)预测了分子量和等电点; 利用 SignalP网站工具预测了信号肽序列(www.cbs.dtu.dk/services/SignalP/); 利用 NCBI的CDD数据库检索了cgdpp中的保守结构域情况(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。通过比较cgdpp编码蛋白序列与其他种属动物dpp同源序列的比较, 以 Neighbor-Joining方法构建了进化树[13]。
1.4 整装原位杂交
整装原位杂交使用的探针选择了部分 ORF序列,利用引物 cgdpp-F2(TTCTCTGGGAGAGAGCGTCA)和 cgdpp-R2(CTACCGGCAACCACAGCCTTC)扩增得到 PCR产物后, 连接入 pGEM-T载体(Promega),克隆入大肠杆菌(DH5α)内增殖。质粒经酶切线性化后作为模板, 以T7或SP6 RNA聚合酶体外转录合成RNA; 使用DIG RNA Labeling Mixture试剂盒(Roche)以获得地高辛标记RNA探针。利用正义RNA探针作为阴性对照, 在卵细胞, 各时期胚胎及担轮幼虫、D形幼虫中进行整装原位杂交以研究 cgdpp的时空表达规律。整装原位杂交的流程按照Maures[14]报道的方法进行。
2 结果
2.1 cgdpp基因
扩增得到的cgdpp基因cDNA全长1448bp, 包括 131bp的 5’UTR, 1257bp的编码序列(ORF)以及60bp的 3’UTR, 编码一个含 418个氨基酸的前体蛋白, 其理论分子量为 48.09 kDa, 理论等电点 9.59。该序列已提交至 GenBank(Accession No. KC56-1778)。其中第 1~20个氨基酸被预测为信号肽序列(SP), 保证新生蛋白进入内质网-高尔基体以接受必要的翻译后修饰, 如糖基化等。在距离C端106~146个氨基酸处长达30个氨基酸的序列中有众多的位点符合 R(K)-X-X-R(K)的序列, 它们都是潜在的蛋白酶作用位点(图1)[15]。在距C端105个氨基酸之内的成熟肽部分有 7个半胱氨酸残基, 在人 BMP2和Cgdpp中保守存在, 参与形成必要的分子内二硫键。整个分子的结构见图1。
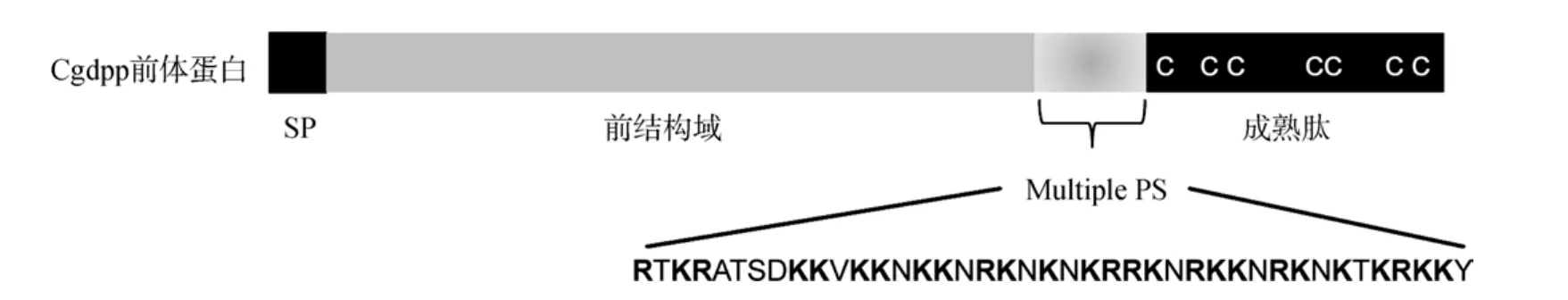
图1 Cgdpp前体蛋白的结构Fig.1 A scheme of Cgdpp
2.2 进化分析
基于 cgdpp所编码的氨基酸序列及其他物种的同源序列, 构建了系统进化树(图2)。cgdpp首先和其他两种双壳贝类的的 dpp基因聚为一支, 再与腹足类的dpp基因形成软体动物分支; 人(Homo sapiens)、鼠(Rattus norvegicus)、斑马鱼(Danio rerio)等的BMP2和 BMP4则形成脊椎动物分支; 果蝇(Drosophila melanogaster)等节肢动物形成节肢动物分支;线虫则单独占据一个分支。
2.3 cgdpp在长牡蛎早期发育中的时空表达分析

图2 cgdpp的进化分析, 节点处的数值表示1000次重复抽样所得的bootstrap值Fig.2 A phylogenetic tree of dpp-homologs constructed through the Neighbor-Joining method. The bootstrap values were calculated from 1000 replicates
利用整装原位杂交技术在长牡蛎卵细胞、受精卵至受精后14 h(14 hours post fertilization, 14 hpf)内的数个时间点研究了长牡蛎 cgdpp的表达情况(图3)。在卵细胞及4细胞时期(2 hpf)未能检测到cgdpp表达。自4 hpf起, cgdpp开始在胚胎背部的两个细胞中表达, 这种表达模式一直保持到原肠胚时期(8 hpf); 同时在这两个细胞周围逐渐出现一些较弱的表达。值得注意的是, 随着贝壳发生区自 6 hpf起变得明显,cgdpp的表达部位很清晰地被定位于正在发生中的贝壳的上下两端。在担轮幼虫中(11 hpf), cgdpp的表达区域发生变化, 由贝壳中部的上下两端演变为沿新生贝壳的边缘分布(贝壳两侧的信号不甚清晰)。在担轮幼虫后的早期D形幼虫中(14 hpf), 整个幼虫都能检测到微弱的 cgdpp表达, 但是没有明显的集中部位, 似乎是广泛表达的。为了更清晰地展示cgdpp在贝壳发生过程中的表达模式, 作者在图 4中展示了在原肠胚(8hpf)和担轮幼虫(11hpf)中贝壳形成区与cgdpp的表达区域间的关系。
3 讨论与结论
作者从长牡蛎幼虫cDNA中克隆到了dpp同源序列cgdpp, 其序列具有TGF-β家族的诸多特征, 如信号肽序列, 保守的功能域, 蛋白酶切割位点等。值得关注的是在成熟肽部分的 7个保守的半胱氨酸残基, 在人类BMP2和cgdpp中毫无变化, 说明这些残基在进化过程中承受了巨大的选择压力, 其突变可造成巨大的影响(可能是致死的)。此外, 在距 C端105个氨基酸范围内并没有发现其他的半胱氨酸残基, 这表明可能除了在进化中保守的二硫键外,cgdpp中并没有其他的二硫键存在。
进化分析表明各物种的 dpp依其种属来源聚在一起, 说明从整体序列上来看不同的种类间具有一定的差异, 暗示 cgdpp的部分序列可以在进化中积累变异。这些序列可能来自功能氨基酸之间连接的部分, 这与在多序列比对过程中发现这些部分保守性较差的观察结果一致。另外, 软体动物和脊椎动物在各自聚成一支后又一起形成了更大的一个分支(图2), 这与其种属关系并不一致。作者观察到这个大分支的 bootstrap值相对比较低(只有 45), 可信度远不及其他分支, 推测这种现象可能是由于 cgdpp中的部分序列, 如蛋白切割位点及成熟肽部分比较保守导致的。
作者用整装原位杂交的方法研究了 cgdpp在长牡蛎由卵细胞、受精卵至早期D形幼虫中的表达情况, 其结果对于研究cgdpp的功能具有启示意义。首先, 在卵细胞中未能检测到cgdpp表达, 说明cgdpp并不是母体效应基因, 这与 Kin等[16]在刺牡蛎(Saccostrea kegaki)中的观察一致。受精后的一段时间内(4hpf到8hpf), 贝壳形成区变平、内陷继而扩张,为后续贝壳物质的分泌和最早期贝壳的形成做准备。在此期间, cgdpp在开始并在较长时间内表达于胚胎背部的两个细胞中。Ninov等[17]的相关研究中揭示, dpp信号通路可以直接调控细胞的运动性和内陷,作者认为 cgdpp应该也调控了长牡蛎胚胎背部细胞的变形和内陷等运动过程。此外, 在运动过程中, 显然这些细胞还发生了分化, 由普通的外胚层细胞获得了分泌贝壳物质的能力。这些细胞分化过程也应该有 dpp信号通路的参与, 正如果蝇翅形成过程中前后端细胞的分化过程一样[18]。除此之外, 考虑到dpp在体轴决定中的重要作用[8,12], cgdpp表达于背部细胞中也提示 dpp信号通路可能控制了长牡蛎早期体轴决定过程中的背部化过程。
在担轮幼虫之后, 随着贝壳形成区的扩张,cgdpp的表达由两个细胞扩展到贝壳外边缘的一系列细胞中, 与贝壳的形状一致(图 3、图 4), 提示cgdpp调控了贝壳的形状和形成速度。这与Nederbragt等[2]在一种腹足类(Patella vulgata)贝壳发生过程中的观察结果相同。Nederbragt等还观察到dpp和engrailed在P. vulgata的贝壳发生过程中各自形成一个表达界面。他们认为, 与果蝇翅的发生等许多发育事件相同, dpp和engrailed形成的表达界面界定了贝壳形成细胞与其他普通外胚层细胞的区别。在长牡蛎中可能也存在类似的过程, 如果后面的研究中能够将长牡蛎dpp和engrailed基因同时定位应该能够解答这个问题。在早期D形幼虫中, cgdpp表达量突然下降至痕量水平, 并与贝壳发育区无明显的关联, 提示cgdpp可能仅仅参与了贝壳的发生, 不参与其进一步的发育过程。长牡蛎幼虫贝壳的发育可能是一个正反馈的调节过程, 其形成过程一旦起始, 则可以自发进行下去, 其起始信号(如Dpp等)不是维持其发育的必要条件。
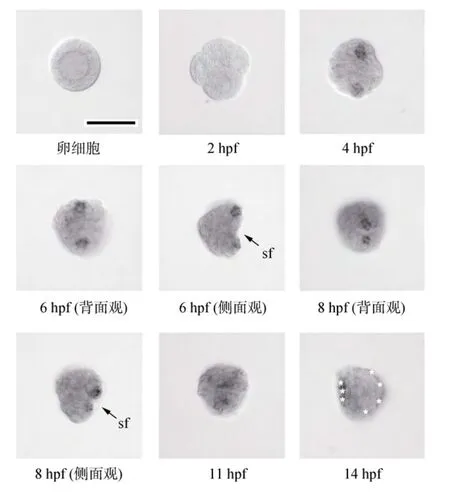
图3 长牡蛎cgdpp的在早期发育中的表达情况Fig.3 Expression pattern of cgdpp mRNA during early development of C. gigas
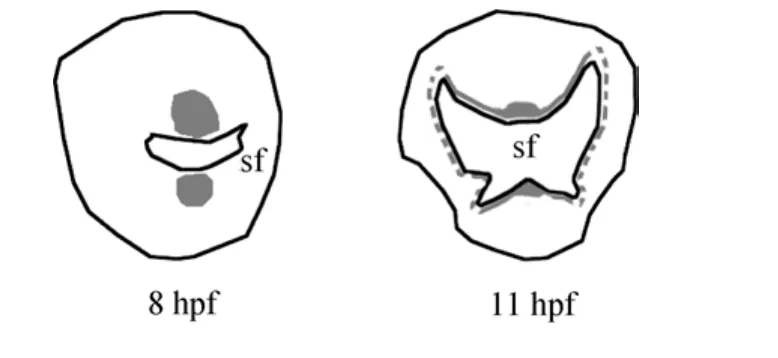
图4 长牡蛎cgdpp在原肠胚(8 hpf)和担轮幼虫(11 hpf)中的表达模式Fig.4 Schemes of the cgdpp expression pattern in the gastrula (8 hpf) and trochophore (11 hpf) of C. gigas
Kin等[16]在刺牡蛎中研究了 dpp基因的表达情况, 其结果与作者的观察大部分一致, 但有一个十分关键的不同点。在担轮幼虫向D形幼虫发育的过程中, Kin认为cgdpp表达于新生的铰合部, 在参与铰合部形成的同时还调控了其形状。但是作者的观察结果与其完全不同, 并没有明确地观察到 cgdpp在铰合部的表达, 而是与之前的在腹足类的观察类似, 即在新生贝壳的外缘观察到cgdpp的mRNA。这种差别可能是由于贝类幼虫在显微镜下不易分辨而导致的观察上的差异。采用更加精准的观察手段, 如激光共聚焦显微镜或者电子显微镜等或许可以给出更加确定的结果。
总之, 在早期发育中长牡蛎胚胎通过细胞运动和细胞分化过程形成了贝壳形成区, 为早期贝壳提供了结构基础, cgdpp作为重要的调控分子可能涉及其中。正如绝大多数发育事件一样, 当中必然还涉及到其他调控分子与 cgdpp协同作用, 这些调控分子是下一步研究中的重要研究目标。
[1] Jackson D J, Wörheide G, Degnan B M. Dynamic expression of ancient and novel molluscan shell genes during ecological transitions[J]. BMC Evolutionary Biology , 2007, 7 (1): 160.
[2] Nederbragt A J, Van Loon A E, Dictus W J A G.Expression of Patella vulgata orthologs of engrailed and dpp-BMP2/4 in adjacent domains during molluscan shell development suggests a conserved compartment boundary mechanism[J]. Developmental Biology, 2002, 246 (2): 341-355.
[3] Shen X, Belcher A M, Hansma P K, et al. Molecular cloning and characterization of lustrin A, a matrix protein from shell and pearl nacre of Haliotis rufescens[J]. Journal of Biological Chemistry, 1997, 272 (51):32472-32481.
[4] Sarashina I, Endo K. The complete primary structure of molluscan shell protein 1 (MSP-1), an acidic glycoprotein in the shell matrix of the scallop Patinopecten yessoensi [J]. Marine Biotechnology, 2001, 3(4):362-369.
[5] Marie B, Zanella-Cléon I, Guichard N, et al. Novel proteins from the calcifying shell matrix of the Pacific oyster Crassostrea gigas [J]. Marine Biotechnology,2011, 13 (6): 1159-1168.
[6] Mouëza M, Gros O, Frenkiel L. Embryonic development and shell differentiation in Chione cancellata(Bivalvia, Veneridae): an ultrastructural analysis[J].Invertebrate Biology, 2006, 125 (1): 21-33.
[7] Weiss I M, Tuross N, Addadi L, et al. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite[J]. Journal of Experimental Zoology, 2002, 293 (5): 478-491.
[8] Nakayama T, Cui Y, Christian J. Regulation of BMP/Dpp signaling during embryonic development[J]. Cellular and Molecular Life Sciences, 2000, 57 (6): 943-956.
[9] Schmidt J E, Suzuki A, Ueno N, et al. Localized BMP-4 mediates dorsal/ventral patterning in the early Xenopus embryo [J]. Developmental biology, 1995, 169 (1):37-50.
[10] Nikaido M, Tada M, Saji T, et al. Conservation of BMP signaling in zebrafish mesoderm patterning[J].Mechanisms of Development, 1997, 61 (1-2): 75-88.
[11] Niwa N, Inoue Y, Nozawa A, et al. Correlation of diversity of leg morphology in Gryllus bimaculatus(cricket) with divergence in dpp expression pattern during leg development[J]. Development, 2000, 127(20):4373-4381.
[12] Ferguson E L, Anderson K V . Decapentaplegic acts as a morphogen to organize dorsal-ventral pattern in the Drosophila embryo [J]. Cell, 1992, 71(3): 451.
[13] Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution, 1987, 4(4): 406-425.
[14] Maures T J, Duan C. Structure, developmental expression, and physiological regulation of zebrafish IGF binding protein-1[J]. Endocrinology, 2002, 143(7):2722-2731.
[15] Herpin A, Lelong C, Favrel P. Transforming growth factor-β-related proteins: an ancestral and widespread superfamily of cytokines in metazoans[J]. Developmental& Comparative Immunology, 2004, 28(5): 461-485.
[16] Kin K, Kakoi S, Wada H. A novel role for dpp in the shaping of bivalve shells revealed in a conserved molluscan developmental program[J]. Developmental Biology, 2009, 329 (1): 152-166.
[17] Ninov N, Menezes-Cabral S, Prat-Rojo C, et al. Dpp signaling directs cell motility and invasiveness during epithelial morphogenesis[J]. Current Biology, 2010, 20(6): 513-520.
[18] Zecca M, Basler K, Struhl G. Sequential organizing activities of engrailed, hedgehog and decapentaplegic in the Drosophila wing [J]. Development, 1995, 121 (8):2265-2278.
