具有共轭结构单元的有机二硫化物双硫键的结构及其电子性质的理论研究
2014-12-01王洁琼曹泽星
王洁琼,曹泽星
(厦门大学化学化工学院,福建 厦门361005)
双硫键是一类重要的化学键,对蛋白质的折叠和稳定性具有重要作用,是电化学能量存取和释放正极材料的重要结构单元.S—Sσ单键可以俘获一个电子形成两中心三电子(two-center three-electron,2c-3e)键,即[S∴S]-.三电子双硫键相对高的稳定性已经被脉冲辐解[1-3]、电子自旋共振[4]、激光闪光光解[2]、电化学[5]等多种技术手段所证实.在生物体内,2c-3e键在无所不在的电子转移反应中充当着中继站的作用[6-7],在维持蛋白质结构和活性方面扮演重要角色.含三电子双硫键的自由基在模型有机化合物中[8-12]、有机金属络合物[13-14]和生物体中都被认为是长寿命的中间体[15-16].
1988年美国Lawrence Berkeley实验室的Visco等[17]首次提出了利用有机二硫化物作锂电池正极材料,通过的电聚合与电解聚过程发生的能量交换实现储能.由此,国内外对新型电池材料的研究开始关注有机二硫化物及其聚合物.这种材料具有能量密度高、工作温度低、无毒价廉等优点,尽管还不能像无机嵌入式化合物Li2MnO4、LiCoO2及LiNiO2那样实现产业化,但仍然是最具应用前景的新型储能材料之一[18-22].目前研究比较成熟的有PDMcT正极材料,但面临充放电可逆性差,放电小分子产物溶解损失,有机二硫化物及其聚合物本身不导电等问题.为克服上述不足,“主链导电,侧链储能”成为新型导电有机二硫聚合物的设计思路.最近,研究人员通过优化分子结构,设计合成了一些新的有机二硫化物和有机二硫聚合物,以改善这种新正极材料的储能性能.
本文选择了4种有机二硫化物的模型体系(图1中的Ⅱ~Ⅴ),其中化合物Ⅳ和Ⅴ能聚合形成长链聚合物.从有机二硫化物单体分子模型出发,应用密度泛函和从头算电子相关方法,计算比较了这些分子中S—S键的得失电子能力和氧化还原中间体的结构特征,讨论了[S∴S]-在有机二硫化合物自由基中的稳定性.
1 计算方法
为了评估不同方法处理S—S的可靠性,对最简单的H2S2分子进行了广泛的测试计算.计算方法包括:CCSD(T)、G3、G2、MP2、wB97XD、M06-2X、X3LYP、B3LYP等,不同方法的计算结果,实验和理论方面的文献值[23-29]列于表1.与文献值比较,G2和 G3结果符合得最好,M06-2X对某些量的预测也具有较高的精度,但对相对大的体系计算花费较大.B3LYP计算方法在计算效率和可靠性方面有较好的平衡,且将 AUG-cc-pVDZ基组扩展到 AUG-cc-pVTZ,计算结果变化不大,表明 B3LYP/AUG-cc-pVDZ计算对有机二硫化物体系具有好的可靠性.

图1 二硫化物分子的结构Fig.1 Structures of disulfides

表1 不同方法预测的H2S2及其衍生物的电子和热力学性质Tab.1 Predicted electronic and thermodynamic properties of H2S2and its derivatives by different approaches
通过B3LYP/AUG-cc-pVDZ计算,对4种有机二硫化物中性分子和得失电子形成的阴阳离子的结构进行了优化.为确定得到的平衡结构是否为势能面上的稳定态,所有优化结构都进行了频率分析,稳定结构不存在虚频,所有振动频率为实数.计算中,考察了分子不同位置俘获电子的可能性及其不同的初始结构,以确定中间体的可能构型和相对稳定性.
绝热的电子亲和能(electron affinity)和电离能(ionization potential)定义如下:
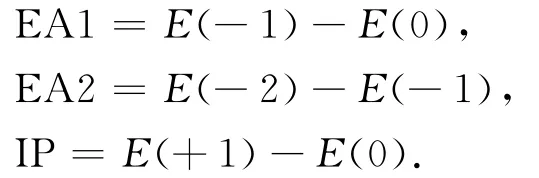
其中,EA1和EA2分别表示第一和第二电子亲和能,IP表示电离能,E(q)表示二硫化物平衡结构的总能量,q表示体系带的电荷,计算中考虑了零点能校正,第一垂直电离能(VIP)的计算均采用中性体系基态的几何构型.为了评估溶剂效应对电子亲和能和电离能的影响,计算中采用了可极化连续介质模型(polarizable continuum model,PCM).所 有 的 计 算 由Gaussian 09程序包完成.
2 结果与讨论
2.1 几何构型和电子性质
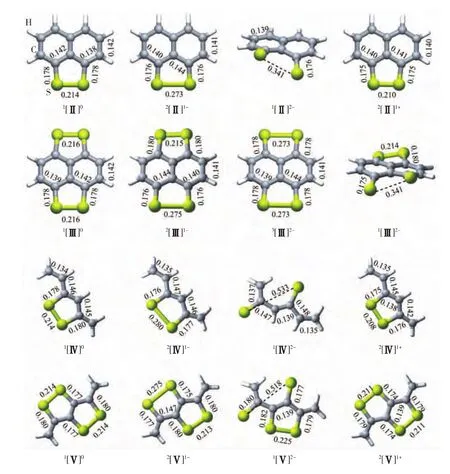
图2 二硫化物Ⅱ~Ⅴ不同荷电态的优化结构(键长以nm为单位)Fig.2 Optimized geometries of disulfidesⅡ~Ⅴ with different charged states(bond lengths in nm)
图2给出了二硫化物(Ⅱ~Ⅴ)不同荷电态的优化结构.B3LYP和G2计算预测的电子亲和能和电离能列于表2.与H2S2相比,二硫化物中共轭结构主链的存在使得S—S键更容易得电子,同时也更容易失去电子,这些得失电子性质的变化可归结为连接S—S键共轭体系对正负离子的稳定作用.表2结果表明,这些二硫化物得一个电子可以形成稳定的一价气相阴离子,而第二电子亲和能为正值,说明二价阴离子在气相中是不稳定的.注意到包含2个S—S键的二硫化物Ⅲ和Ⅴ,其二价阴离子具有相对高的稳定性,其中Ⅲ的二价阴离子含有2个等价的[S∴S]-.而对于Ⅴ最稳定的二价阴离子,2个电子进入同一个S—S键,导致该S—S键断裂,并形成2个S-单元,2个带负电荷单元间的强烈排斥,引起结构发生显著的变化(见图2中的1[Ⅴ]2-).
考虑到溶液中的溶剂化作用,基于PCM模型,计算了水介质环境中二硫化物Ⅱ和Ⅲ的电子亲和能和电离能相关的计算结果合并到表2中.表2结果表明,它们的第一、第二电子亲和能数值接近,而第一电离能却减小,显示水介质环境可以显著地稳定一价和二价阴离子,对阳离子也有一定的稳定作用.在水溶液中,2个过剩电子进入二硫化物Ⅲ同一端的S—S键,形成2个S-单元,不同于气相结构,2个电子分别进入萘环两端的σ*S—S反键.
优化结构显示,不同荷电态二硫化物的结构变化主要在S—S结构单元,其他键长变化不大,表3给出了S—S键长随电子得失的变化.如图3所示[29],一个过剩电子进入S—S的σ*反键轨道,形成稳定的[S∴S]-键,S—S键级由1变为0.5,键的强度减弱,键长变长,这种三电子双硫键键长维持在0.27nm左右.由于失去的电子来源于S原子上的孤对电子,对体系的成键几乎没有影响,因此,阳离子体系的S—S键长和其他键长都变化不大.
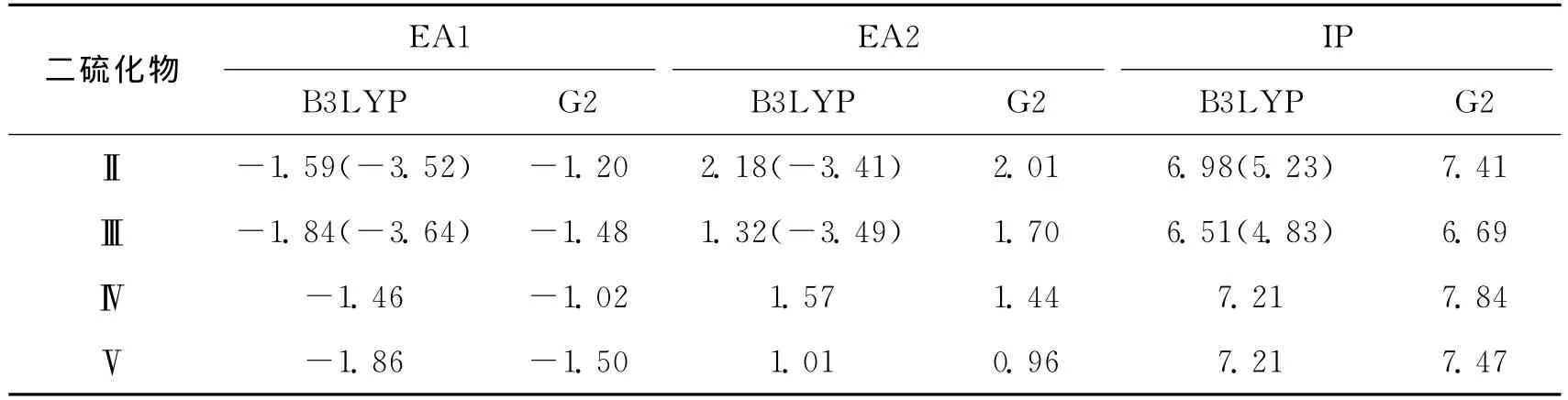
表2 B3LYP和G2计算预测的二硫化物电子亲合能和电离能Tab.2 Electron affinities and ionization potentials of selected disulfides by B3LYP and G2 approaches eV

表3 二硫化物不同荷电态的S—S键长Tab.3 S—S bond lengths of disulfides with the different charged states nm
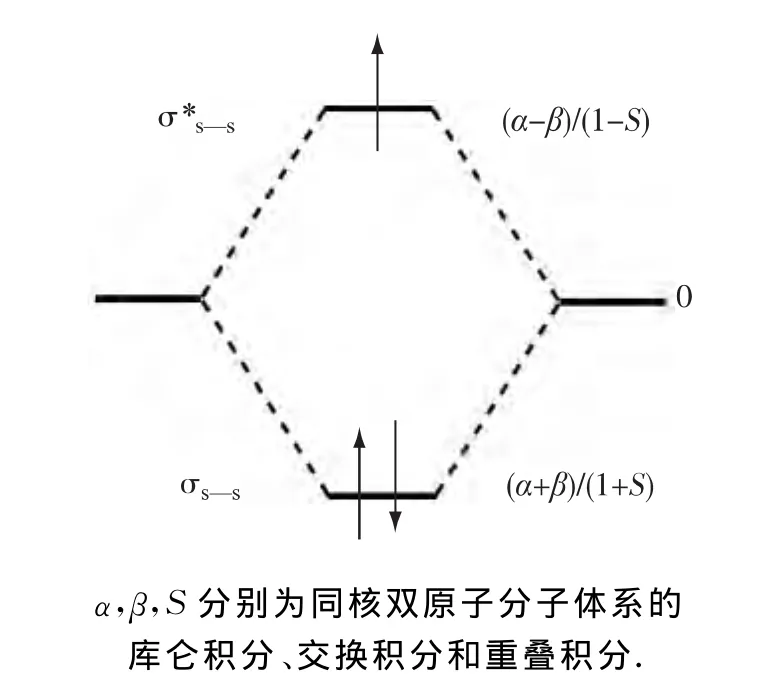
图3 两中心三电子键示意图Fig.3 Schematic diagram of 2c-3ebonding
图2中,1[Ⅱ]2-优化结构显示,2个S-单元之间存在强的排斥作用,导致明显的面外形变.类似的结构变化也出现在闭壳层体系1[Ⅲ]2-中.对于二硫化物Ⅳ和Ⅴ,由于不存在骨架结构的限制,当2个电子进入同一S—S键时,随着S—S键的断裂,体系可以通过C—C单键的转动达到2个S-单元的最大分离,减小静电排斥作用,演化成更稳定的构型,其中2个S-单元的间距增加到0.518nm以上.
对于多S—S键的二硫化物Ⅲ,在分子平面存在2个低能的σ*S—S反键轨道,当2个电子进入这2个σ*轨道时,并不会影响垂直分子平面上的π成键性质.2个σ*S—S反键轨道容纳2个过剩电子有如图4所示的3种可能的电子组态.
计算表明,Ⅲ的二价阴离子最稳定构型是开壳层的双自由基结构,2个单电子分布在萘环两侧,即:(σ*S—S)1(σ*S—S)1.注意到,开壳层的单重态和三重态的结构完全相同,能量也十分接近,表明2个σ*电子基本上定域在两端的S—S键,无相互作用,自旋密度分析也很好地验证了这一点.
类似地,二硫化物Ⅴ的二价阴离子也存在3种稳定构型,但不同于Ⅲ的二价阴离子,Ⅴ的二价阴离子最稳定的构型是闭壳层结构.当2个电子进入Ⅴ的同一S—S键时,S—S键断裂,伴随C—C单键的旋转,2个带负电荷的S-基团充分远离,减小静电排斥,体系变得更稳定.

图4 二硫化物Ⅲ和Ⅴ二价阴离子3种可能的电子组态(自旋密度和相对能量)Fig.4 Three possible electron configurations of disulfides[Ⅲ]2-and[Ⅴ]2- (spin densities and relative energies)
2.2 取代基对有机二硫化物性质的影响
为了探索取代基对有机二硫化物性质的影响,对共轭结构单元上的氢进行了取代(见图1),以调节这些分子的氧化还原能力.取代基包括—Cl和—NO2,—Cl是具有σ吸电子效应和π给电子效应的取代基,—NO2是典型的吸电子效应取代基.从表4结果可以看出,—Cl和—NO2取代使二硫化物Ⅱ~Ⅴ均更易得电子,也更难失电子.—NO2的吸电子能力强于—Cl,取代效应也更明显.对于ⅡCl和ⅡNO2的二价阴离子,其S—S键长变化显示,2个电子都进入S—S键的σ*反键轨道,形成双S-阴离子.
二硫化物ⅢNO2中,第1个过剩电子进入远离—NO2的σ*S—S反键轨道,第2个过剩电子进入另一个σ*S—S反键轨道,自旋平行或相反,分别形成2个[S∴S]-键.
3 结 论
应用密度泛函理论,我们研究了4类有机二硫化物分子的结构和电子性质,讨论了取代基对它们性质的影响.计算结果表明,共轭结构单元的存在对二硫化物中的[S∴S]-有一定的稳定作用,体系的过剩电子进入低能的σ*S—S反键轨道.当σ*S—S容纳2个电子时,S—S键断裂;由于2个S-单元的强烈排斥导致显著的结构畸变,使它们最大程度的分开.对于含2个S—S键的体系,过剩的2个电子可以分别进入不同的σ*S—S轨道或同一轨道,形成单、三态的双自由基或闭壳层的双S-阴离子.当体系受到骨架结构的限制,2个S-单元不能最大远离时,单、三态的双自由基具有相对高的稳定性,反之,双S-阴离子的闭壳层结构更稳定.—Cl和—NO2取代基的存在会导致有机二硫化物分子更容易得电子,更难失电子,—NO2呈现出更强的取代基效应.当—NO2和相连的共轭结构单元存在强的共轭相互作用时,—NO2的存在会改变低能空轨道能级的相对顺序,第1个过剩电子进入体系的π*反键轨道,而不是σ*S—S轨道(如Ⅳ的—NO2取代物).但大多数情况下,σ*S—S是体系中能量最低的空轨道,形成的[S∴S]-具有相对高的稳定性,对拓展有机二硫化物在电池正极材料中的应用具有重要意义.这些模型体系的计算结果有助于认识三电子双硫键的成键特征,对有机二硫化物正极材料分子的设计和应用研究有一定的帮助.

表4 取代基对二硫化物Ⅱ~Ⅴ的电子亲和能和电离能的影响Tab.4 Substituent effect on electron affinities and ionization potentials of disulfideⅡ-Ⅴ eV
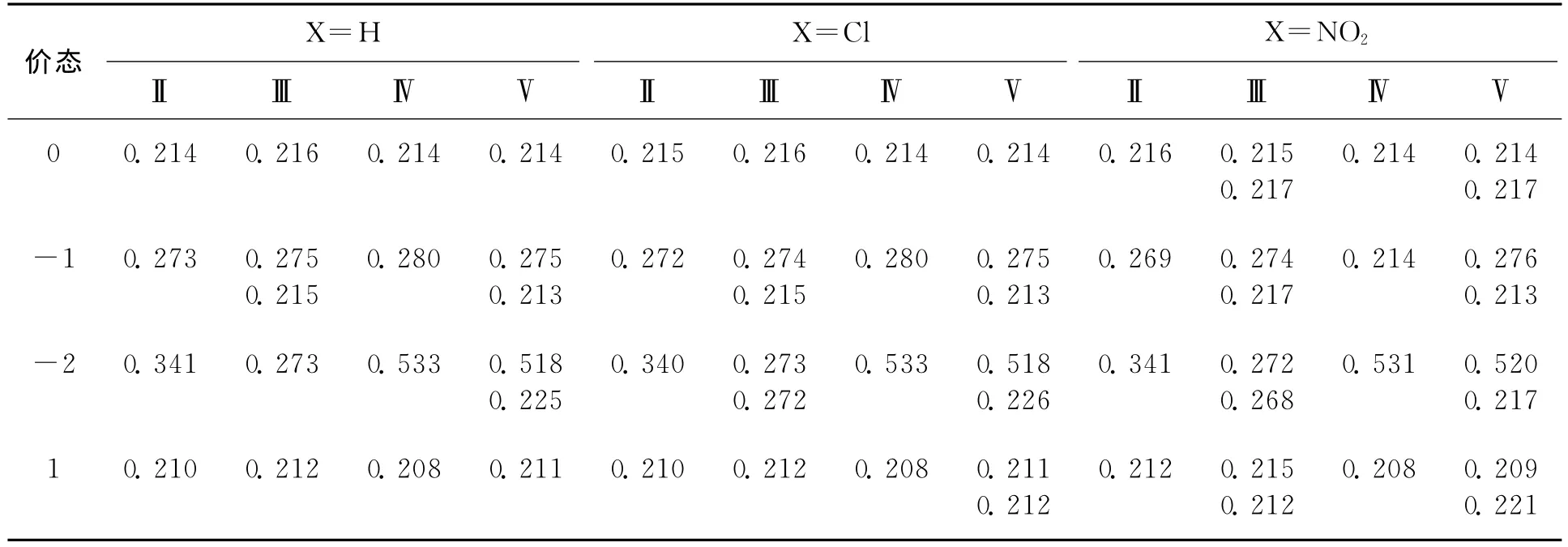
表5 取代基对二硫化物Ⅱ~Ⅴ在不同价态时的S—S键长的影响Tab.5 Substituent effect on the S—S bond length of disulfideⅡ-Ⅴ with different charged states nm
致谢:赵金宝教授提供部分二硫化物的结构和有益的讨论.
[1]Houée-Levin C,Berges J.Conformational stability of disulfide bonds in redox processes[J].Radiat Phys Chem,2008,77(10):1286-1289.
[2]Tung T L,Stone J A.The formation and reactions of disulfide radical anions in aqueous solution[J].Can J Chem,1975,53(21):3153-3157.
[3]Fang X,Wu J,Wei G,et al.Generation and reactions of the disulphide radical anion derived from metallothionein:apulse radiolytic study[J].Int J Radiat Biol,1995,68(4):459-466.
[4]Lawrence C C,Bennati M,Obias H V,et al.High-field EPR detection of a disulfide radical anion in the reduction of cytidine 5′-diphosphate by the E441QR1mutant of Escherichia coli ribonucleotide reductase[J].Proc Natl Acad Sci USA,1999,96(16):8979-8984.
[5]Johnson D L,Polyak S W,Wallace J C,et al.Probing the stability of the disulfide radical intermediate of thioredoxin using direct electrochemistry[J].L Peptide Sci,2003,10(5/6):495-500.
[6]Giese B,Graber M,Cordes M.Electron transfer in peptides and proteins[J].Curr Opin Chem Biol,2008,12(6):755-759.
[7]Dumont E,Laurent A D,Loos P F,et al.Analyzing the selectivity and successiveness of a two-electron capture on a multiply disulfide-linked protein[J].J Chem Theory Comput,2009,5(6):1700-1708.
[8]Antonello S,Benassi R,Gavioli G,et al.Theoretical and electrochemical analysis of dissociative electron transfers proceeding through formation of loose radical anion species:reduction of symmetrical and unsymmetrical disulfides[J].J Am Chem Soc,2002,124(25):7529-7538.
[9]Antonello S,Daasbjerg K,Jensen H,et al.Formation and cleavage of aromatic disulfide radical anions[J].J Am Chem Soc,2003,125(48):14905-14916.
[10]Gauduel Y,Marignier J L,Belloni J,et al.Ultrafast formation of a three-electron-bonded radical anion(CH3S∴SCH3-)in a liquid organic sulfur compound[J].J Phys Chem A,1997,101(48):8979-8986.
[11]Gauduel Y,Gelabert H,Guilloud F.Real-time probing of a three-electron bonded radical:ultrafast one-electron reduction of a disulfide biomolecule[J].J Am Chem Soc,2000,122(21):5082-5091.
[12]Gauduel Y,Launay T,Hallou A.Femtosecond probing of a 2c/3edisulfide bond making in liquid phase[J].J Phys Chem A,2002,106(9):1727-1732.
[13]Mel′nikov M Y,Weinstein J A.Structural reorganization in the excited state of transition metal complexes[J].High Energ Chem,2008,42(4):287-289.
[14]Wenska G,Filipiak P,Asmus K D,et al.Formation of a sandwich-structure assisted,relatively long-lived sulfur-centered three-electron bonded radical anion in the reduction of a bis (1-substituted-uracilyl)disulfide in aqueous solution[J].J Phys Chem B,2008,112(32):10045-10053.
[15]Weik M,Berges J,Raves M L,et al.Evidence for the formation of disulfide radicals in protein crystals upon X-ray irradiation[J].J Synchrotron Radiat,2002,9(6):342-346.
[16]Carles S,Lecomte F,Schermann J P,et al.Non-dissociative electron capture by disulfide bonds[J].J Phys Chem A,2001,105(23):5622-5626.
[17]Visco S J,DeJonghe L C.Ionic conductivity of organosulfur melts for advanced storage electrodes[J].J Electrochem Soc,1988,135(12):2905-2909.
[18]苏育志,翁国明,刘兆清.有机二硫化物CE反应机理的电极过程动力学[J].广州大学学报:自然科学版,2009,8(3):45-48.
[19]Su Y Z,Dong W,Zhang J H,et al.Poly[bis(2-aminophenyloxy)disulfide]:apolyaniline derivative containing disulfide bonds as a cathode material for lithium battery[J].Polymer,2007,48(1):165-173.
[20]Li Y,Zhan H,Kong L,et al.Electrochemical properties of PABTH as cathode materials for rechargeable lithium battery[J].Electrochem Commu,2007,9(5):1217-1221.
[21]Xue L J,Li J X,Hu S Q,et al.Anthracene based organodisulfide positive active materials for lithium secondary battery[J].Electrochem Commu,2003,5(10):903-906.
[22]Deng S R,Kong L B,Hu G Q,et al.Benzene-based polyorganodisulfide cathode materials for secondary lithium batteries[J].Electrochim Acta,2006,51(13):2589-2593.
[23]Cheng Bingming,Eberhard Jürg,Chen Weichen,et al.I-onization energy of HSSH[J].J Chem Phys,1997,107(13):5273-5274.
[24]Frost D C,Lee S T,McDowell C A,et al.A versatile,fast pumping ultraviolet photoelectron spectrometer for the study of transient and unstable species[J].J Electron Spectrosc,1977,12(1):95-109.
[25]Flisza′r,S.In atoms,chemical bonds and bond dissociation energies;lecture notes in chemistry[M].Berlin:Springer-Verlag,1994.
[26]Luo Y R.Handbook of bond dissocation energies in organic compounds[M].Boca Raton,FL:CRC Press:2003.
[27]Breyer F,Frey P,Hotop H.High resolution photoelectron spectrometry of negative ions:rotational transitions in laser-photodetachment of OH-,SH-,SD-[J].Z Phys A:Atoms and Nuclei,1981,300(1):7-24.
[28]Braïda B,Hiberty P C.A simplified Gaussian-2scheme for determining electron affinities of covalent bonds.Application to the disulfide bond RS-SR′(R,R′=H,CH3,C2H5)[J].J Phys Chem A,2003,107(23):4741-4747.
[29]Braïda B,Thogersen L,Wu W,et al.Stability,metastability,and unstability of three-electron-bonded radical anions.A model ab initio theoretical study[J].J Am Chem Soc,2002,124(39):11781-11790.
