夏眠期间仿刺参生长、肠体比以及RNA/DNA比值变化的研究
2014-12-01王青林于姗姗董云伟
王青林,于姗姗,董云伟
(厦门大学 海洋与地球学院,近海海洋环境科学国家重点实验室,福建 厦门361102)
仿刺参(Apostichopus japonicus Selenka),又名刺参,主要分布于北纬35~44°N的西北太平洋沿岸[1-2].当水温超过25 ℃时,仿刺参进入夏眠(aestivation)状态[3-4].夏眠期间,仿刺参会出现代谢减弱,体质量减轻,内脏器官退化等现象[5-6].夏眠是仿刺参生活史中的一个重要环节,有研究指出夏眠是仿刺参应对夏季高温期的一种适应策略[4,7].但是由于夏眠持续时间长达4个月,期间仿刺参体质量下降,且死亡率高达30%~40%,严重影响了仿刺参的生长以及产量的提高[8].因此研究夏眠期间仿刺参的生理有助于了解其夏眠机制,对仿刺参夏季高温养殖提供一定的理论指导.
动物的生长是通过蛋白质生物合成实现的[9-10].Bulow[11]研究认为:在蛋白质合成过程中,mRNA和tRNA是重要的参与者,当组织中的蛋白质合成速度加快时,RNA浓度也增加.组织中的RNA浓度与动物的生长速度、外界食物密度以及温度等因素相关[12-13],而 DNA是生物的遗传物质,含量一般保持稳定,不受外界因子的影响[14].因此,RNA/DNA(简称R/D)比值能准确地反映组织蛋白质合成水平.20世纪70年代以来,人们开始利用R/D比值来判断鱼类生长的优劣,认为其可以作为鱼类生长状况的评价 指 标[15-18].司 亚 东 等[19]通 过 对 比 研 究 表 明 鲤(Cyprinus carpio)白肌中的 R/D比值在饥饿与饱食状态下有差异,认为R/D比值可以推断鱼幼体的营养状况.在甲壳动物的研究中也得到了类似的结果[20].此外,Kobari等[21]指出 R/D比值可以作为辨别桡足类动物是否进入休眠状态的简单有效的生理指标.但是关于R/D比值在棘皮动物特别是仿刺参方面的研究还尚未见报道.因此,本实验通过测定分析仿刺参夏眠过程中肠体比以及肠、呼吸树和体壁中R/D比值变化,研究夏眠期间仿刺参R/D比值与其生理状况之间的关系.
1 材料与方法
1.1 实验材料
实验所需仿刺参幼参采自山东省即墨市育苗场,平均体质量为(50.43±0.11)g.购买的仿刺参在实验室内16℃暂养.暂养期间不间断充气,光照周期为14 L∶10D.水源为沙滤自然海水,每天换水1/2,海水盐度为30左右.换水前对海水进行预加热,防止换水造成水族箱温度变化过大.每天4:00pm投喂仿刺参配合饲料,组成(质量分数)为:粗蛋白(22.9±0.2)%、粗脂肪(2.1±0.1)%、灰分(34.7±0.6)%,含水量(9.0±0.1)%,能值(10.6±0.0)kJ/g.
1.2 实验方法
1.2.1 温度变化模式
实验分夏眠组和对照组,共持续49d.夏眠组水温以每周5℃(0.7℃/d)的速度由16℃逐渐升至26℃,水温达到26℃后维持5周.对照组16℃恒温维持7周.
1.2.2 生长实验
将仿刺参放置在6个玻璃缸中(长×宽×高:450 mm×250mm×350mm),分夏眠组和对照组,每组3个缸,每缸3只.仿刺参初始平均湿体质量为(50.72±1.05)g,对照组和夏眠组没有显著性差异(p>0.05).在整个实验过程中,每7天称仿刺参体质量一次,实验持续49d.实验结束后,称仿刺参末体质量.称体质量时,先对仿刺参进行24h饥饿,然后用灭菌纱布拭去体表水后用MP-120型电子天平进行湿体质量的称量.
仿刺参特定生长率(SGR)由以下公式计算[22]:

其中,W2和W1分别表示仿刺参的末体质量(g)和初始体质量(g);D为实验持续的时间(d).
1.2.3 肠体比实验
将仿刺参放置在10个玻璃缸中(长×宽×高:450mm×250mm×350mm),分夏眠组和对照组,每组5个缸,每缸10只.分别在0,7,14,21,28,35,42和49d每缸随机取1只仿刺参,迅速解剖并分离出肠、呼吸树、体壁,称量后保存于液氮中,待测.对肠、呼吸树、体壁进行称量时,先用滤纸吸去表面水分,然后用MP-120型电子天平称量.
肠体比(viserosomatic index,VI)按照以下公式计算:

其中,Wi为肠质量(g);W 为仿刺参体质量(g).
1.2.4 R/D比值测定
采用刘存歧等[20]的方法进行.
把适量肠、呼吸树或体壁与缓冲液(0.05mol/L Tris-HCl,pH=7.4)混合,匀浆,取1.4mL匀浆液与0.7mL冷的0.6mol/L HClO4混合.放置冰上冷却15min后,4℃离心(12 000r/min)10min(GL-20G-II冷冻离心机,上海安亭科学仪器厂),弃去上清液.在沉淀中加入1.12mL 0.3mol/L的 KOH 37 ℃水浴1h,然后冰浴30min,4℃离心10min(同上).取上清液,于751G型分光光度计(上海分析仪器厂)上读取260nm处的吸光值,此为RNA在260nm处的吸光值.将沉淀用2.0mL冷的0.2mol/L的 HClO4洗涤,离心,去掉上清液.在沉淀中加入2.2mL 0.6 mol/L的HClO4,5℃水浴15min后,冰浴15min,离心,沉淀为蛋白质.取上清液,在260nm处测吸光值,此为DNA在260nm处的吸光值.从而估测RNA和DNA的含量,计算R/D(质量比)比值.
1.3 数据分析
数据统计采用SPSS 13.0进行,同组不同时间点之间仿刺参体质量以及R/D比值的差异采用单因子方差分析(one-way ANOVA);同组不同时间点之间肠体比差异采用体质量为协变量的协方差分析(analysis of covariance);相同时间点不同组之间仿刺参体质量、肠体比以及R/D比值的差异采用t检验进行分析,以p<0.05作为差异显著的标准.
2 结 果
2.1 生 长
如图1所示,实验期间对照组仿刺参体质量持续增加,不同时间点仿刺参体质量差异显著(p=0.011).夏眠组仿刺参体质量呈下降趋势,第49天时仿刺参湿体质量降至(41.34±0.57)g,且不同时间点差异显著(p<0.001).从第21天开始对照组和夏眠组仿刺参体质量差异显著(21d:p=0.012;28d:p=0.004;35d:p=0.002;42d:p=0.001;49d:p=0.001).
2.2 肠体比
如图2,对照组仿刺参的肠体比比较稳定,各时间点差异不显著(p=0.279).夏眠组仿刺参不同时间点肠体比变化差异显著(p<0.001),可以分成2个阶段,在0~28d仿刺参肠体比急剧下降,从(2.73±0.07)%降至(0.34±0.04)%;在28~49d肠体比维持在较低的水平.且体质量和取样点对肠体比的交互作用不显著(夏眠组:p=0.451;对照组:p=0.553).从第14天开始对照组和夏眠组仿刺参肠体比比值差异显著(14d:p=0.012;21d:p=0.016;28d:p=0.003;35d:p<0.001;42d:p=0.001;49d:p<0.001).

图1 2种温度模式下仿刺参体质量变化Fig.1 The body weight of the sea cucumber

图2 2种温度模式下仿刺参肠体比的变化Fig.2 The viserosomatic index of sea cucumbers
2.3 R/D比值
2.3.1 体壁、呼吸树、肠中R/D比值
体壁的R/D比值如图3(a)所示.实验过程中,对照组R/D比值始终维持在较低的水平,且各时间点之间差异不显著(p=0.258).夏眠组R/D比值的变化分2个阶段:温度升高的过程中,R/D比值逐渐升高,温度恒定后R/D比值开始逐渐下降,至实验结束时恢复到初始水平,不同时间点之间差异显著(p=0.001).7,14,21和28d夏眠组R/D比值显著高于对照组(7d:p=0.024;14d:p=0.024;21d:p=0.003;28d:p=0.036).
呼吸树中R/D比值如图3(b)所示.对照组R/D比值始终维持在较低的水平,且各时间点之间差异不显著(p=0.975).夏眠组R/D比值在升温过程中逐渐升高,然后在14~28d维持在较高的水平,随后逐渐下降,至49d恢复至初始水平,各时间点之间差异显著(p=0.001).7,14,21和28d夏眠组R/D比值显著高于对照组(7d:p=0.034;14d:p=0.017;21d:p=0.006;28d:p=0.026).
肠中R/D比值如图3(c)所示.对照组R/D比值始终维持在较低的水平,且各时间点之间差异不显著(p=0.334).夏眠组 R/D比值变化总体呈现先升高后降低的趋势,各时间点之间差异显著(p<0.001).7,21和28d夏眠组R/D比值显著高于对照组(7d:p=0.026;21d:p=0.026;28d:p=0.032).
2.3.2 夏眠组仿刺参肠、呼吸树和体壁中R/D比值的对比
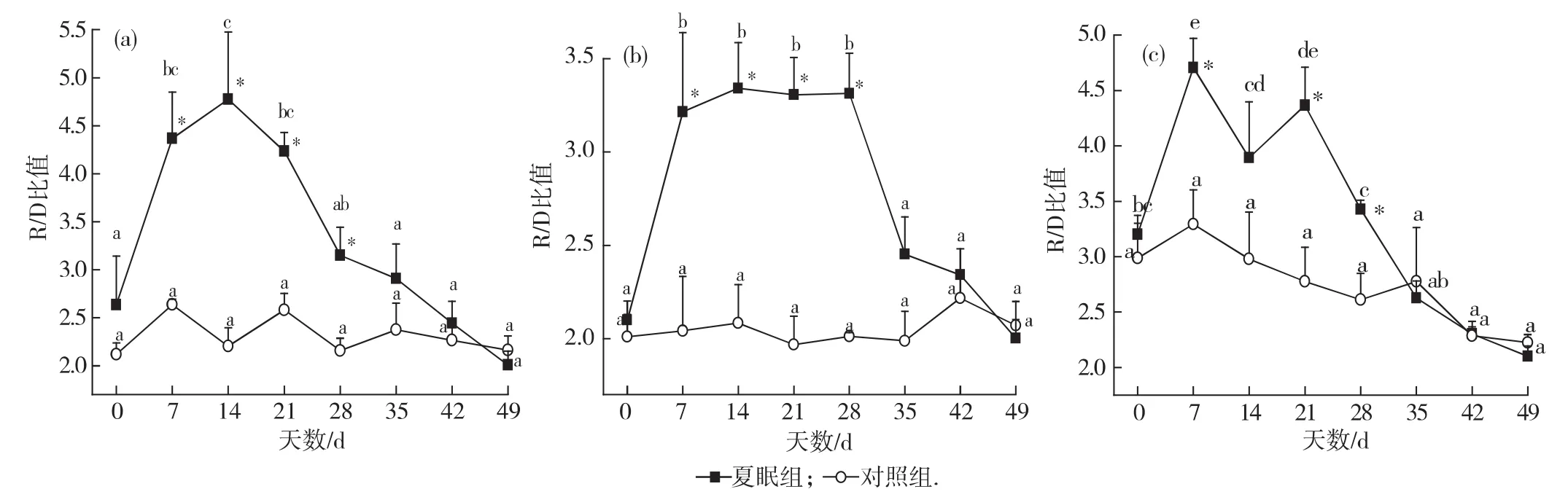
图3 2种温度模式下仿刺参体壁(a)、呼吸树(b)以及肠(c)R/D比值的变化Fig.3 The R/D ratio in body wall(a),respiratory tree(b)and intestine(c)of sea cucumbers A.japonicus in the two treatments in a 49dtrial
如图4所示,夏眠组肠、呼吸树和体壁中R/D比值总体呈现相同的变化趋势,其中呼吸树变化幅度最小,体壁变化幅度最大,肠表现出了较高的初始值.各取样点3个部位R/D比值差异不显著(0d:p=0.148;7d:p=0.086;14d:p=0.224;21d:p=0.051;28d:p=0.680;35d:p=0.486;42d:p=0.812;49d:p=0.806).
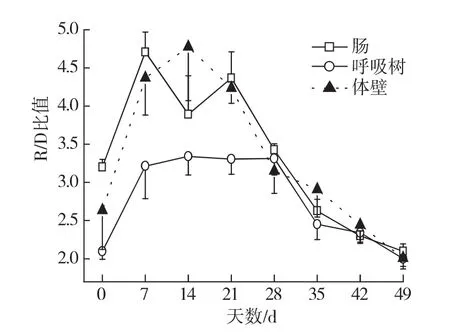
图4 夏眠组仿刺参肠、体壁及呼吸树R/D比值的对比Fig.4 The R/D ratio in intestine,body wall and respiratory tree of sea cucumbers A.japonicus in aestivation group in a 49dtrial
3 讨 论
夏眠是动物应对食物缺乏、环境高温等极端生存条件的一种生存策略[23-25].夏眠期间仿刺参处于休眠状态,肠道退化,摄食停止,体质量减轻[4,26-27].高温期仿刺参摄食情况可以作为判断其是否进入夏眠阶段的依据[28-30].实验过程中,夏眠组仿刺参体质量持续下降(图1).期间,观察发现,随着温度缓慢升高仿刺参摄食逐渐减少.当温度升至26℃,并维持1周时仿刺参摄食基本为0,因此可以认为仿刺参进入了夏眠阶段.
实验期间夏眠组仿刺参的肠体比呈下降的趋势,按比值下降的程度可分为3个阶段:第1阶段从0~14d;第2阶段从14~21d;第3阶段从21~49d.其中第2阶段肠体比急剧下降,至第3阶段时肠体比维持在较低的水平.肠体比比值的下降表明仿刺参肠的退化,李霞等[31]和苏琳等[32]根据消化道外部形态和组织结构变化特点,将夏眠退化过程分为早、中、晚3个阶段,其中中期消化道萎缩现象明显,组织结构退化严重,此期对应本实验第2阶段,到晚期时消化道已经萎缩成细线状,此时仿刺参进入夏眠状态.因此21d时仿刺参进入夏眠状态.这与根据摄食情况判断仿刺参是否进入夏眠阶段的结果一致.夏眠期间消化道急剧萎缩,摄食停止,此时没有外源食物摄入,仿刺参只能消耗自身物质来维持基本的代谢活动,导致体质量持续下降(图1).
本实验的结果显示,从7~28d夏眠组仿刺参肠、体壁及呼吸树中R/D比值均高于对照组,且21d(夏眠开始)和28d(夏眠状态持续1周)的R/D比值要显著高于对照组(p<0.05).我们之前的研究表明,当水温由16℃升至26℃的过程中,HSP70的表达水平随温度的升高而上调,进入夏眠阶段后,初期HSP70表达维持在较高的水平,随后随着夏眠时间的持续呈现下降的趋势[4].本实验中,相同的温度模式下,HSP70的表达应该具有相同的表达趋势,即:从0~14d,热休克蛋白(HSPs)表达量逐渐升高,随后在21~28d维持在较高的水平,然后随着实验的进行,表达量逐渐下降至初始水平.HSPs表达水平与R/D比值呈现出的相同趋势,说明这种比值的升高与体内大量合成用于抵抗高温胁迫的蛋白质有关.HSP70具有帮助变性蛋白重新折叠,防止变性蛋白凝聚沉淀的作用[33-35].在高温胁迫条件下,机体会优先合成 HSPs,因此HSPs表达水平和R/D比值有所升高.但是这种过程不能持续太长时间,这是因为HSPs的合成以及发挥作用需要消耗大量的能量,机体中存在着热耐受和代谢输出之间的一种平衡[35].在夏眠阶段为维持生存,必须降低代谢,因此蛋白质的合成不能较长时间维持高水平,故在本实验中后期HSPs和R/D比值逐渐下降.
体壁、呼吸树以及肠R/D比值不同(图4),这是因为不同器官对温度胁迫的敏感性不同[36].体壁R/D比值变化幅度较大,说明相比呼吸树和肠,体壁能够更敏感地反映夏眠状态仿刺参R/D比值的变化.夏眠组肠R/D比值在14d较7d下降,且差异显著(p<0.05),主要是由于升温过程中,仿刺参肠的退化(图3(c)).从图2可以看出14d开始肠体比急剧下降,且与7和21d差异显著(p<0.05),说明肠在此阶段结构退化非常严重,这种组织结构的退化通过R/D比值的降低来体现.从14~21d,夏眠组仿刺参仍有少量摄食,到21d时基本为0.摄食活动说明21d时肠仍然具有一定的结构和功能,因此此时R/D比值较实验后期有较高的水平.
Kobari等[21]通过对比水体表层和中层桡足类R/D比值发现,中层的处于休眠状态的桡足类R/D比值显著低于表层活跃个体,认为R/D比值可以作为评价此种动物是否进入夏眠的指标.目前尚未发现有关于其他水生动物的相关报道.本实验结果表明,在夏眠初期夏眠组R/D比值显著高于对照组,表明R/D比值能够反映夏眠仿刺参的一些特征,但是关于R/D比值能否作为评价仿刺参进入夏眠的指标还需要进一步的研究.
总体来说,夏眠过程中仿刺参肠道严重退化,R/D比值可以用来反映夏眠阶段仿刺参的生长特征,夏眠初期肠、体壁及呼吸树中R/D比值的升高可能与HSPs的上调表达有关.
[1]LiaoY L.The aspidochirote holothurians of China with erection of a new genus[C]∥Proceedings of the European Colloquium on Echinoderms.Rotterdam,Holland:A A Balkema,1980:115-120.
[2]廖玉麟.中国动物志:棘皮动物门,海参纲[M].北京:科学出版社,1997.
[3]Yang H S,Zhou Y,Zhang T,et al.Metabolic characteristics of sea cucumber Apostichopus japonicus(Selenka)during aestivation[J].Journal of Experimental Marine Biology and Ecology,2006,330:505-510.
[4]Ji T T,Dong Y W,Dong S L.Growth and physiological responses in the sea cucumber,Apostichopus japonicus Selenka:aestivation and temperature[J].Aquaculture,2008,283(1/2/3/4):180-187.
[5]YangH S,Yuan X T,Zhou Y,et al.Effects of body size and water temperatureon food consumption and growth in the sea cucumber Apostichopus japonicus (Selenka)with special reference to aestivation[J].Aquaculture Research,2005,36:1085-1092.
[6]Dong Y W,Dong S L.Induced thermotolerance and expression of heat shock protein 70in sea cucumber Apostichopus japonicus[J].Fishery Science,2008,74:573-578.
[7]Yuan X T,Yang H S,Wang L L,et al.Effects of aestivation on the energy budget of sea cucumber Apostichopus japonicas(Selenka)(Echinodermata:Holothuroidea)[J].Acta Ecologica Sinca,2007,27:3155-3161.
[8]刘永安,李馥馨,宋本祥,等.刺参(Apostichopus japonicus SelenKa)夏眠习性研究Ⅰ——夏眠生态特点的研究[J].中国水产科学,1996,3(2):41-48.
[9]Valente L M P,Moutou K A,Conceição L E C,et al.What determines growth potential and juvenile quality of farmed fish species[J].Reviews in Aquaculture,2013,5(Sup.1):S168-S193.
[10]Carter C G,Mente E.Protein synthesis in crustaceans:a review focused on feeding and nutrition[J].Central European Journal of Biology,2014,9:1-10.
[11]Bulow F J.Seasonal variations in RNA/DNA ratios and in indicators of feeding,reproduction,energy storage,and condition in population of Bluegill,Lepomis macrochirus Rafinesque[J].Journal of Fish Biology,1981,18(3):237-244.
[12]Wagner M,Durbin E,Buckley L.RNA∶DNA ratios as indicators of nutritional condition in the copepod Calanus finmarchicus[J].Marine Ecology Progress Series,1998,162:173-181.
[13]Wagner N D,Hillebrand H,Wacker A,et al.Nutritional indicators and their uses in ecology [J].Ecology Letters,2013,16:535-544.
[14]Sivaraman G K,Barat A,Ali S,et al.Prediction of fish growth rate and food availability in the Himalayan Waterbodies by estimation of RNA/DNA ratios[J].IUP Journal of Genetics & Evolution,2011,4(3):15-19.
[15]Grimm C,Lehmann K,Clemmesen C,et al.RNA/DNA ratio is an early responding,accurate performance parameter in growth experiments of noble crayfish Astacus astacus(L.)[J].Aquaculture Research,2013(Article first published online).doi:10.1111/are.12348.
[16]Zehra S,Khan M A.Dietary lysine requirement of fingerling Catla catla (Hamilton)based on growth,protein deposition,lysine retention efficiency,RNA/DNA ratio and carcass composition[J].Fish Physiology and Bio-Chemistry,2013,39(3):503-512.
[17]BuckleyL J.Relationships between RNA/DNA ratio,prey density,and growth rate in Atlatic cod (Gadus morhua)larvae[J].Journal ofthe Fisheries Board of Canada,1979,36(12):1497-1502.
[18]Mercaldo-Allen R,Kuropat C A,Perry D M,et al.Relation between nucleic acid indices and growth rate in fed and fasting juvenile scup[J].North American Journal of Aquaculture,2014,76(1):1-8.
[19]司亚东.鲤鱼白肌中的RNA/DNA值与其生长的关系[J].上海水产大学学报,1992,1(3/4):159-167.
[20]刘存歧,沈会涛,吴玲玲.日本沼虾体内RNA/DNA比值与其生长关系的研究[J].河北大学学报:自然科学版,2006,26(5):524-528.
[21]Kobari T,Mori H,Tokushige H.Nucleic acids and protein content in ontogenetically migrating copepods in the Oyashio region as influenced by development stage and depth distribution [J].Journal of Plankton Research,2013,35(1):97-104.
[22]董云伟,董双林,田相利,等.不同水温对刺参幼参生长、呼吸机体组成的影响 [J].中国水产科学,2005,12(1):33-37.
[23]Abe A S.Estivation in South American amphibians and reptiles[J].Brazilian Journal of Medical and Biological Research,1995,28:1241-1247.
[24]LandS C,BernierN J.Estivation,mechanisms and control of metabolic suppression[M].Amsterdam,Holland:Elsevier Science,1995.
[25]Withers P C,Cooper C E.Metabolic depression:a historical perspective[J].Prog Mol Subcell Biol,2010,49:1-23.
[26]Yang H S,Zhou Y,Zhang T,et al.Metabolic characteristics of sea cucumber Apostichopus japonicus(Selenka)during aestivation[J].Journal of Experimental Marine Biology and Ecology,2006,330(2):505-510.
[27]Fangyu W,Yang Y H,Xiaoyu W,et al.Antioxidant enzymes in sea cucumber Apostichopus japonicus (Selenka)during aestivation[J].Journal of the Marine Biological Association of the United Kingdom,2011,91(1):209-214.
[28]Choe S.Study of sea cucumber:morphology,ecology and propagation of sea cucumber[M].Tokyo,Japan:Kaibundou Publisher,1963.
[29]李馥馨,刘永宏,宋本祥,等.海参(Apostichopus japonicus Selenka)夏眠习性研究II.夏眠致因的探讨 [J].中国水产科学,1996,3(2):49-57.
[30]袁秀堂.刺参生理生态学及其生物修复作用的研究[D].青岛:中国科学院海洋研究所,2005.
[31]李霞,王霞.仿刺参在实验性夏眠过程中消化道和呼吸树的组织学变化[J].大连水产学院学报,2007,22(2):82-85.
[32]苏琳,陈慕雁,王天明,等.刺参夏眠不同时期划分以及前肠各组织层厚度定量分析[J].海洋科学,2012,12:1-5.
[33]Kostenko S,Jensen K L,Moens U.Phosphorylation of heat shock protein 40(Hsp40/DnaJB1)by mitogen-activated protein kinase-activated protein kinase 5 (MK5/PRAK)[J].The International Journal of Biochemistry& Cell Biology,2014,47:29-37.
[34]EllisR J.Stress proteins as molecular chaperones[M].New York,USA:Marcel Dekker,1996.
[35]Somero G N.Thermal physiology and vertical zonation of intertidal animals:optima,limits,and costs of living[J].Integrative and Comparative Biology,2002,42:780-789.
[36]Selvakumar S,Geraldine P.Heat shock protein induction in the freshwater prawn Macrobrachium malcolmsonii:acclimation-influenced variations in the induction temperatures for Hsp70[J].Comparative Biochemical Physiology,2005,140A:209-215.
