内生链霉菌Streptomyces sp.LC18中安莎霉素类化合物的发现
2014-12-01李善仁王浩鑫鲁春华沈月毛
李善仁,孟 瑾,王浩鑫,鲁春华,沈月毛*
(1.厦门大学生命科学学院,福建 厦门361102;2.山东大学药学院,山东 济南250012;3.山东大学生命科学学院,山东 济南250100)
安莎霉素(ansamycins)是一类主要由微生物产生的结构独特的大环内酰胺类抗生素,其结构特征由一平面的芳香核和连接芳香核2个不相邻位置脂肪链桥组成的环状结构.安莎霉素类化合物具有抗菌、抗肿瘤等显著的生物活性,其中,最具代表性如利福霉素(rifmaycin)衍生物利福平是治疗结核的一线药物[1-2];格尔德霉素(geldanamycin)和美登木素(maytansinoid)的衍生物分别用于肿瘤治疗[3-5].安莎霉素属于I型聚酮类化合物,其生物合成是以3-氨基-5-羟基苯甲酸 (3-amino-5-hydroxybenzoic acid,AHBA)为起始单元,通过聚酮合酶催化添加乙酸或丙酸单元组装聚酮链,由酰胺合酶环化释放聚酮链形成安莎前体,经过一系列的后修饰反应,形成不同的安莎霉素[6].目前已经发现约200多个安莎霉素类化合物,结构上可以分为5酮、7酮、8酮、9酮、11酮和14酮,由于聚酮链的延伸次数并不像大环类酯类化合物一样连续,我们推测自然界中还可能存在其他聚酮链长度的安莎霉素类化合物[7-8].因此,从自然界特异生境微生物资源中筛选挖掘新型安莎霉素的潜力仍然巨大.
红树植物生长于陆地与海洋交界带的浅滩中,是陆地向海洋过渡的特殊生态系统,与红树植物协同进化的内生菌是发现活性天然产物的重要来源[9].我们课题组前期从红树林植物中分离得到一株内生链霉菌Streptomyces sp.LC18,通过PCR检测发现其基因组中含有与安莎霉素合成相关的3-氨基-5-羟基苯甲酸(AHBA)合酶基因,具有产生安莎霉素类化合物的潜力.因此,本文对Streptomyces sp.LC18的次级代谢产物进行了研究,以期获得结构新颖的安莎霉素类化合物.
1 材料与方法
1.1 材 料
1.1.1 菌 株
Streptomyces sp.LC18分离自红树林植物秋茄中的内生链霉菌,由厦门大学生命科学学院微生物药物实验室保存.
1.1.2 培养基
燕麦培养基(ISP3):燕麦20g,微量元素液1mL,琼脂18g,蒸馏水1 000mL,pH 7.2.(微量元素溶液:Fe2SO4·7H2O 0.1g,MnCl2·4H2O 0.1g,ZnSO4·7H2O 0.1g,蒸馏水100mL).
LB培养基:胰蛋白胨10g,酵母提取物5g,NaCl 5g,蒸馏水1 000mL,pH 7.0.
PDA培养基:马铃薯200g,葡萄糖20g,琼脂18 g,蒸馏水1 000mL.
1.1.3 试 剂
DMEM 购自Gibco BRL公司;二甲亚砜(DMSO)购自Sigma公司;噻唑蓝(MTT)购自华美公司;顺铂(cisplatin)购自锦州制药一厂;常用有机溶剂如甲醇、丙酮、乙酸乙酯、三氯甲烷、石油醚、正丁醇等均为分析纯,购自天津富宇精细化工有限公司.
1.1.4 仪 器
Bruker Advance 600型核磁共振波谱仪(Bruker公司),API4000 型 质 谱 仪 (Applied Biosystems公司),凝胶柱Sephadex LH-20(GE Healthcare公司),反相硅胶Silica gel 60RP-18(Merck公司),柱色谱用硅胶(200~300目)和薄层色谱用硅胶GF254(青岛海洋化工厂).
1.2 方 法
1.2.1 发 酵
从内生链霉菌Streptomyces sp.LC18保种斜面上刮取孢子接种ISP3固体培养基平板上,28℃活化培养5d.从活化的种子板上刮取孢子接种于ISP3发酵平板,每平板约25mL,共发酵10L,28℃倒置培养12d.
1.2.2 提取与分离
收集发酵12d的培养物,将其切成小块,用V(乙酸乙酯)∶V(甲醇)∶V(乙酸)=80∶15∶5混合溶剂浸提3次,提取液减压浓缩至干,然后用等体积的石油醚和甲醇(加5%的水)萃取3次.甲醇萃取液减压浓缩至干,得浸膏4.2g.浸膏用少量甲醇溶解,经凝胶柱(Sephadex LH-20,140g)色谱,甲醇洗脱合并后得到2个组分:Fr.1(1.880 1g)和Fr.2(139.4mg).Fr.1(1.880 1g)经反相中压液相柱 (RP-18,30g)色谱,分别用体积分数30%、40%、50%、60%、100%甲醇洗脱,合并后得到2个组分:Fr.1.a(155.2mg)和Fr.1.b(436.6mg).Fr.1.a(155.2mg)经正相硅胶柱分离,石油醚-乙酸乙酯 (1∶1)洗脱,得到化合物2(56.2mg).Fr.1.b(436.6mg)经正相硅胶柱分离,石油醚-丙酮 (5∶1)洗脱,得到化合物1(263.3mg).Fr.2(139.4mg)经反相中压液相柱 (RP-18,30g)色谱,60%甲醇洗脱,得到化合物3(11.9mg).
1.2.3 抗菌和细胞毒活性测定
化合物的抗菌活性检测采用纸片扩散法,以橙色青霉菌 (Penicilium avellaneum,编号 UC-4376)、水稻稻瘟菌 (Magnaporthe grisea,实验室保存)和枯草芽孢杆菌 (Bacillus subtilis,ATCC,编号11060)作为指示菌株,利福霉素为阳性药物,设置3个平行实验取平均值.细胞毒活性采用 MTT法[10],检测化合物对人乳腺癌细胞株 MDA-MB-231、前列腺癌细胞株PC3的抑制作用,阳性对照药物为顺铂.实验设置3个平行,取平均值绘制抑制曲线,计算IC50值.
2 实验结果
2.1 化合物结构解析
通过各种柱层析分离,从10L固体发酵提取物中分离得到3个安莎霉素类化合物,根据核磁共振以及质谱数据鉴定了化合物1~3的结构(图1),分别为herbimycin A (1),herbimycin C (2),hygrocin A derivative 6(3).
化合物1:黄色粉末.ESI-MS m/z:575.4 [M+H]+,597.5[M+Na]+.1H-NMR(600MHz,CDCl3)δ:8.82(1H,s,—NH),2.03(3H,s,H-2a),6.98(1H,m,H-3),6.51(1H,t,J=12Hz,H-4),5.89(1H,m,H-5),4.13(1H,d,J=12Hz,H-6),3.32(3H,s,6-OCH3),5.31(1H,s,H-7),4.52(2H,br.s,7-OCONH2),1.76(3H,br.s,H-8a),5.77(1H,m,H-9),2.65(1H,m,H-10),1.11(3H,d,J=6.0Hz,H-10a),3.40(1H,m,H-11),3.29(3H,s,11-OCH3),3.54(1H,m,H-12),3.26(3H,s,12-OCH3),1.92(2H,m,H-13),1.68(1H,m,H-14),0.82(3H,d,J=6.0Hz,H-14a),4.37(1H,m,H-15),3.35(3H,s,15-OCH3),6.64(1H,m,H-17),7.35(1H,s,H-19).13CNMR(150MHz,CDCl3)δ:168.9(C-1),134.6(C-2),12.5(C-2a),128.1(C-3),125.8(C-4),136.8(C-5),78.2(C-6),55.8(6-OCH3),79.2(C-7),155.7(7-OCONH2),131.5(C-8),14.2(C-8a),130.9(C-9),34.3(C-10),16.5(C-10a),82.3(C-11),58.5(11-OCH3),83.7(C-12),57.8(12-OCH3),33.8(C-13),36.4(C-14),13.5(C-14a),78.7(C-15),59.7(15-OCH3),144.7(C-16),132.7(C-17),187.7(C-18),113.2(C-19),138.3(C-20),184.1(C-21).上述数据与文献[11]报道的化合物herbimycin A一致.
化合物2:淡黄色粉末.ESI-MS m/z:561.1[M+H]+,583.0[M+Na]+.1H-NMR(600MHz,CDCl3)δ:8.59(1H,s,—NH),2.05(3H,s,H-2a),6.96(1H,m,H-3),6.59(1H,t,J=12.0Hz,H-4),5.88(1H,t,J=6.0Hz,H-5),4.35(1H,d,J=12.0Hz,H-6),3.35(3H,s,6-OCH3),5.28(1H,s,H-7),4.93(2H,br s,7-OCONH2),1.80(3H,s,H-8a),5.82(1H,m,H-9),2.79(1H,m,H-10),1.04(3H,d,J=6.0Hz,H-10a),3.46(1H,m,H-11),3.57(1H,m,H-12),3.30(3H,s,12-OCH3),1.94(2H,m,H-13),1.70(1H,m,H-14),0.88(3H,d,J=6.0Hz,H-14a),4.37(1H,m,H-15),3.38(3H,s,15-OCH3),6.64(1H,s,H-17),7.50(1H,d,J=6.0Hz,H-19).上述数据与文献[12]报道的化合物herbimycin C一致.
化合物3:墨绿色粉末.ESI-MS m/z:510.5[M+H]+,532.4 [M + Na]+.1H-NMR (600MHz,CD3OD)δ:3.87(1H,d,J=15.5Hz,H-2),6.47(1H,d,J=9.6Hz,H-3),2.21(3H,s,H-4a),4.81(1H,m,H-6),0.97(3H,d,J=6.4Hz,H-6a),3.98(1H,s,H-7),4.24(1H,d,J=10.8Hz,H-8),5.23(1H,ddd,J=2.0,9.7,15.5Hz,H-9),1.54(1H,m,H-10),1.76(1H,m,H-10a),1.08(1H,m,H-10a),0.74(3H,t,J=7.3Hz,H-10b),1.35(2H,m,H-11),2.66(1H,m,H-12),2.50(1H,m,H-12),2.31(3H,s,H-16a),7.56(1H,s,H-17),5.82(1H,s,H-21).13C-NMR(150MHz,CD3OD)δ:175.5(C-1),54.5(C-2),131.3(C-3),33.9(C-4),20.1(C-4a),167.0(C-5),74.7(C-6),12.3(C-6a),70.4(C-7),126.6(C-8),136.3(C-9),42.7(C-10),28.2(C-10a),11.3(C-10b),33.5(C-11),41.3(C-12),210.6(C-13),127.1(C-14),151.7(C-15),131.7(C-16),15.6(C-16a),129.0(C-17),132.9(C-18),72.3(C-19),163.0(C-20),102.1(C-21),184.0(C-22),127.9(C-23).上述数据与文献[13]报道的化合物hygrocin A derivative 6一致.
2.2 化合物的抗菌和细胞毒活性
用纸片扩散法测定安莎霉素类化合物1~3(载药量均为50μg)的抑菌活性(图2).化合物1和2对橙色青霉菌抑菌圈直径分别为(30.66±1.53)和(9.33±1.15)mm,对枯草芽孢杆菌抑菌圈直径分别为(7.67±0.58)和(11.67±0.58)mm;化合物1对水稻稻瘟菌抑菌圈直径为(11.67±1.53)mm;化合物3对供试菌株没有抑菌活性.
用MTT法检测安莎霉素类化合物对肿瘤细胞株的细胞毒活性,结果显示3个化合物均能抑制肿瘤细胞株的生长,其IC50值见表1.
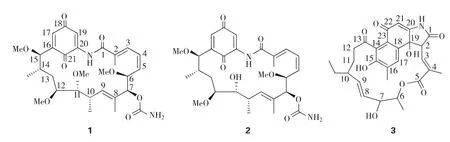
图1 化合物1~3的化学结构Fig.1 The chemical structures of compounds 1-3

图2 安莎霉素类化合物1~3的抗菌活性Fig.2 Antibacterial activity of ansamycin compounds 1-3

表1 安莎霉素类化合物1~3对MDA-MB-231和PC3细胞的增殖抑制Tab.1 Growth-inhibitory effects of ansamycin compounds 1-3 on MDA-MB-231and PC3cells
3 讨 论
微生物次级代谢产物是药物开发的重要来源,经过长期和广泛的研究,从土壤微生物中发现新的天然产物日益困难,研究学者们逐步将注意力转向特殊生境的微生 物[14].Strobel等[15]从 短 叶 红 豆 杉 (Taxus brevifolia)中分离得到一株产紫杉醇的内生真菌Taxomyces andreana,证明内生菌具有合成宿主代谢产物的能力,开辟了从内生菌中发现活性代谢产物药物的新途径.基于“内生菌与宿主植物在长期系统演化中形成了互惠共生关系,在协同进化中发生基因水平转移,产生与宿主相似或相同的生物活性物质”的假说,植物内生菌及其产生活性成分的研究受到广泛关注[16].
本文从红树林植物来源内生菌Streptomyces sp.LC18中分离得到2种类型3个安莎霉素类化合物,其中herbimycin A(1)和herbimycin C(2)为8酮苯安莎霉素,最初是从土壤吸水链霉菌(Streptomyces hygroscopicus)中分离得到,能选择性杀死双子叶植物,具有除草活性[11-12].化合物3为9酮萘安莎霉素,也是从吸水链霉菌中分离得到的安莎化合物[13].化合物1~3虽然均为已知化合物,但这是从植物内生菌中分离得到的2种类型的安莎霉素,表明植物内生菌也是发现安莎霉素的重要来源,具有产生多种类型安莎化合物的丰富性.生物活性测定显示,化合物1对细菌和真菌均具有较好的抑菌活性,对前列腺癌PC3细胞株IC50小于1μmol/L,具有显著的细胞毒活性.文献[17]报道,化合物1可以结合Hsp90,是酪氨酸激酶的选择性抑制剂,其细胞毒活性可能与此相关.化合物2在抑菌和细胞毒活性上较弱,可能与其结构中C-11位甲氧基被羟基取代有关,降低了生物活性,与文献[12]中结果一致.化合物3对供试菌株没有抑菌活性,但能显著地抑制肿瘤细胞的生长,对人乳腺癌MDA-MB-231细胞和前列腺癌PC3细胞IC50值分别是0.5和1.9μmol/L,其作用机制尚不清楚,可能是潜在的新型抗肿瘤药物,值得进一步深入研究.
[1]Lounis N,Roscigno G.In vitro and in vivo activities of new rifamycin derivatives against mycobacterial infections[J].Curr Pharm Des,2004,10(26):3229-3238.
[2]Campbell E A,Korzheva N,Mustaev A,et al.Structural mechanism for rifampicin inhibition of bacterial RNA polymerase[J].Cell,2001,104(6):901-912.
[3]Ikeda H,Hideshima T,Fulciniti M,et al.The monoclonal antibody nBT062conjugated to cytotoxic maytansinoids has selective cytotoxicity against CD138-positive multiple myeloma cells in vitro and in vivo[J].Clin Cancer Res,2009,15(12):4028-4037.
[4]Cassady J M,Chan K K,Floss H G,et al.Recent developments in the maytansinoid antitumor agents[J].Chem Pharm Bull(Tokyo),2004,52(1):1-26.
[5]Franke J,Eichner S,Zeilinger C,et al.Targeting heatshock-protein 90 (Hsp90)by natural products:geldanamycin,a show case in cancer therapy[J].Nat Prod Rep,2013,30(10):1299-1323.
[6]August P R,Tang L,Yoon Y J,et al.Biosynthesis of the ansamycin antibiotic rifamycin:deductions from the molecular analysis of the rif biosynthetic gene cluster of Amycolatopsis mediterranei S699[J].Chem Biol,1998,5(2):69-79.
[7]Wang H X,Chen Y Y,Ge L,et al.PCR screening reveals considerable unexploited biosynthetic potential of ansamycins and a mysterious family of AHBA-containing natural products in actinomycetes[J].J Appl Microbiol,2013,115(1):77-85.
[8]Yu T W,Bai L,Clade D,et al.The biosynthetic gene cluster of the maytansinoid antitumor agent ansamitocin from Actinosynnema pretiosum[J].Proc Natl Acad Sci USA,2002,99(12):7968-7973.
[9]Hong K,Gao A H,Xie Q Y,et al.Actinomycetes for marine drug discovery isolated from mangrove soils and plants in China[J].Mar Drugs,2009,7(1):24-44.
[10]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1/2):55-63.
[11]Omura S,Iwai Y,Takahashi Y,et al.Herbimycin,a new antibiotic produced by a strain of Streptomyces[J].J Antibiot(Tokyo),1979,32(4):255-261.
[12]Shibata K,Satsumabayashi S,Nakagawa A,et al.The structure and cytocidal activity of herbimycin C[J].J Antibiot(Tokyo),1986,39(11):1630-1633.
[13]Cai P,Kong F,Ruppen M E,et al.Hygrocins A and B,naphthoquinone macrolides from Streptomyces hygroscopicus[J].J Nat Prod,2005,68(12):1736-1742.
[14]Tiwari K,Gupta R K.Rare actinomycetes:apotential storehouse for novel antibiotics[J].Crit Rev Biotechnol,2012,32(2):108-132.
[15]Stierle A,Strobel G,Stierle D.Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260(5105):214-216.
[16]Li Y,Shen Y.Chemical components of some microorganisms isolated from specific habitats and their antitumor activities[J].Chin J Org Chem,2013,33(6):1135-1143.
[17]Sakagami M,Morrison P,Welch W J.Benzoquinoid ansamycins (herbimycin A and geldanamycin)interfere with the maturation of growth factor receptor tyrosine kinases[J].Cell Stress Chaperones,1999,4(1):19-28.
