慢性软组织损害性疼痛外周不同组织中TNF-α表达的研究
2014-11-29董宏然李启芳杨彬奎吴华山王全美
董宏然,李启芳,杨彬奎,吴华山,王全美
(1.南京总医院汤山分院骨科,江苏 南京 211131;2.上海第九人民医院疼痛科,上海200011)
临床上腰臀部软组织损害和腰椎间盘突出症都可以引起类似的腰腿麻痛等症状,但其发病机制不同,腰椎间盘突出引起的疼痛除了传统的神经机械压迫外,还包括炎症机制和免疫机制,而软组织损害性疼痛的病灶部位是筋膜、肌肉、韧带、关节囊等周围软组织,其病理基础是软组织损害引起的无菌性炎症病变[1],但无菌性炎症的本质尚不清楚。近年来,细胞因子在慢性疼痛中作用越来越受到重视。内源性肿瘤坏死因子(TNF-α)是一种重要的致炎因子,它不仅在作为免疫系统的重要因子参与机体的免疫反应,还在病理情况下由外周或中枢神经系统产生[2],在慢性疼痛的发生发展中起着重要的作用。本研究以慢性软组织损害性腰腿痛和腰椎间盘突出症手术病人为研究对象,分别切取外周组织中三个不同部位的软组织标本,检测其TNF-α的表达,以探讨软组织损害性疼痛可能的作用机制。
1 资料与方法
1.1 一般资料
选择2010-01-2013-12我院行手术治疗的腰臀部软组织损害性疼痛患者18例为实验组,男16例,女2例,平均年龄39.2岁,临床表现为腰痛、臀部疼痛及下肢麻痛等症状;以手术治疗的腰椎间盘突出症患者16例为对照组,男5例,女11例,平均年龄51.1岁,临床主要表现为腰腿痛、下肢平均麻木、行走困难等,其中腰4-5椎间盘突出5例、腰5骶1椎间盘突出5例、腰4-5腰5骶1椎间盘突出5例、腰3-骶1椎间盘突出1例。所有病例术前均常规行腰椎X线、CT及MRI检查及相关血生化检查,诊断明确。在手术中分别切取两组病人脊柱后关节骨表面(部位1)、肌肉(部位2)、腰部深筋膜(部位3)软组织标本,-80℃深低温冰箱保存。全部患者在术前均签署知情同意书。
1.2 实验材料和实验仪器
RDHumanSubstanceP(SP)Elisa测定试剂盒,Lot:201401,Exp:201406。LabsystemsFinnpipette 100μl单道移液器,Thermo50μl8道移液器。HH-4数显恒温水浴锅(国华电器有限公司),华东电子DG5033A酶标仪(南京华东电子集团医疗装备有限责任公司)。
1.3 操作步骤
1.3.1 本前处理:取样本40μl待测。
1.3.2 测定过程:严格按照试剂盒的说明进行操作(1)测定前将试剂盒放置室温40min,所有试剂在使用前都轻轻摇匀;(2)标准品的稀释与加样:取5个离心管分别标记为S1、S2、S3、S4、S5,然后用标准品稀释液把1280ng/L的标准品原液稀释成40、80、160、320、640ng/L的不同浓度的标准品应用液;(3)加样:分别设定空白孔(空白对照孔不加样本、生物素标记的抗-SP抗体及链霉亲和素-HRP,其余各步操作相同)、待测样品孔、标准孔。待测样品孔加入样本40μl,然后各加入抗-SP抗体10μl,链酶亲和素-HRP50μl,标准品孔加入不同浓度的标准品50μl,链霉亲和素-HRP50μl(标准品中已事先整合好生物素抗体,故不加);加样时将样本加于酶标板底部,尽量不触及孔壁,轻轻晃动混匀。盖上封板膜后,37℃温育60min;(4)配液:浓缩洗涤液与新鲜的医用双蒸水1∶30倍稀释,混匀后室温放置待用;(5)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,在吸水纸上将酶标板拍干;(6)显色:每孔先加入显色剂A 50μl,再加入显色剂B50μl,轻轻震荡混匀,然后37℃避光反应10min,(7)终止:每孔加终止剂50μl,终止反应(此时蓝色立即转黄);(8)测定:在华东电子DG5033A酶标仪上,450nm处测定OD;(9)计算:根据制备的标准曲线,计算样本含量;(P>0.05)。
1.4 统计学方法
应用Graphpad统计分析软件,两组以上采用单因素方差分析对数据进行统计分析,组间比较采用Bonferroni法比较,两组间比较采用t检验。数据以均数±标准差表示。
2 结果
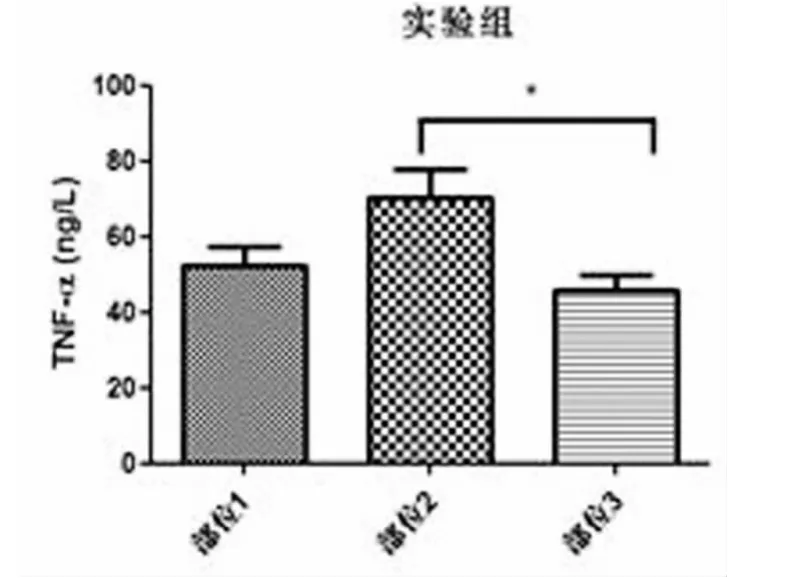
图1 实验者三个部位中TNF-α的表达以肌肉组织中最高,与其他部位TNF-α的表达相比有统计学差异(P<0.05)。
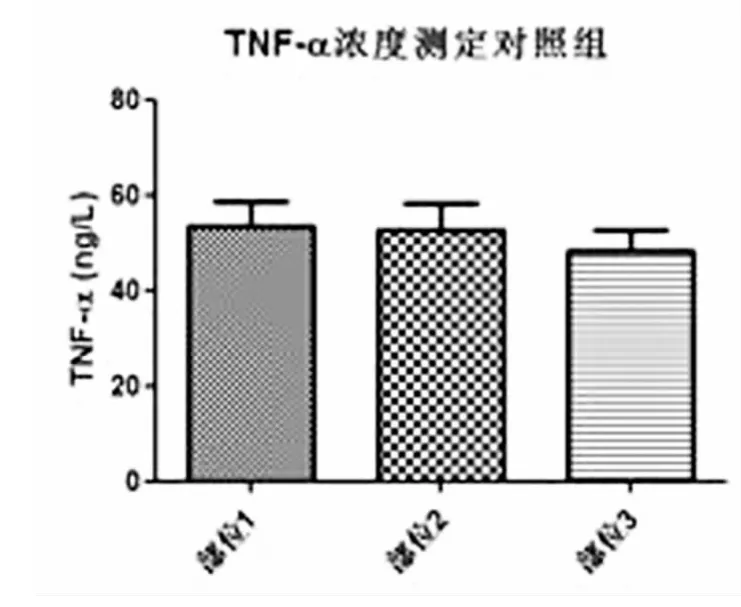
图2 对照组各组织中TNF-α表达相比无统计学差异。
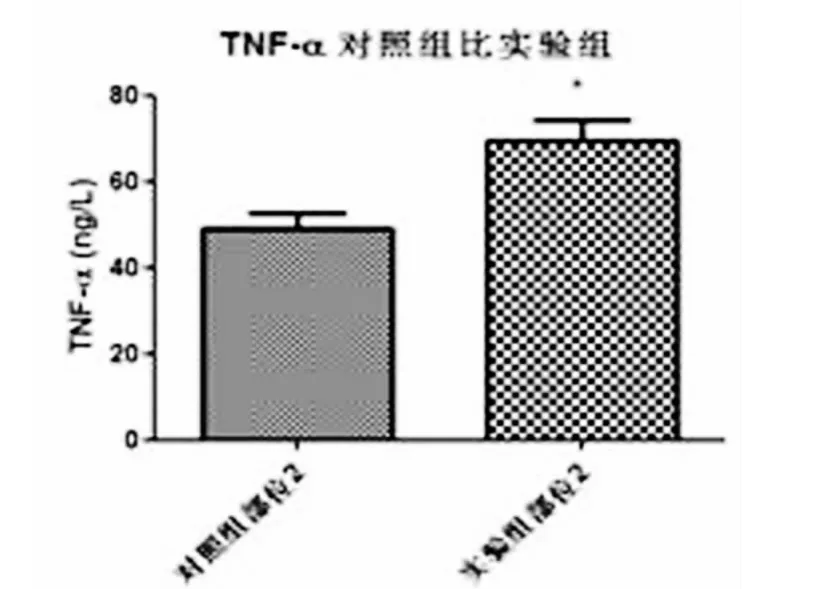
图3 实验组与对照组肌肉组织中TNF-α的表达相比有统计学差异(P<0.05)。
3 讨论
软组织损害性疼痛是临床常见病、多发病,宣蛰人[1]对其病因、发病机制、诊断及治疗等方面做了系统的研究,运用软组织压痛点强刺激推拿、密集型银质针、软组织松解手术等手段针对慢性软组织损害性疼痛病灶进行治疗,取得了优良的临床治愈显效率。董宏然等[3]对椎管外重度软组织损害性疼痛患者采用针对软组织病灶的松解手术治疗,平均随访5年8个月,优良率达95%。急性损伤后遗或慢性劳损等原因引起运动系统软组织损害,筋膜、肌肉、韧带、关节囊等软组织出现无菌性炎症病变,引起疼痛及其他相关征象,但无菌性炎症的本职仍不清楚。近年来,细胞因子在慢性疼痛中的作用越来越受到重视,TNF-α的作用尤其引起人们的重视[4],被认为是一种神经调节剂,相关机制的阐明为临床疼痛的治疗提供了新的依据。但以临床上腰腿痛病人为研究对象,检查其外周不同组织中TNF-α的表达,尚未见相关报道。本研究以临床中腰臀部软组织损害性腰腿痛病人为实验对象,以腰椎间盘突出症病人为对照组,能更真实地反应不同致痛机理下两组病人的实际病理状况,通过检测两组病人外周不同软组织中TNFα的表达水平,进一步探讨其可能的作用机制。
TNF-α是由单核-巨噬细胞产生的一种多肽细胞因子,具有广泛的生物学活性,是参与多种生理和免疫反应过程的重要介质,同其它细胞因子共同参与维持内环境稳定等生理过程,同时介导感染、创伤及免疫应答反应。研究表明,TNF-α能促进炎症细胞释放炎症介质,增强中性粒细胞及单核细胞的粘附作用,诱导其它细胞因子(如IL-1、IL-6等)的产生,加重炎症反应,并参与疼痛的发生、发展和转归。朱干等[5]发现,TNF-α可直接对神经、血管组织产生影响,也可以刺激其他细胞产生致病物质,还能作用于炎性细胞和局部神经组织的鞘细胞,导致更多的TNF-α的生成。内源性的TNF-α在神经源性疼痛的发生、发展中也有着重要的作用,而且主要是通过与其受体TNF-RⅠ结合后发挥作用。已知TNF-α的两种受体P55(TNF-RⅠ)和P75(TNF-RⅡ),在神经元和胶质细胞上皆有表达,并且与TNF-α有较好的亲和力,发挥不同的生理学作用[6]。TNF-α可以诱导神经根髓鞘损伤、轴突变性,又可以引起神经传导功能障碍,痛觉变得更加敏感。高峰等[7]的研究认为,外周的伤害性信息传入可以增加脊髓背角TNF-α的释放,并通过激活TNFR上调NR1亚基的磷酸化,从而引起机体慢性疼痛的发生和发展。
本研究发现TNF-α在临床两组病人的不同外周组织中均有表达,但慢性软组织损害性疼痛病人外周三个不同部位软组织中TNF-α的表达以肌肉组织中明显增高,与对照组相比有显著差异,而对照组三个部位软组织中TNF-α的表达无统计学差异,说明TNF-α在软组织损害引起的疼痛中可能起着重要的作用,具体的机制尚需要进一步研究;实验组病例肌肉组织中TNF-α表达水平最高,且与另两部位相比有显著差异,提示肌肉组织是软组织损害性疼痛的主要病灶部位,也是针对软组织疼痛病灶进行治疗时的重点部位。
[1] 宣蛰人.宣蛰人软组织外科学[M].上海:文汇出版社,2002.11-25.
[2] Collins M,Bartelt RR,Houtman JC. T cell receptor activation leads to two distinct phases of pyk2 activation and actin cytoskeletal rearrangement in human T cells[J]. Mol Immunol,2010,47(9):1665-1674.
[3] 董宏然,王全美.椎管外软组织松解手术治疗慢性软组织疼痛100例远期疗效分析[J].中国疼痛医学杂志,2011,17:322-324.
[4] Baron R,Peripheral neuropathic pain:from mechanisms to symptoms[J]. Clin J Pain,2000,16(2)S12-20.
[5]朱干,张盛强,黄彪,等.腰椎间盘突出症患者疼痛程度与TNF水平相关性研究[J].北京中医药大学学报,2010,17(4):8-9.
[6]Boka G,Angade P,Wallach D,et al. Immunocytochemical analysis of tumor necrosis factor and its receptors in Parkinson,sdisease[J]. Neurosci Lett,1994,172:151-154.
[7]高峰,赵欣,史瑞红,等.TNF-α在脊髓背角参与慢性疼痛机制的研究[J].中国医疗前沿,2011,5(6):15-16.
