熔盐电解制备铝锂合金中阳极过程动力学参数的分析与计算
2014-11-28李继东张保国张明杰张廷安
李继东,张保国,张明杰,张廷安
(1.辽宁科技大学 材料与冶金学院,辽宁 鞍山 114051;2.东北大学 材料与冶金学院,沈阳 110819)
金属锂是自然界中最轻的金属,铝锂合金作为一种低密度、高弹性模量、高强度和高比刚度的理想结构材料而广泛应用于航空航天及国防太空等领域[1~4].通常锂电解是采用氯化物作为电解质体系,如能以Li2CO3为原料代替LiCl电解将极大地降低槽电压和生产成本.作者曾以LiCl-LiF为电解质体系,以铝液做阴极直接制备了铝锂合金,采用纯锂盐体系保证了合金纯度和电流效率,取得了较好的研究成果[5].铝工业中对氧化物的放电机理和电极反应过程的研究已相当深入[6,7],但在锂电解中由于碳酸盐的放电机理比较复杂,对 Li2CO3的电化学研究报道较少[8,9].本文通过连续脉冲-计算机法测量阳极过电压,研究电解过程中的极化曲线变化,根据电极过程动力学理论重点研究CO2-3在阳极上的放电机理及反应速度控制步骤,并分析计算阳极相关动力学参数,这对促进Li2CO3的分解,加快电解反应速率,提高锂电解的电流效率具有一定的理论指导意义.
1 实验
实验中采用的电解槽如图1所示.

图1 电解槽简图Fig.1 Configuration of electrolytic cell
实验中所用电解槽由带有刚玉内衬的石墨坩埚(φ=60 mm)盛装120g电解质,在刚玉内衬下部有一个小孔,在实验前加入纯铝40 g,之所以铝的加入量比较大,是因为这样使得熔化的铝液可以铺满刚玉内衬下部的小孔.反电动势值的大小采用连续脉冲示波器法[10]测量电解过程中的实际分解电压.本实验中测得的反电动势值,即阳极与阴极之间的电动势与测得的过电压值.

由于尽量增加了阴极面积,降低阴极电流密度,从而使阴极过电压变得很小,与阳极相比,阴极过电压可以忽略.本文直接测量的反电动势即代表阳极与参比电极之间的电位,则
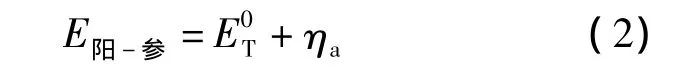
其中,E阳-参为研究电极与参比电极之间的电位.
阳极采用φ=10 mm的光谱纯石墨棒,外有刚玉管保护.石墨坩埚外有钢套保护并兼做导体.在整个实验过程中,由石墨坩埚上方通入干燥的氩气.
2 结果与讨论
2.1 电解氯化物体系的极化曲线
680℃ 下,在 0.1至 0.8 A·cm-2范围内以0.1 A·cm-2依次递增电解 LiCl-LiF-KF体系,由式(2)可知,测量不同电流密度下的E阳-参值,减去E0T后求得阳极过电压大小,将电流密度的对数与对应的过电压关系绘制成图2.

图2 阳极电流密度的对数与过电压的关系(LiCl-LiF-KF体系)Fig.2 Relationship between logarithms of current density and anode over voltage(LiCl-LiF-KF system)
从图2可以看出,随着通过电极的电流密度逐渐增加,电流密度在0.1~0.3 A·cm-2范围内,过电压处于Tafel区,此时过电压与电流密度的对数成直线关系,通过最小二乘法拟合得到直线方程为:

即此时电极反应受电化学极化控制.
对于阳极反应处于电化学极化控制下满足Tafel方程[10]:

式中,α为阳极反应的传递系数,n为反应电荷数,i0为交换电流密度(A/cm-2),iα为阳极电流密度(A/cm-2),R为摩尔气体常数(8.314 J·K-1·mol-1),F 为法拉第常数,T 为电解温度(K),ηα为阳极过电压,其他符号同上.
所以,
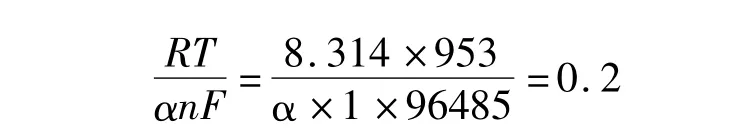
则α=0.41

则 i0=0.35A·cm-2.
由于氯化物电解的电化学反应中,由电解质中扩散到阳极电极表面来的阴离子直接参加电化学步骤,即直接失去电子,且只通过这一步骤就可以得到最终的反应产物.
随着电流密度的进一步增大,超出了电化学极化控制的Tafel区(i>0.3A·cm-2),电极反应控制逐渐由电化学极化和浓差极化联合控制过渡到浓差极化控制区,直至达到临界电流密度.
2.2 电解氧化物体系的极化曲线
680℃下电解LiCl-LiF-KF-Li2CO3体系,与上述计算阳极过电压的过程相同,测量不同电流密度下的E阳-参值并减去后求得过电压大小,将电流密度的对数与对应的过电压关系绘制成图3.

图3 阳极电流密度的对数与过电压的关系(LiCl-LiF-KF-Li2CO3体系)Fig.3 Relationship between current density logarithm and overvoltage(LiCl-LiF-KF-Li2CO3system)
从图3中可以看出,随着通过电极的电流密度逐渐增加,电流密度在0.1~0.4 A·cm-2范围内,过电压处于Tafel区,此时过电压与电流密度的对数成直线关系,通过最小二乘法拟合得到直线方程为:

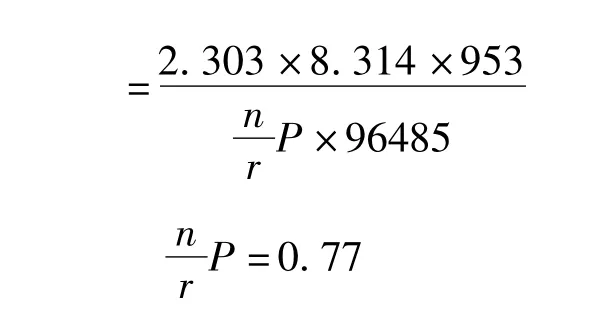
式中,n为电子得失数,r是化学计量数,P为反应级数.由电极反应可知,

所以,


氧化物以O*(配合的)2-的形式溶解在电解质体系中,由电极过程动力学的理论[11,12]得知,两个含氧的配合离子在电极表面的同一处同时进行放电的机会是非常小的.因此,电解槽炭阳极上的一次电解产物似乎应该是CO气体.但是实际上的产物不是CO而是CO2,由此可以判断,炭阳极上最初的电解产物只可能是碳与氧的配合物C*O,然后C*O按某种方式脱附生成CO2.由于CO2分子的价键已处于完全的饱和,且电解反应又是在高温下进行,故可以不考虑CO2在电极表面上的吸附.这样,在炭阳极上出现的电化学反应步骤主要有以下几步:

按照电极过程动力学的理论,上述任何一个反应步骤如果是阳极反应的控制步骤,都具有相同的半对数曲线形式.
假定反应I是整个阳极反应最慢的,则以电流形式表示的电极反应速率为:


此乃塔费尔方程式,其斜率为

取α=0.56,上式等于:

这个结果与实验值拟合的直线方程(5)式的斜率值接近,即反应式I为过程的控制步骤时才接近实验值0.25,而经验证明[6],当Ⅱ或Ⅲ为控制步骤时推导出来的塔费尔方程式的斜率甚小,与根据实验所计算出来的数值相差甚大.由此判断,在整个阳极反应的过程中,决定整个电极反应速率的是炭阳极上配合氧离子的缓慢放电.
随着电流密度的进一步增大,超过了电化学极化控制的 Tafel区(i>0.4 A·cm-2),电极反应控制逐渐由化学极化和浓差极化联合控制过渡到浓差极化控制区.
3 结论
(1)680℃下测量电解LiCl-LiF-KF体系的极化曲线得知,随着通过电极的阳极电流密度逐渐增加,电流密度在0.1~0.3 A·cm-2范围内,过电压处于Tafel区,最小二乘法拟合得到直线方程为:η=0.21+0.2lgi,即此时电极反应受电化学极化控制,求得交换电流密度为0.35 A·cm-2.(2)680℃下测量电解 LiCl-LiF-KFLi2CO3体系的极化曲线得知,随着通过电极的阳极电流密度逐渐增加,电流密度在0.1~0.4 A·cm-2范围内,过电压进入 Tafel区,通过最小二乘法拟合得到直线方程为:η=0.56+0.25lgi,即此时电极反应受电化学极化控制,求得交换电流密度为0.005 25 A·cm-2.根据电极过程动力学的理论计算判断得知,在整个阳极反应的历程中,整个电极反应速率的是由炭阳极上配合氧离子的缓慢放电引起的电化学控制步骤决定的.
[1]程晓宇,王晓梅.铝锂合金研究与发展[J].中国有色金属,2008,11(12):72-73.
(Cheng Xiaoyu,Wang Xiaomei.Study and development of Al- Li alloys[J].The Chinese Journal of Nonferrous Metals,2008,11(12):72 -73.)
[2]周昌荣,潘青林,朱朝明,等.新型铝锂合金的研究和发展[J].材料导报,2004,18(5):30.
(Zhou Changrong, Pan Qinglin, Zhu Chaoming, et al.Development and study of new types aluminum-lithium alloys[J].Material Review,2004,18(5):30.)
[3] Gupta R K,Niraj N and Nagasireesha.G,et al.Development and characterization of Al- Li alloys[J].Materials Science&Engineering A,2006,420(2):228-234.
[4]Fridlyander I N.Current-technology aluminum alloys for aerospace applications[J].Metal Science and Heat Treatment,2001,7(7):7 -8.
[5]李继东,张明杰,张廷安,等.熔盐电解法制备铝锂中间合金[J].中国有色金属学报,2008,18(8):1555-1559.
(Li Jidong,Zhang Mingjie,Zhang Tingan et al.Preparation of Al- Li master alloys by molten salt electrolysis[J].The Chinese Journal of Nonferrous Metals,2008,18(8):1555-1559.)
[6]冯乃祥,邱竹贤.铝电解槽反电动势和阳极过程动力学参数的分析和计算[J].1983,35(4):49-51.
(Feng Naixian,Qiu Zhuxian.Analysis and calculation of back EMF and anodic kinetics parameters in aluminium electrolysis cells[J].Nonferrous metals,1983,35(4):49 - 51.)
[7] Griotheim K,Kvande H,Li Qingfeng,et al.Metal production by molten salt electrolysis[M].Beijing:China University of Mining and Technology Press,1998:112 -113.
[8] Sato Y,Saito S,Araike E,et al.Electrode behavior for the electrolytic production of Al-Li alloy by using molten chlorides[J].Journal of Japan Institute of Light Metals,1993,43(1):33-39.
[9] Sato Yuzum,Kariya Hrioshi,Suzuki Takeshi,et al.High efficient electrolytic production of Al-Li alloy by using Li2CO3as a source of lithium[J].Journal of Japan Institute of Light Metals,1998,48(3):138 -142.
[10]张明杰,王兆文.熔盐电化学原理与应用[M].北京:化学工业出版社,2006:162-163.
(Zhang Mingjie,Wang Zhaowen.Principle and application of electrochemistry of fused salts[M].Beijing:Chemical Industry Press,2006:162 -163.)
[11]蒋汉赢.冶金电化学[M].北京:冶金工业出版社,1983:110.
(Jiang Hanying.Metellurgical electrochemistry[M].Beijing:Metallurgical Industry Press,1983:110.)
[12]查全性.电极过程动力学导论[M].北京:冶金工业出版社,2003:72 -78.
(Cha Quanxing.Kinetics of electrode process[M].Beijing:Science Press,2003:72 -78.)
