紫花前胡苷抑制哮喘小鼠气道炎性反应和NF-κB信号传导通路
2014-11-27熊友谊时维静张孝林
熊友谊,时维静,俞 浩,张孝林
(安徽科技学院 食品药品学院, 安徽 凤阳 233100)
研究论文
紫花前胡苷抑制哮喘小鼠气道炎性反应和NF-κB信号传导通路
熊友谊*,时维静,俞 浩,张孝林
(安徽科技学院 食品药品学院, 安徽 凤阳 233100)
目的观察紫花前胡苷抗过敏性哮喘鼠气道炎性反应作用。方法BALB/c小鼠被随机分为对照、模型、紫花前胡苷和地塞米松4组。除对照组外,所有小鼠腹腔注射和雾化吸入卵清蛋白以致敏和诱导气道炎性反应。于每次雾化前1h,给紫花前胡苷组灌胃10 mg/kg紫花前胡苷;给地塞米松组腹腔注射1 mg/kg地塞米松。动物肺功能仪分析气道高反应性;细胞计数器和Diff-Quick染色计数支气管灌洗液中白细胞总数及分类;酶联免疫吸附法检测血清或BALF中炎性介质的水平;苏木精-伊红染色法观察气道病理改变;电泳迁移率和免疫印迹法检测肺组织NF-κВ信号通路中蛋白的活力和表达。结果与对照组比较,模型组呈现明显的气道炎性反应,气道反应性显著增高 (Plt;0.05);血清或BALF中IgE、IL-4、IL-5和IL-13的水平显著增加 (Plt;0.01);细胞系P65、p-P65的水平显著增加(Plt;0.05);细胞质P65和IκBα显著减少,NF-κB DNA-结合力显著增加 (Plt;0.05)。与模型组比较,紫花前胡苷能够显著抑制气道炎性反应和气道高反应 (Plt;0.05);降低血清或BALF中IgE、IL-4、IL-5和IL-13的水平(Plt;0.01);抑制细胞系P65、p-P65水平(Plt;0.05);增加细胞质P65、IκBα蛋白和减弱NF-κB DNA-结合力(Plt;0.05)。结论紫花前胡苷具有抗过敏性哮喘鼠气道炎性反应。
紫花前胡苷;紫花前胡;哮喘;核因子κB
哮喘是一种以嗜酸性粒细胞为主的多种炎性细胞浸润的慢性气道炎性反应。主要病理生理改变为气道高反应、黏液分泌增多和间歇性气道阻塞[1]。哮喘是临床常见病多发病,尚无有效的根治方法[2]。紫花前胡苷是一种具有代表性的线性四氢呋喃型香豆素苷类化合物,以传统抗哮喘中药紫花前胡中含量高。研究表明紫花前胡苷具有抗炎、抗过敏、抗氧化等多种生物活性[3~5]。考虑到哮喘多属过敏性气道炎性反应,以及紫花前胡抗哮喘的传统功效。本研究以雌性BALB/c小鼠模仿人类的哮喘模型,研究紫花前胡苷的抗哮喘作用,为其新药开发提供理论依据。
1 材料与方法
1.1 动物与试剂
SPF级雌性BALB/c小鼠,6~8周龄,体质量22~25 g[北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)20060009]。Ⅰ级卵白蛋白(OVA) 试剂盒、氯化乙酰胆碱、紫花前胡苷和地塞米松(Sigma公司);IL-4、IL-5和IL-13 ELISA试剂盒(Bender Medsystems公司);抗P65、抗p-P65 (Ser536)、羊抗兔IgG(碧云天生物技术公司);抗IκBα(Cell Signaling公司);EMSA试剂盒(Pierce公司)。
1.2 实验分组与模型
用随机表将小鼠分成对照、模型、紫花前胡苷和地塞米松4组,每组8只。于实验第0、7和14 d,模型、紫花前胡苷和地塞米松组腹腔注射10 μg OVA混悬液(含50 μg氢氧化铝凝胶),自第21 d雾化吸入1% OVA,1次/d,20 min/次,连续5 d;对照组腹腔注射50 μg氢氧化铝凝胶和雾化吸入0.9%氯化钠注射液。于雾化前20 min,紫花前胡苷组灌胃给予10 mg/kg紫花前胡苷(溶剂为0.5% 羧甲基纤维素钠),地塞米松组腹腔注射1 mg/kg地塞米松(Dex),对照组和模型灌胃给予等容的0.5% 羧甲基纤维素钠。
1.3 肺功能检测
小鼠末次雾化24 h后,用60 mg/kg戊巴比妥钠麻醉,行气管插管术,后被置于动物呼吸机检测肺功能。每隔5 min,小鼠尾静脉顺次注射10、30、90和270 μg氯化乙酰胆碱诱导气道高反应,纪录每次注射后1 min的最大气道阻力。具体操作方法按AniRes2005肺功能仪(北京贝兰博科技有限公司)说明书进行。
1.4 白细胞计数和细胞因子检测
小鼠肺功能检测完毕先后被摘球取血和支气管灌洗。灌洗液(BALF)离心上清和血清分别用于IL-4、IL-5、IL-13 和IgE 酶联免疫吸附法测定。BALF离心沉淀用细胞计数器和Diff-Quick染色法计数。
1.5 肺组织病理改变
小鼠左下肺组织经4%中性多聚甲醛溶液固定送至南京医科大学作病理分析。
1.6 Western blot检测p-P65、P65和IκВα蛋白
参照Heijink的实验方法[6],结果以目的蛋白和内参电泳条带的吸光度比值来表示。
1.7 NF-κB DNA结合力
按试剂盒的操作说明逐步进行,结果以目的蛋白与突变探针NF-κB电泳条带的吸光度百分比来表示。
2 结果
2.1 气道高反应实验
与对照组比较,模型组的气道阻力显著增加(Plt;0.05)。与模型组比较,紫花前胡苷组气道阻力显著降低(Plt;0.05) (表1)。
2.2 肺组织病理改变
对照气道上皮平整,黏膜下无炎性细胞浸润,肺泡腔内无渗出。模型组气道气道有大量炎性渗出,气道和血管周围有大量炎性细胞浸润。紫花前胡苷组炎性渗出和炎性细胞浸润减少 (图1)。
2.3 BALF中白细胞总数及分类计数
模型组BALF中白细胞总数、嗜酸性粒细胞和淋巴细胞计数较对照组显著增加(Plt;0.01);紫花前胡苷组较模型组显著回降(Plt;0.05或Plt;0.01) (表2)。
2.4 血清或BALF中炎性介质的水平
模型组IgE、IL-4、IL-5和IL-13较对照组显著增加 (Plt;0.01);紫花前胡苷组较模型组明显降低 (Plt;0.05或Plt;0.01) (表3)。
2.5 肺组织p-P65、P65、Iκβα的表达水平
模型组细胞系P65、p-P65较对照组显著增加(Plt;0.05),紫花前胡苷组较模型组显著回降(Plt;0.05);模型组细胞质P65、Iκβα较对照组显著减少(Plt;0.05), 紫花前胡苷组P65、Iκβα较模型组显著回升(Plt;0.05) (图2)。
表1 紫花前胡苷对氯乙酰胆碱诱导的哮喘鼠气道高反应的作用
#Plt;0.05,##Plt;0.01 compared with control group;*Plt;0.05,**Plt;0.05 compared with model group.
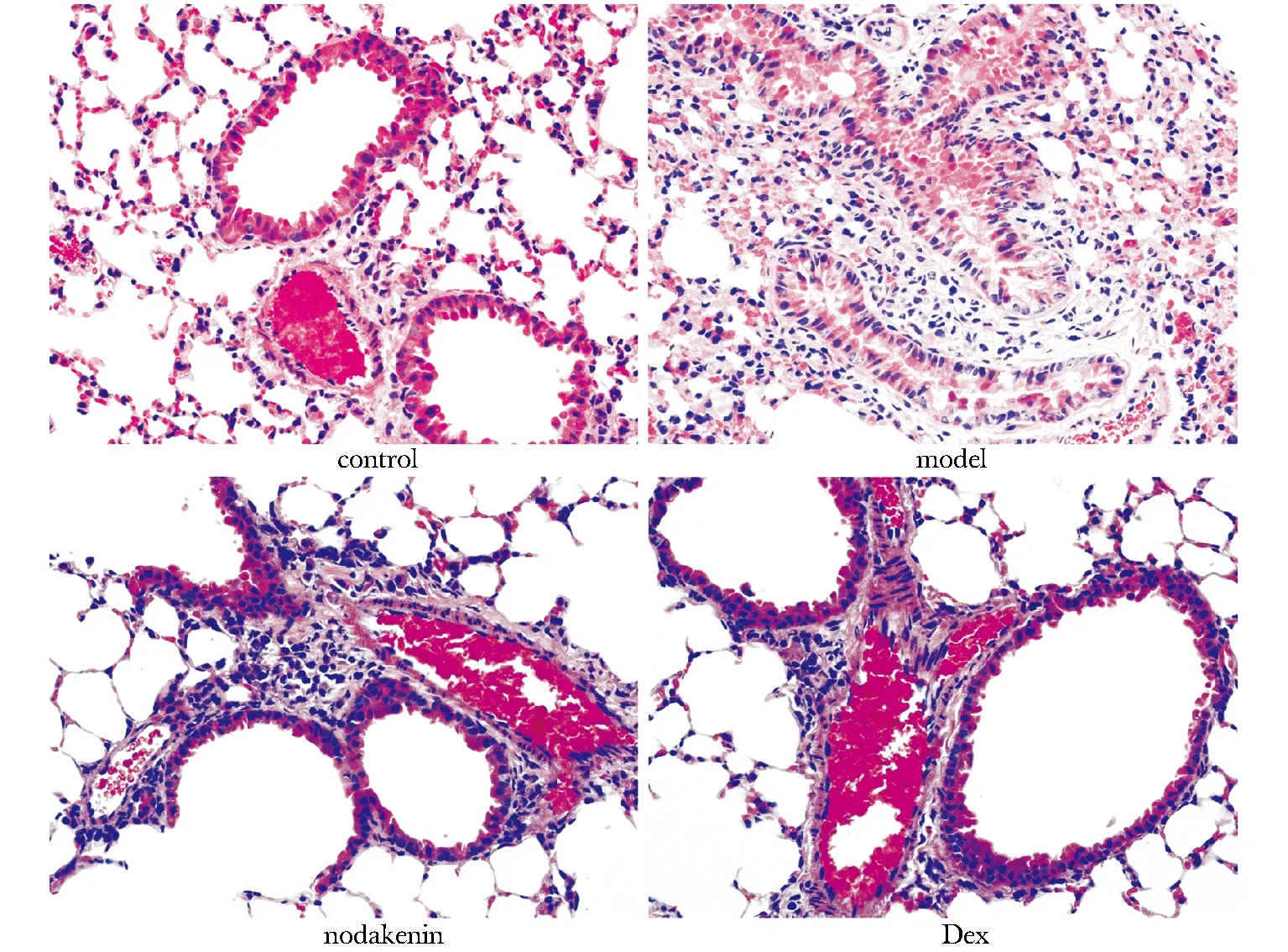
图1 紫花前胡苷对OVA 诱导的哮喘鼠肺组织炎性反应的作用Fig 1 Effects of nodakenin on OVA-induced airway inflammation in asthmatic mice(×400)

grouptotalleukocyteseosinophilslymphocytescontrol10±3.000.3±0.2model72.7±18.2#41.3±10.9#17.6±3.0#nodakenin29.3±7.3*12.8±3.2*5.4±1.3*Dex14.3±3.0*7.9±1.2*2.6±0.2*
#Plt;0.01 compared with control group;*Plt;0.01 compared with model group.
表3 紫花前胡苷对OVA诱导的哮喘鼠血清或BALF中炎性介质的作用
#Plt;0.01 compared with control group;*Plt;0.05,**Plt;0.01 compared with model group.
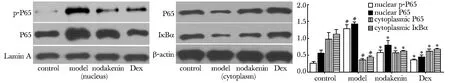
#Plt;0.05 compared with control group; *Plt;0.05 compared with model group 图2 紫花前胡苷对OVA诱导的哮喘鼠肺组织NF-κВ信号传导蛋白的作用Fig 2 Effects of nodakenin on proteins of NF-κВ signaling pathway in asthmatic mice induced by OVA(±s,n=8)
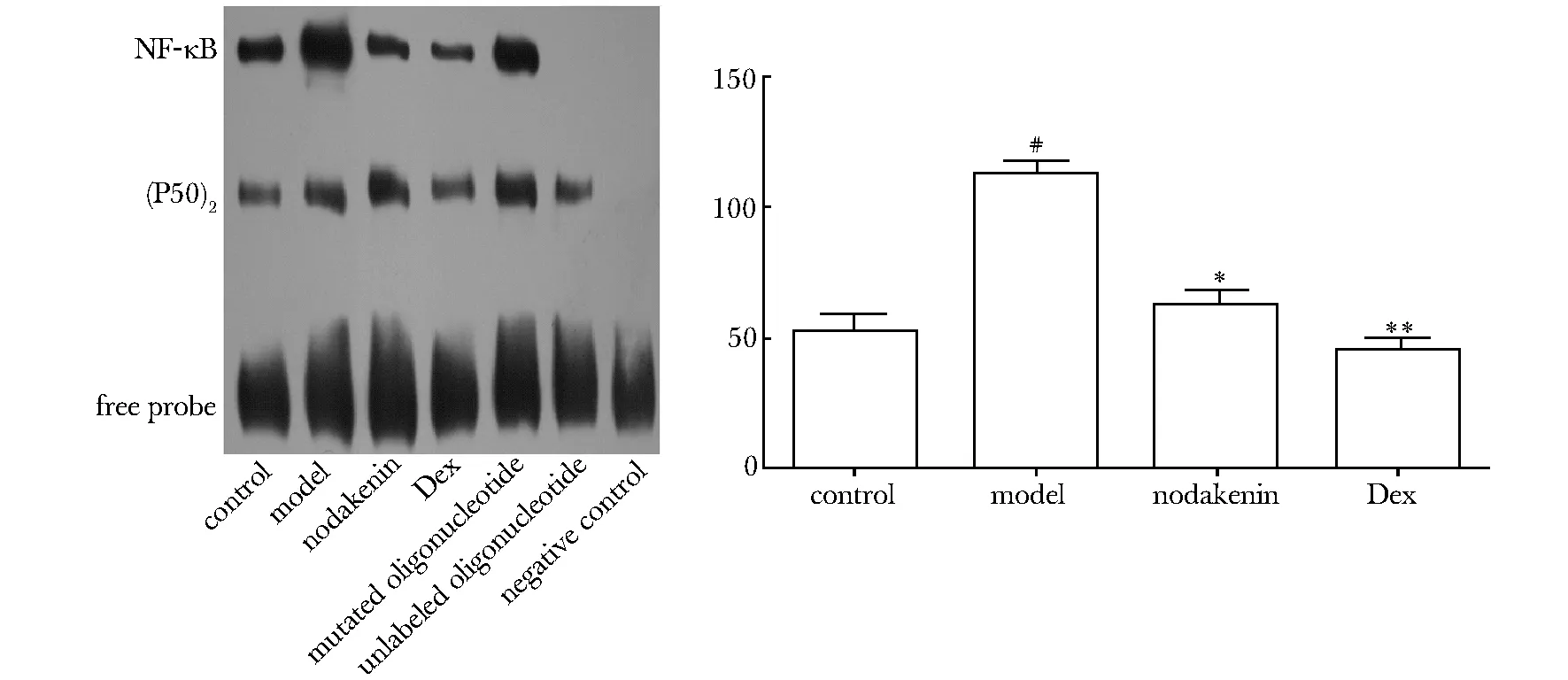
#Plt;0.05 compared with control group; *Plt;0.05; **Plt;0.01 compared with model group图3 紫花前胡苷对OVA诱导的哮喘鼠肺组织NF-κВ-DNA结合力的作用Fig 3 Effects of nodakenin on the NF-κВ-DNA binding activity in asthmatic mice induced by OVA(±s,n=8)
2.6 肺组织NF-κВ-DNA结合力
模型组NF-κВ-DNA结合力较对照组显著增加(Plt;0.05),紫花前胡苷组NF-κВ-DNA结合力较模型组明显降低(Plt;0.05或Plt;0.01) (图3)。
3 讨论
目前中国哮喘病患者约2 500万,随着气候和自然环境的改变,发病率呈现上升趋势[7]。糖皮质激素是抑制哮喘气道炎性反应最有效的药物,但长期使用会导致机体对药物产生耐受性,药效降低,并产生一些严重的不良反应[8]。开发低毒、疗效好的抗哮喘天然药物具有重大意义。本次研究表明紫花前胡苷能显著抑制了哮喘鼠气道炎性反应,减少气道分泌物和气道高反应,具有明显的抗哮喘作用。
Th2优势反应是哮喘发病机制中的关键因素,Th2细胞通过分泌IL-4、IL-5、IL-13等炎性因子在诱导EOS早期分化、活化及向炎性反应区域的募集,高反应性和黏液高分泌的产生过程中发挥重要作用[9-10]。紫花前胡苷具有显著下调BALF中IL-4、IL-5、IL-13 等炎性因子的作用。说明紫花前胡苷抑制哮喘气道炎性反应和高反应与抑制Th2 优势有关,对免疫起调节作用。
另外,NF-κB作为哮喘发生发展过程中促炎信号通路中的转录因子,参与了多种炎性介质的表达,包括对Th2细胞因子[11]。P50/P65二聚体是NF-κB信号通路中重要的信号物质,在细胞的静息状态下,P50/P65被IκB蛋白家族结合滞留于细胞质中而失活。当细胞在受到过敏原等各种刺激下,IκBα发生磷酸化进而被降解,P50/P65被激活进入核内促进致炎性反应物质基因的表达。另外,NF-κB活性受其核内磷酸化化水影响[12]。本研究结果显示,紫花前胡苷能显著抑制P65的核转位和抑制核P65的磷酸化,以及抑制NF-κB P65的DNA结合力,提示是其抗哮喘鼠气道炎性反应和高反应的重要机制。总之,通过本文研究表明紫花前胡苷具有抗哮喘作用,具有很好的研究和开发价值。
[1] Houssen ME, Ragab A, Mesbah A,etal. Natural anti-inflammatory products and leukotriene inhibitors as complementary therapy for bronchial asthma [J]. Clin Biochem, 2010, 43: 887-889.
[2] Anandan C, Nurmatov U, Van Schayck OC,etal. Is the prevalence of asthma declining? Systematic review of epidemiological studies [J]. Allergy, 2010, 65: 152-167.
[3] Kontogiorgis CA, Hadjipavlou-Litina D. Coumarin-based drugs: a patent review (2008—present) [J]. Expert Opin Ther Pat, 2012, 22: 437-454.
[4] Seo CS, Lee MY, Lim HS,etal. Determination of 5-hydroxymethyl-2-furfural, albiflorin, paeoniflorin, liquiritin, ferulic acid, nodakenin, and glycyrrhizin by HPLC-PDA, and evaluation of the cytotoxicity of Palmul-tang, a traditional Korean herbal medicine [J]. Arch Pharm Res Jan, 2012, 35: 101-108.
[5] Lee MY, Shin IS, Jeon WY,etal. Protective effect of Bojungikki-tang, a traditional herbal formula, against alcohol-induced gastric injury in rats [J]. J Ethnopharmacol, 2012, 142: 346-353.
[6] Heijink IH, Marcel KP, Van Oosterhout AJ,etal. Der p, IL-4, and TGF-beta cooperatively induce EGFR-dependent TARC expression in airway epithelium [J]. Am J Resp Cell Mol, 2007, 36: 351-359.
[7] Stocks J, Sonnappa S. Early life influences on the development of chronic obstructive pulmonary disease[J]. Ther Adv Respir Dis, 2013, 7: 161-173.
[8] Buchman AL. Side effects of corticosteroid therapy [J]. J Clin Gastroenterol, 2001. 33: 289-294.
[9] Klein Wolterink RG, Hendriks RW. Type 2 innate lymphocytes in allergic airway inflammation [J]. Curr Allergy Asthma Rep, 2013, 13: 271-280.
[10] Palmqvist C, Wardlaw AJ, Bradding P. Chemokines and their receptors as potential targets for the treatment of asthma [J]. Brit J Pharmacol, 2007, 151: 725-736.
[11] Roth M, Black JL. Transcription factors in asthma: are transcription factors a new target for asthma therapy? [J]. Curr Drug Targets, 2006, 7: 589-595.
[12] Zhou BP, Hu MC, Miller SA,etal. HER2/neu blocks tumor necrosis factor-induced apoptosis via the AKT/NF-κB pathway [J]. J Biol Chem, 2000, 17:8027-8031.
Inhibitory effects of nodakenin on the airwayinflammation and NF-κB signaling pathway in a murine asthmatic model
XIONG You-yi*, SHI Wei-jing, YU Hao, ZHANG Xiao-lin
(College of Food and Drug, Anhui Science and Technology University, Fengyang 233100, China)
ObjectiveTo observe the effects of nodakenin on airway inflammation in a mouse model of allergic asthma.MethodsBALB/c mice were assigned randomly to one of the following four experimental groups: control, model, nodakenin and dexamethasone. All test mice were sensitized and challenged by OVA to induce airway inflammation. One hour before OVA challenge, nodakenin group was intragastrically administered with nodakenin at a dose of 10 mg/kg, and dexamethasone group was intraperitoneally injected with dexamethasone a dose of 1 mg/kg. Airway responsiveness was measured by a lung function analysis systems. The number of total leukocytes in BALF was counted using a hemocytometer, and differential cells were counted using Diff-Quick-stained smears. Histopathology of lung tissue was analyzed by Hematoxylin-eosin staining. Levels of inflammatory mediators in serum or BALFs were measured by ELISA. The activity and expression of proteins in NF-κB signaling pathway was respectively evaluated by EMSA and western blot analysis.ResultsCompared with control group, the model group
exhibited obvious airway inflammation, airway reactivity was significantly increased, the level of total cells and differential cells was significantly increased, levels of IL-4, IL-5, IL-13, IgE were significantly increased, levels of nuclear P65 and p-P65 protein was significantly enhanced, level of cytoplasmic P65 and IκBα protein was significantly decreased, and the NF-κB DNA binding activity was significantly increased. Compared with model group, nodakenin significantly suppressed airway inflammation, airway hyperreactivity, reduced levels of IL-4, IL-5 and IL-13 in BALF, and IgE in serum, decreased levels of nuclear P65 and p-P65 protein, increased cytoplasmic P65 and IκBα protein, and increased the NF-κB DNA binding activity.ConclusionsNodakenin efficiently inhibits antigen-induced airway inflammation in asthmatic mouse.
nodakenin;peucedanum decursivum maxim;asthma;NF-κB
2013-11-21
2014-01-16
*通信作者(correspondingauthor): xyytc1@163.com
1001-6325(2014)05-0690-05
R 541.4
A
