氯甲基化聚苯乙烯负载修饰L-脯氨酸催化不对称Aldol反应研究
2014-11-27赵文善贾晓波宋玉杰
赵文善,贾晓波,宋玉杰
(1.河南大学 化学化工学院,河南 开封 475001;2.安阳钢铁集团有限公司动力厂,河南 安阳 455004)
近年来随着立体化学的发展,手性化合物被广泛应用于药物、农药、生物医药、功能材料等领域,且需求量越来越大[1].而要合成各种各样的手性化合物,寻找高效的不对称合成催化剂是关键.而不对称Aldol反应是该领域中最常见的反应之一,从1966年第一个手性金属配合物催化剂被成功用于催化不对称反应至今已有近50年的研究历史[2].在传统的不对称反应中,使用手性催化剂或手性辅助剂是必要的[3].手性催化剂一般分为两类:酶催化剂和过渡金属手性配合物.酶催化具有对映选择性高,环境污染小等优点,但制备困难,价格昂贵;过渡金属手性配合物活性高,选择性好,但毒性大、价格高、污染严重等,因此二者的使用都受到了一定的限制.直到2000年,LIST[3]和SAKTHIVEL[4]等人发现L-脯氨酸分子能够高选择性地直接催化Aldol反应以来,有机小分子催化不对称反应的研究得到了国内外学者的高度重视[5-10]和快速发展.L-脯氨酸这类有机小分子催化剂相对于传统的酶催化剂[11-12]和过渡金属手性配体类催化剂[13-14]具有来源广、价格低、反应条件温和、操作简单等优点,但也存在催化剂用量较大、反应多在有机溶剂中进行而造成环境污染、难以回收重复利用等不足之处.为克服这些缺点,化学家们进行了许多尝试,例如CÓRDOVA等[15]利用离子液体[bmim]PF6为溶剂,L-脯氨酸为催化剂催化Aldol反应.其优点是立体选择性和催化活性较高[16-17]、产品易分离,溶剂可重复使用,但回收次数较少.若将有机小分子催化剂负载在大分子上,则催化剂易于回收.这是一种克服有机小分子催化剂不足之处的有效方法.本文作者分别以三聚氰胺、氨基胍和DASA为连接臂,将L-脯氨酸接枝到氯甲基化聚苯乙烯载体上.利用大分子的不溶性和L-脯氨酸的催化性,应用于催化Aldol反应.考察了其在不同条件下的催化及重复使用性能.
1 实验部分
1.1 仪器和试剂
SHJM-1型数显恒温搅拌电热套(山东鄄城现代实验仪器厂),DZF-6050型真空箱式干燥箱(上海新苗医疗器械制造公司),AVATAR-360型傅立叶变换红外光谱仪(尼高力公司),Agilent1100HPLC仪(安捷伦公司)(Daicel Chiralpak AD-H型手性分离柱);L-脯氨酸、碳酸氨基胍、三聚氰胺、芴甲氧羰酰琥珀酰亚胺(Fmoc-OSu)、氯化亚砜、二氯甲烷、氯甲基化聚苯乙烯(S.DCl=1.23mmol/g),均为分析纯.
1.2 催化剂的制备
其合成流程示意图见图1.
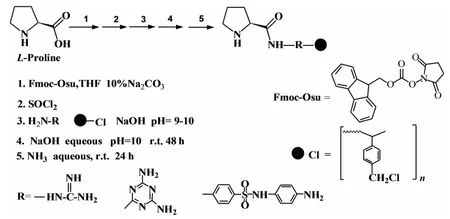
图1 催化剂合成流程示意图Fig.1 Schematic diagram of catalyst synthesis process
1.3 催化Aldol反应的一般步骤
在试管中按顺序加入0.04g催化剂,3mL水,环己酮(5.13mmol)和取代苯甲醛(0.497mmol),于室温下搅拌反应直至反应完全(薄层色谱跟踪).用乙酸乙酯萃取,无水硫酸钠干燥,减压蒸去溶剂.薄层色谱层析[V(石油醚)∶V(乙酸乙酯)=2.5∶1]分离后,称重、计算产率,用手性柱高效液相色谱测得产物的对映选择性,并且进行催化剂重复利用性能实验.催化反应式见图2.

图2 催化剂催化Aldol反应的示意图Fig.2 Schematic diagram of catalysts for Aldol reaction
2 结果与讨论
2.1 催化剂的红外光谱表征
2.1.1 接枝氨基胍催化剂
从IR图可以看到:在3 480cm-1处出现N-H键的吸收峰,在1 600cm-1附近出现4个吸收峰,并且在1 265cm-1处的吸收峰较弱,说明产物中有苯环出现.另外在1 610cm-1处出现了C=N的特征吸收峰.
2.1.2 接枝DASA催化剂
从IR图可以看到:在3 400cm-1处出现了氨基的吸收峰,在1 600cm-1附近出现了4个吸收峰,在1 250 cm-1处出现一个弱的吸收峰,说明有苯环存在.在1 696cm-1处有一强的C=O吸收峰,在1 156cm-1处出现C-S单键的特征吸收峰,在另外1 040cm-1处出现S=O的特征吸收峰.
2.1.3 接枝三聚氰胺催化剂
从IR图可以看到:在3 460cm-1附近出现了氨基的吸收峰,在1 600cm-1附近出现了4个吸收峰,且在1 265cm-1处出现微弱的吸收峰,说明有苯环存在.在1 551~1 436cm-1有三嗪环伸缩振动特征吸收峰,815cm-1处出现了三嗪环变形振动特征吸收峰,说明有三嗪环存在.在1 680cm-1处出现C=O的吸收峰.
2.2 催化剂的催化性能
2.2.1 催化剂在不同溶剂中的催化性能
以对硝基苯甲醛和环己酮为Aldol反应的底物,将不同溶剂加入反应体系中,分别探究三种催化剂的催化效果.

表1 接枝不同分子臂的催化剂的催化性能Table 1 The catalytic performance of catalysts with different molecular arm of the graft
从表1可以看出:接枝氨基胍、DASA分子臂的催化剂在无其他溶剂下催化效果较好;而接枝三聚氰胺分子臂的催化剂在DMF的条件下催化效果较好.
2.2.2 催化剂对不同底物的催化性能
环己酮不变,改变另一底物,并在各个催化剂最适宜的溶剂中反应,以探究不同底物对催化剂催化性能的影响.
从表2可以看出,接枝三种分子臂的催化剂对催化对硝基苯甲醛与环己酮反应均具有较好的催化效果.

表2 催化剂对不同底物的催化性能Table 2 Catalyst on catalytic properties of different substrates
2.2.3 催化剂的重复利用性
以对硝基苯甲醛和环己酮为底物进行反应.从表3可以看出,接枝三种分子臂的催化剂均可以重复使用,产率和e.e.值均有所降低,但接枝DASA的催化剂,降幅较小,相比而言该催化剂活性较好.而接枝三聚氰胺的催化剂,产率和e.e.值均降低较多,重复利用效果不理想.
3 结论
由以上实验可知,三种催化剂对反应都有一定的催化效果,但接枝DASA的催化剂催化效果较好(产率达到83%,e.e.值达86%),且回收5次仍能达到40%的产率和78%的e.e.值,说明该催化剂在无溶剂的条件下,对催化以硝基苯甲醛和环己酮为底物的Aldol反应有一定的应用价值.

表3 催化剂重复使用性能Table 3 Repeated use of catalyst performance
[1]王 钦,夏传琴,杜 曦,等.不对称催化反应在手性药物合成中的应用进展[J].化学研究与应用,2006,18(10):1137-1141.
[2]郭超红,丁奎岭.不对称催化研究进展[M].北京:化学工业出版社,2005.
[3]LIST B,LEMER R A,BARBAS III C F.Proline-catalyzed direct asymmetric Aldol reactions[J].J Am Chem Soc,2000,122:2395-2396.
[4]SAKTHIVEL K,NOTZ W,BUI T,et al.Amino acid catalyzed direct asymmetric aldol reactions:abioor ganic approach to catalytic asymmetric carbon-carbon bond-forming reactions[J].J Am Chem Soc,2001,123:5260-5267.
[5]DALKO P I,MOISAN L.Enantioselective organocatalysis[J].Angew Chem Int Ed,2001,40:3726-3748.
[6]JARVO E R,MILLER S J.Amino acids and peptides as asymmetric organocatalysts[J].Tetrahedron,2002,58:2481-2495.
[7]ALCAIDE B,ALMENDROS P.The direct catalytic asymmetric cross-Aldol reaction of aldehydes[J].Angew Chem Int Ed,2003,42:858-860.
[8]KAZMAIER U.Amino acids-valuable organocatalysts in carbohydrate synthesis[J].Angew Chem Int Ed,2005,44:2186-2188.
[9]ZEITLER K.Extending mechanistic routes in heterazolium catalysis-promising concepts for versatile synthetic methods[J].Angew Chem Int Ed,2005,44:7506-7510.
[10]XU X Y,WANG Y Z,CUN L F,et al.L-Proline amides catalyze direct asymmetric aldol reactions of aldehydes with methylthioacetone and fluoroacetone[J].Tetrahedron:Asymmetry,2007,18(2):237-242.
[11]WANG Y,LI Y,WU Y,et al.Mechanism of dihydroneopterin aldolase:NMR,equilibrium and transient kinetic studies of the Staphylococcus aureus and Escherichia coli enzymes[J].Febs J,2007,274(9):2240-2252.
[12]AHN M,PIETERSMA A L,SCHOFIELD L R,et al.Mechanistic divergence of two closely related Aldol-like enzymecatalysed reactions[J].Org Biomol Chem,2005,3:4046-4049.
[13]BARI I D,LELLI M,SALVADORI P.Ligand lability and chirality inversion in Yb heterobimetallic catalysts[J].Chem Eur J,2004,10:4594-4598.
[14]ZHONG Y W,MATSUO Y,NAKAMURA E.Chiral ruthenium-allenylidene complexes that bear a fullerene cyclopentadienyl ligand:synthesis,characterization,and remote chirality transfer[J].Chem Asian J,2007,2:358-366.
[15]CORDOVA A.Direct catalytic asymmetric cross-Aldol reactions in ionic liquid media[J].Tetrahedron Letters,2004,45:3949-3952.
[16]LIST B.Proline-catalyzed asymmetric reactions[J].Tetrahedron,2002,58:5573-5590.
[17]曲程科,李煜东,张 磊,等.Merrifield树脂负载的L-脯氨酰L-苏氨酸二肽催化剂的合成及其对不对称Aldol反应的催化性能[J].高分子学报,2013,11:1384-1388.
