糖基化三氮唑水杨酸白杨素酯的合成与结构表征
2014-11-27景临林范小飞马慧萍樊鹏程贾正平
景临林,范小飞,马慧萍,樊鹏程,贾正平
(兰州军区兰州总医院 药剂科,甘肃 兰州 730050)
白杨素(5,7-二羟基黄酮)属于天然黄酮家族,广泛存在于蜂蜜、蜂胶和植物提取物中.白杨素具有抗氧化[1]、抗炎[2]、抗菌[3]、抗焦虑[4]、抗肿瘤[5]和神经保护[6]等众多的药理活性,并且几乎没有毒副作用,是一种优秀的天然来源药物活性先导物.但是,白杨素存在溶解性很差,肠道吸收少,代谢快、生物利用度低等不足,尚不能作为药物进行开发[7].研究表明,白杨素分子中5位和7位羟基容易与葡萄糖醛酸作用而代谢失活,针对这两个位点对其进行结构修饰,可以改善其溶解性和药代动力学性质,提高其代谢稳定性和生物利用度.
糖基化三氮唑结构具有三氮唑类化合物和糖类化合物的良好的生物活性[8],将其引入母体分子可以改变母体分子的溶解性和药代动力学性能,增强母体分子的生物活性,在医药和生物工业上应用广泛,已经成为设计合成新型活性分子的有效手段之一.
为了发现活性更加优异的白杨素衍生物,本文作者根据药物拼合原理,以水杨酸为桥联基,将糖基化三氮唑结构引入白杨素分子中,合成得到四个糖基化三氮唑水杨酸白杨素酯,产物结构经1H NMR,IR,EIMS和元素分析确认.目标化合物合成路线见图1.
1 实验部分
1.1 仪器与试剂
X-4B型显微熔点仪,温度计未校正;NEXUS 670傅立叶变换红外光谱仪,KBr压片;Vario EL cube型元素分析仪;Brucker 400核磁共振波谱仪;API 3200LC/MS/MS质谱仪.
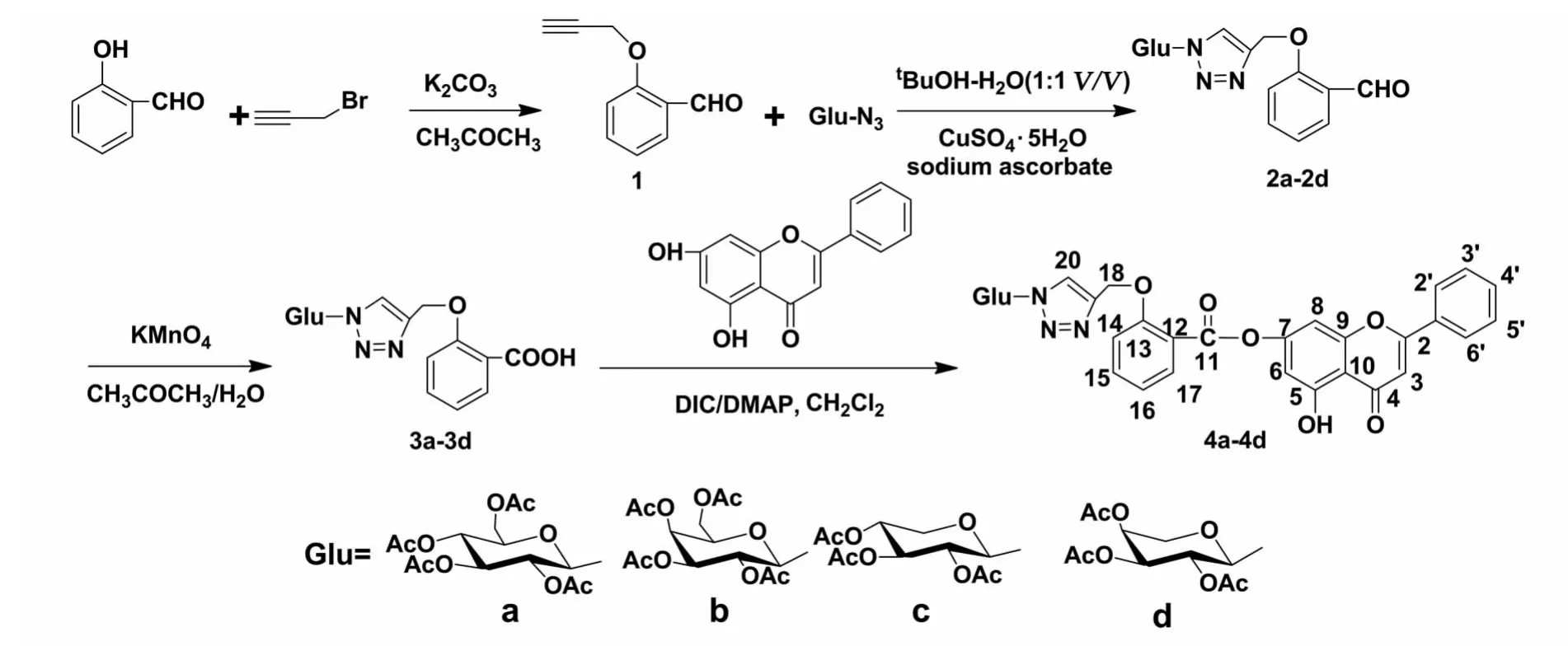
图1 糖基化三氮唑水杨酸白杨素酯衍生物的合成路线Fig.1 Synthesis of chrysin glycosyltriazole salicylic acid esters derivatives
白杨素(纯度99%)购自陕西慈缘生物技术有限公司;200~300目柱层析硅胶和10cm×20cm GF254高效薄层硅胶板购自青岛海洋化工厂分厂;CDCl3,DMSO-d6,内标TMS购自Sigma公司,N,N′-二异丙基碳二亚胺(DIC)购自阿拉丁试剂(上海)公司.其余试剂为市售分析纯或化学纯.CH2Cl2经P2O5脱水干燥处理.
1.2 乙酰叠氮糖参考文献[9]方法制备
1.3 化合物1-3按照文献[10]方法制备
1.4 糖基化三氮唑水杨酸白杨素酯(4a-4d)的制备
将白杨素(508mg,2.0mmol),化合物3a-3d(3.0mmol),4-二甲氨基吡啶(DMAP,0.2mmol)和二氯甲烷(15mL)置于三口烧瓶中,搅拌下冰水浴冷却至0℃,滴加N,N′-二异丙基碳二亚胺(380mg,3.0 mmol)的二氯甲烷溶液(15mL),滴毕后升至室温继续搅拌反应24h.薄层色谱监测(TLC)反应完毕后,加入20mL水,分液,水相用二氯甲烷萃取(3×30mL),合并有机相,用无水硫酸钠干燥过夜.减压除去溶剂,得粗品.快速柱层析分离后,得化合物4a-4d.
4a:产率82%.淡黄色粉末,mp.158.3~160.7℃.1H NMR(400MHz,CDCl3)δ:12.79(1H,s,5-OH),8.08(1H,d,J=7.6Hz,H-17),7.98(1H,s,H-20),7.91(2H,d,J=6.8Hz,H-2′,6′),7.59~7.52(4H,m,H-15,H-3′,4′,5′),7.16~7.13(2H,m,H-14,16),7.02(1H,s,H-3),6.77(1H,s,H-8),6.72(1H,s,H-6),5.84(1H,d,J=9.2Hz,H-1″),5.43~5.40(2H,m,H-2″,3″),5.30(2H,s,H-18),5.24~5.20(1H,m,H-4″),4.25(1H,dd,J=12.8,4.8Hz,H-6″),4.12(1H,d,J=12.8Hz,H-5″),3.96(1H,dd,J=10.0,2.8Hz,H-6″),2.05,2.02,1.98,1.81(12H,4s,4×COCH3).ESI-MS(m/z):786[M+H]+.IR(KBr,cm-1):3 449,1 753,1 660,1 615,1 486,1 368,1 228,1 132,1 036.Anal.calcd.for C39H35N3O15:C 59.62,H 4.49,N 5.35;found C 59.66,H 4.43,N 5.38.
4b:产率83%.淡黄色粉末,mp.173.6~175.1℃.1H NMR(400MHz,CDCl3)δ:12.76(1H,s,5-OH),8.08(1H,d,J=7.2Hz,H-17),8.03(1H,s,H-20),7.91(2H,d,J=7.6Hz,H-2,6),7.62~7.53(4H,m,H-15,H-3′,4′,5′),7.21(2H,d,J=8.4Hz,H-14,16),7.00(1H,s,H-3),6.76(1H,s,H-8),6.72(1H,s,H-6),5.80(1H,d,J=9.2Hz,H-1″),5.60~5.54(1H,m,H-2″),5.51(1H,d,J=2.8Hz,H-3″),5.39(2H,s,H-18),5.21(1H,dd,J=10.4,3.2Hz,H-6″),4.15~4.11(3H,m,H-4″,5″,6″),2.14,2.00,1.98,1.83(12H,4s,4×COCH3).ESI-MS(m/z):786[M+H]+.IR(KBr,cm-1):3 450,1 752,1 657,1 618,1 490,1 370,1 227,1 132,1 038.Anal.calcd.for C39H35N3O15:C 59.62,H 4.49,N 5.35;found C 59.64,H 4.51,N 5.31.
4c:产率86%.白色粉末,mp.210.0~211.7℃.1H NMR(400MHz,CDCl3)δ:12.78(1H,s,5-OH),8.06(1H,d,J=8.0Hz,H-17),7.94(1H,s,H-20),7.91(2H,d,J=7.6Hz,H-2′,6′),7.61~7.53(4H,m,H-15,H-3′,4′,5′),7.16~7.12(2H,m,H-14,16),7.01(1H,s,H-3),6.77(1H,s,H-8),6.71(1H,s,H-6),5.74~5.71(1H,m,H-1″),5.41~5.38(1H,m,H-2″),5.34(2H,s,H-18),5.33-5.30(1H,m,H-3″),5.11(1H,d,J=5.6Hz,H-4″),4.26(1H,dd,J=11.6,6.0Hz,H-5″),3.53~3.49(1H,m,H-5″),2.06,2.01,1.83(9H,3s,3×COCH3).ESI-MS(m/z):714[M+H]+.IR(KBr,cm-1):3 451,1 751,1 656,1 615,1 490,1 369,1 228,1 135,1 034.Anal.calcd.for C36H31N3O13:C 60.59,H 4.38,N 5.89;found C 60.65,H 4.32,N 5.81.
4d:产率81%.白色粉末,mp.189.5~191.4℃.1H NMR(400MHz,CDCl3)δ:12.75(1H,s,5-OH),8.06(1H,d,J=7.6Hz,H-17),8.03(1H,s,H-20),7.91(2H,d,J=7.2Hz,H-2′,6′),7.61~7.52(4H,m,H-15,H-3′,4′,5′),7.19(1H,d,J=8.4Hz,H-16),7.12~7.10(1H,m,H-14),6.98(1H,s,H-3),6.76(1H,s,H-8),6.71(1H,s,H-6),5.71(1H,d,J=9.2Hz,H-1″),5.59(1H,t,J=9.6Hz,H-2″),5.39(1H,s,H-3″),5.30(2H,s,H-18),5.21(1H,dd,J=10.4,2.8Hz,H-4″),4.21(1H,dd,J=13.2Hz,H-5″),3.88(1H,dd,J=13.2Hz,H-5″),2.12,2.00,1.85(9H,3s,3×COCH3).ESI-MS(m/z):714[M+H]+.IR(KBr,cm-1):3 449,1 742,1 657,1 617,1 493,1 372,1 228,1 134,1 034.Anal.calcd.for C36H31N3O13:C 60.59,H 4.38,N 5.89;found C 60.55,H 4.33,N 5.92.
2 结果与讨论
2.1 合成方法
黄酮类化合物酯化修饰主要有酶法和化学法两种.尽管酶催化反应具有专一性强和选择性好的优点,但酶种的选择和培养极其费时,且价格昂贵[11],因此化学法还是目前最常用的方法.利用碳二亚胺类缩合剂制备酯类和酰胺在药物合成中应用非常广泛.目前常用的缩合剂主要有三种:二环己基碳二亚胺(DCC)、二异丙基碳二亚胺(DIC)和1-(3-二甲胺基丙基)-3-乙基碳二亚胺(EDCI).其中,DCC和DIC由于价廉易得,使用较为广泛.但是DCC的反应产物二环己基脲在水中几乎不溶,微溶于一般有机溶剂,因此通过一些常用的纯化方法,例如重结晶,柱层析等很难将其彻底清除.DIC由于其产生的二异丙基脲在一般的有机溶剂中溶解度较好,后处理较为容易.EDCI反应后生成的脲是水溶性的,很容易被洗掉,但是价格较高.综合以上考虑,本文作者选择DIC为脱水剂,DMAP为催化剂,无水二氯甲烷为溶剂进行酯化反应.由于白杨素分子结构中5位和7位羟基的活性差异,经TLC检测发现在反应条件下只得到了7-位酯化产物,产率为81%~86%.
2.2 结构表征
在化合物4的1H-NMR谱中,白杨素分子中5位羟基质子信号出现在12.75~12.79;而7位羟基质子信号消失;7.94~8.03处的尖锐单峰为三氮唑结构中质子信号;-CH2-的质子信号出现在5.30附近;水杨酸分子中4个芳香质子分别出现在8.00,7.50和7.20附近;糖环上的端基质子在5.80附近出峰,其余质子分布在3.90~5.50之间;2.00附近的单峰为乙酰基的质子信号.化合物4的红外谱图中,3 450cm-1附近为典型羟基吸收峰;1 660cm-1附近为黄酮结构中羰基的特征吸收峰;1 750cm-1附近为乙酰基中羰基的特征吸收峰,1 500和1 370cm-1出现苯环骨架振动吸收峰;1 200和1 030cm-1处出现的强吸收峰为C-O的伸缩振动吸收峰.上述数据证明,糖基化三氮唑基团已经成功的通过水杨酸桥联基引入到白杨素分子的7位上.质谱和元素分析的数据进一步证实了上述结论.
3 结论
为了获得代谢稳定性更好、活性更强、生物利用度更高的新型白杨素衍生物,本文作者以四种糖、炔丙基溴、水杨醛和白杨素为原料,将白杨素分子与糖基化三氮唑结构通过水杨酸相连,合成了四种新型糖基化三氮唑水杨酸白杨素酯衍生物,该合成路线短、操作简单,反应条件温和、产率较高,产物结构经波谱分析与目标化合物一致.
[1]LAPIDOT T,WALKER M D,KANNER J.Antioxidant and prooxidant effects of phenolics on pancreatic beta-cells invitro[J].J Agric Food Chem,2002,50(25):7220-7225.
[2]GRESA-ARRIBAS N,SERRATOSA J,SAURA J,et al.Inhibition of CCAAT/enhancer binding proteinδexpression by chrysin in microglial cells results in anti-inflammatory and neuroprotective effects[J].J Neurochem,2010,115(2):526-536.
[3]WANG J,QIU J,DONG J,et al.Chrysin protects mice from staphylococcus aureus pneumonia[J].J Appl Microbiol,2011,111(6):1551-1558.
[4]BROWN E,HURD N S,MCCALL S,et al.Evaluation of the anxiolytic effects of chrysin,a Passiflora incarnata extract,in the laboratory rat[J].AANA J,2007,75(5):333-337.
[5]PICK A,MÜLLER H,MAYER R,et al.Structure-activity relationships of flavonoids as inhibitors of breast cancer resistance protein(BCRP)[J].Bioorg Med Chem,2011,19(6):2090-2102.
[6]KANDHARE A D,SHIVAKUMAR V,RAJMANE A,et al.Evaluation of the neuroprotective effect of chrysin via modulation of endogenous biomarkers in a rat model of spinal cord injury[J].J Nat Med,2014,68(3):586-603.
[7]TSUJI P A,WINN R N,WALLE T.Accumulation and metabolism of the anticancer flavonoid 5,7-dimethoxyflavone compared to its unmethylated analog chrysin in the Atlantic killifish[J].Chem Biol Interact,2006,164(1/2):85-92.
[8]DOS ANJOS J V,SINOU D,D E MELO S J.Synthesis of glycosyl-triazole linked 1,2,4-oxadiazoles[J].Carbohydr Res,2007,342(16):2440-2449.
[9]李一鸣.以叠氮糖为中间体设计合成具有生物活性的杂环化合物[D].天津:南开大学,2010:38-39.
[10]景临林,范小飞,贾正平.糖基化三氮唑水杨酸衍生物的合成及PTP1B抑制活性[J].精细化工,2013,10:1129-1133.
[11]李翠苹,余燕影,曹树稳.根皮素乙酰阿魏酸酯的合成及抗氧化活性研究[J].天然产物研究与开发,2012,3:316-320.
