糖尿病胃轻瘫大鼠模型衍变过程相关指标的观察
2014-11-27万全荃贺凤娥林亚平
万全荃,贺凤娥,林亚平*
(湖南中医药大学,湖南 长沙410208)
成功的糖尿病 (DM) 模型是糖尿病胃轻瘫(DGP)模型成功的基础。 近年的文献资料中以链脲佐菌素(STZ)建立DM 模型较多,而关于DGP 模型研究较少, 在选用STZ 造模的剂量上亦各持己见,并且前人在DGP 模型的制作过程中缺乏其由DM并发DGP 过程中相关指标变化的详细记录。而本实验在总结前人DM 与DGP 造模方法的基础上,以2%STZ [0.1 mmol/L 柠檬酸-柠檬酸钠缓冲液(pH 4.2,4 ℃)配成2%,按50、55、60 mg/kg 的剂量]进行预实验, 进一步肯定DM 大鼠模型用药剂量为55 mg/kg, 并给以滋腻碍胃高糖高脂饲料不规则喂养,成功建立DGP 模型。通过观察记录DGP 大鼠模型每周相关指标积分情况, 直观反映了DM 并发DGP 的发展过程, 一定程度上弥补了以往DPG 造模方法缺乏详细症状改变情况记录的不足,并为后期基于此模型的研究提供了具体的数据支持。 现将正式实验的方法与结果报道如下。
1 材料与方法
1.1 动物及分组
健康SPF 级SD 大鼠90 只, 雌雄各半, 体质量(231±10)g, 购自湖南斯莱克景达实验动物有限公司,动物质量合格证号:43004700002152。 均经血糖仪检测、尿糖试纸检测,血糖正常、尿糖阴性者入选[1]。 将大鼠随机分为空白组(下简称A 组)12 只、STZ 造模组(下简称B 组)78 只。饲养于湖南中医药大学实验动物中心SPF 级实验动物房, 饲养温度22~25 ℃,湿度40%~60%,自然采光。
1.2 动物饲料[1]
高糖高脂饲料含普通饲料、 熟猪油、 蔗糖、奶粉、鸡蛋之比为58∶15∶20∶5∶2。 普通饲料由湖南中医药大学实验动物中心提供。
1.3 主要试剂与仪器
链脲佐菌素(美国sigma 公司,015H1492)临用前用0.1 mmol/L 柠檬酸-柠檬酸钠缓冲液(pH 4.2,4 ℃)配成2%浓度;尿糖试纸(广州市花都高尔宝生物技术有限公司);柠檬酸钠、柠檬酸、NaOH(湖南汇虹试剂公司);酚红(天津市恒兴化学试剂制造有限公司); 三氯乙酸 (天津市科密欧化学试剂有限公司); 血糖仪及血糖试纸 (美国强生公司稳易倍健型);电子天平(日本岛津AEL-120 型);制冰机(三洋SIM-F140); 紫外分光光度计 (日本岛津 UV-1800)。
1.4 造模方法与成模标志
根据参考文献[1], 所有大鼠先适应性饲养1周。 禁食12 h,A 组大鼠单次腹腔注射等容量的0.1 mmoL/(pH 4.2,4 ℃)柠檬酸-柠檬酸钠缓冲液,B组以2%STZ 55 mg/kg 的剂量经左下腹腔一次性注射,注射后72 h 取尾静脉血测大鼠非空腹血糖值,即刻血糖≥16.7 mmol/L 者作为糖尿病大鼠。A 组给予普通饲料规则喂养;B 组给予高糖高脂饲料不规则喂养, 即采取单日上午和双日下午进食的办法,实验期间均随意饮水。 DGP 模型成功指标:(1)监测大鼠血糖、尿糖。 血糖≥16.7 mmol/L、尿糖阳性者;(2) 大鼠一般情况及大便性状与正常对照组有明显差别者;(3)大鼠胃排空率及小肠推进率与正常对照组相比有显著差异者。
1.5 观察方法与指标采集
1.5.1 一般情况观察 (1)根据自制症状积分表观察并记录粪便性状,精神状态、活动情况、皮毛色泽情况,症状积分表见表1;(2)每周以电子秤称取体质量1 次;(3)每周将大鼠单个放入代谢笼,称取定量的饲料,24 h 后以电子秤量取剩余饲料量以计算各只大鼠24 h 食量;(4)每周将大鼠单个放入代谢笼, 称取定量的饮用水,24 h 后以量筒量取剩余水量以计算各只大鼠24 h 饮水量;(5)每周用容器收集各只大鼠24 h 尿量1 次,用量筒测量。
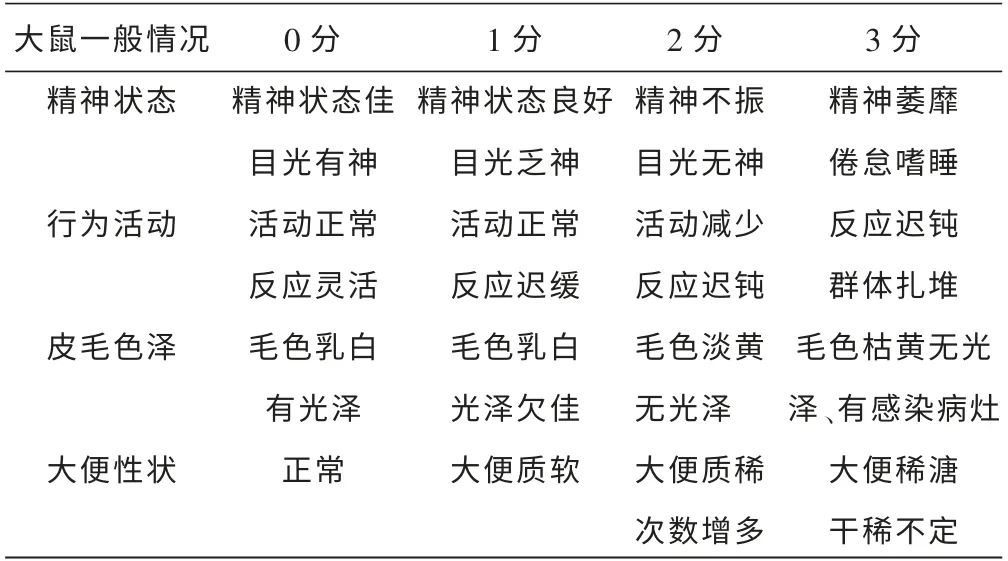
表1 大鼠一般情况评分标准
1.5.2 血糖、 尿糖测定方法 每周以尾静脉采血,用强生血糖仪和血糖试纸测定血糖值;尿液标本采集以压迫大鼠下腹部使其膀胱排空, 收集尿液,用尿糖试纸测量尿糖值。血糖<16.7 mmol/L、尿糖阴性者剔除实验。
1.5.3 胃排空率测定方法[3-4]实验前大鼠禁食24 h,禁水2 h。 每只大鼠给予50 mg/dL 酚红溶液2 mL灌胃,20 min 后处死,剖腹,结扎贲门和幽门,取出整个鼠胃,沿胃大弯切开,以蒸馏水冲洗胃内容物,定容为20 mL。 再加入0.5 mol/L NaOH 20 mL 搅拌混匀,静置1 h 后取5 mL 上清液,加入20%三氯乙酸0.5 mL 去蛋白, 以3 500 r/min (离心半径0.1 m) 离心10 min, 取上清液用分光光度计在560 nm 波长下测定吸光度值(OD)。 另取酚红溶液2 mL, 先后加入蒸馏水18 mL、0.5 mol/L NaOH 20 mL、20%三氯乙酸4 mL 搅拌混匀, 测定吸光度值。
大鼠胃排空率=(1-实测酚红吸光度/标准酚红吸光度)×100%。 (水吸光度为0.067,标准酚红吸光度为2.968)
1.5.4 小肠推进率测定方法[3-4]迅速取出小肠,轻轻剥离后直铺于白纸上,测量幽门至回盲部全长及幽门至酚红所到距离,以幽门至酚红所到位置的距离占幽门至回盲部全长的百分率为小肠推进率。
小肠推进率=酚红在小肠中的移行距离/小肠全长×100%
1.6 统计学分析
所有数据采用SPSS 17.0 统计软件进行统计分析。 全部数据用“±s”表示。 计量资料满足正态性及方差齐性,采用方差分析,不满足正态性及方差齐性,以中位数和四分位间距表示,采用秩和检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 两组大鼠一般状况比较
A 组大鼠一般状况良好,活动正常,反应灵敏,大便性状无明显改变,皮毛光泽,实验期间无动物死亡;B 组大鼠在造模第4 周开始出现精神不佳、活动迟缓,造模第5 周时出现毛色改变及大便性状改变,稀便与干结便均可见到,第6 周时大鼠开始出现明显的精神倦怠、反应迟钝、皮毛稀松泛黄无光泽、大便干稀不调。实验期间死亡15 只(19.2%)。根据排除标准:血糖<16.7 mmol/L、尿糖阴性者剔除实验15 只(19.2%)。成功造模48 只。症状积分结果见表2。
表2 空白组与STZ 造模组大鼠症状积分情况 (±s,分)

表2 空白组与STZ 造模组大鼠症状积分情况 (±s,分)
注:与A 组比较*P<0.05,**P<0.01。
时间第1 周第2 周第3 周第4 周第5 周第6 周第7 周第8 周空白组(n=12)0 0 0 0 0 0 0 0 STZ 造模组(n=48)0 0 0.27±0.74 0.69±1.26 1.23±1.91*2.81±2.35**5.67±2.42**8.96±1.73**
2.2 两组大鼠的体质量、食量、饮水量、尿量比较
2.2.1 两组大鼠体质量比较 A 组大鼠第1 周开始体质量增加,至第8 周,期间体质量较造模前明显增加(P<0.01);B 组大鼠第1 周至第4 周较造模前体质量有所增长(P<0.01 或P<0.05),在第5 周开始减轻,至第8 周体质量较造模前明显降低(P<0.05);并且在第1 周至第8 周造模过程中,与A 组比较B 组大鼠体质量明显减轻 (P<0.01 或P<0.05),结果见图1。
2.2.2 两组大鼠食量比较 B 组大鼠造模后第1 周食量增多, 至第4 周与第5 周时食量稍减少; 与A组比较, 第6 至第8 周期间食量明显减少 (P<0.01或P<0.05),结果见图2。
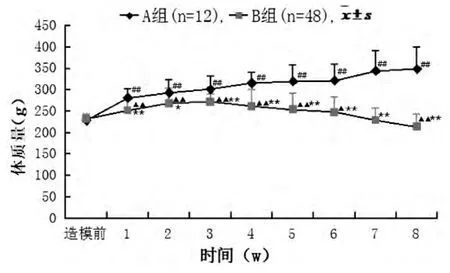
图1 两组造模期间大鼠体质量变化曲线图
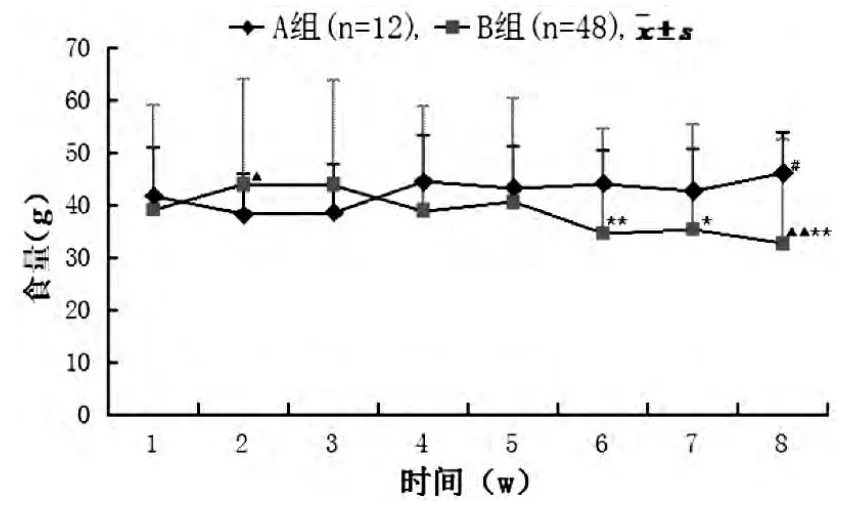
图2 两组造模期间大鼠食量变化曲线图
2.2.3 两组大鼠饮水量比较 与A 组比较,B 组大鼠造模后持续性出现饮水量显著性增多 (P<0.01),结果见图3。
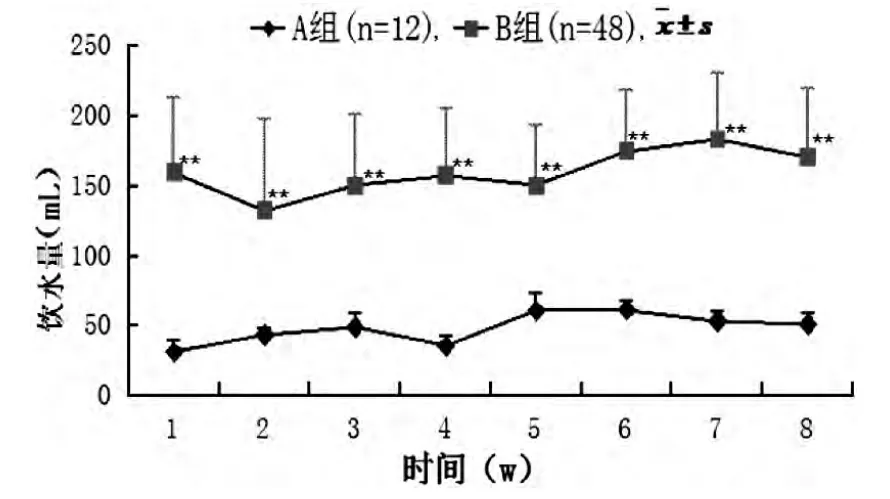
图3 两组造模期间大鼠饮水量变化曲线图
2.2.4 两组大鼠尿量比较 与A 组比较,B 组大鼠造模后持续性出现尿量显著性增多(P<0.01),结果见图4。
结果显示在腹腔注射链脲佐菌素后大鼠迅速出现多食、多饮、多尿,第4 周出现体质量减轻,呈现出典型的糖尿病“三多一少”症状。 而在配合高糖高脂饲料不规则饮食后,造模后期大鼠食量减少,体质量明显下降,与多饮、多尿形成“二多二少”表现,并且出现精神状态、行为活动、皮毛及大便性状的改变。

图4 两组造模期间大鼠尿量变化曲线图
2.3 两组大鼠血糖、尿糖比较
造模前,两组血糖比较无明显差异,造模8 周期间,每周两组的血糖比较,B 组血糖明显升高(P<0.01);造模前,两组的尿糖比较无明显差异,造模8周期间,每周测得两组尿糖比较,B 组大鼠尿糖明显升高(P<0.01)。 说明腹腔注射链脲佐菌素后配合高糖高脂饮食造成大鼠血糖、 尿糖持续性高于正常值,并达到糖尿病诊断标准,成功造成大鼠糖尿病模型。 结果见表3。
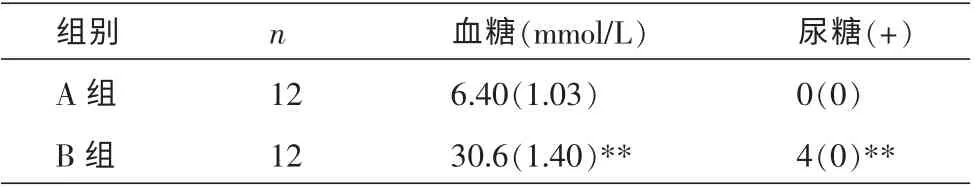
表3 两组大鼠血糖、尿糖比较
2.4 两组大鼠胃排空率与小肠推进率比较
根据后期实验需要,从B 组中随机选取12 只大鼠与A 组作胃排空率及小肠推进率比较,模型组大鼠胃排空率、小肠推进率(P<0.01)明显降低,差异有显著统计学意义, 说明在糖尿病模型基础上配合高糖高脂饮食成功造成大鼠胃肠动力障碍和胃排空延迟, 形成大鼠糖尿病胃轻瘫模型。 结果见表4。
表4 两组大鼠胃排空率、小肠推进率比较 (±s,%)

表4 两组大鼠胃排空率、小肠推进率比较 (±s,%)
注:与A 组比较**P<0.01。
组别A 组B 组n 12 12胃排空率66.69±4.41 25.46±2.73**小肠推进率62.53±3.08 45.97±2.20**
3 讨论
在前人的DM 及DGP 模型中,对于STZ 剂量的选择众说纷纭。 少剂量多次注射可造成2 型糖尿病模型, 大剂量单次注射可造成1 型糖尿病模型,造模剂量选择范围在20~60 mg/kg 之间,其中DGP 模型较多采用的是大剂量单次腹腔注射,而其中“大剂量”到底应该是何等剂量呢? 由于DGP 模型造模时间比较长, 笔者认为剂量过小不能达到成模标准,而剂量过大必定出现死亡率高的情况,故在预实验中, 笔者以2%STZ 按50、55、60 mg/kg 3 种剂量单次腹腔注射制备糖尿病模型,配以高糖高脂饲料不规则喂养8 周。 通过预实验发现,注射55 mg/kg 剂量的糖尿病大鼠模型在实验8 周期间一直维持糖尿病高血糖状态,并且血糖稳定,未出现死亡现象,是成功的DM 造模剂量组,为后期的糖尿病胃轻瘫造模实验,给以STZ 剂量选择的实验支持。
根据预实验结果,在本次实验中应用2%STZ 按55 mg/kg 单次腹腔注射配合高糖高脂饲料的不规则喂养成功建立糖尿病胃轻瘫模型。 在实验8 周期间,在监测大鼠血糖、尿糖的基础上,结合两组大鼠的胃排空率与小肠推进率的比较,B 组大鼠的胃运动消化功能减弱,成功造成了DGP 模型。 根据实验8 周大鼠每周的体质量、24 h 食量、24 h 饮水量及24 h 尿量与造模时间的效应曲线,以及两组大鼠实验8 周期间的一般症状积分的变化情况, 观察到B组大鼠尿量及饮水量在实验过程中表现为持续性的高水平状态并未出现明显波动,食量增多,体质量在造模开始并未立即出现减轻,不符合典型的糖尿病多饮、多食、多尿、体质量减轻的“三多一少”症状。 而B 组大鼠在第5 周开始出现体质量的减轻,进而表现出典型的“三多一少”症状[5-7]。 通过这一点认为,前5 周实验成功建立了糖尿病模型。 而在造模第6 周后,大鼠食量开始明显下降,形成多饮、多尿、少食、体质量减轻的 “二多二少”症状特点,并伴有精神萎靡、行为迟缓、皮毛枯黄及大便性状的改变,故认为第6 周为DGP 开始出现的时间点。 而在造模过程中,B 组大鼠出现的持续性多饮、 多尿,可能与糖尿病肾病有关[8];而低血糖、皮肤感染、泌尿道感染及糖尿病足,以及在死鼠解剖中发现肿瘤等与死亡率息息相关,是今后糖尿病胃轻瘫造模过程中值得注意之处。
糖尿病胃轻瘫模型已具有40 余年的历史,其发展过程中各个基础指标的变化程度与时间的关系却鲜少报道。 笔者认为作为一个成熟、实用且常用的模型,过程的观察非常重要。 在糖尿病胃轻瘫模型的建立过程中,本文与以往文献的关注点并无异同,但本文着重于观察DGP 模型衍变过程中每周体质量、食量、饮水量、尿量及精神、活动、皮毛、大便等基础指标的改变,详尽记录各项基础指标随造模时间变化的程度及趋势的改变情况,通过DGP 模型衍变过程的观察: 首先验证了2%浓度STZ 按55 mg/kg 剂量单次腹腔注射造模方法的可行性;其次,完善了以往缺乏症状改变情况详细记录的DPG造模过程,为今后基于DGP 模型的研究提供详细直观的数据参考,并为后期中医治疗DGP 的机制研究予以实验数据支持。
[1]陈 俊.糖胃康对糖尿病胃轻瘫大鼠胃窦SCF-Kit 信号途径影响的研究[D].武汉:湖北中医药大学博士论文,2010.
[2]窦 娟.外源性SCF 对糖尿病胃轻瘫大鼠RhoA/ROCK 信号通路的影响[D].重庆:重庆医科大学硕士论文,2012.
[3]张 猛,郭建生,王小娟,等.云木香不同提取物对小鼠胃排空和小肠推进功能的影响[J].中国实验方剂学杂志,2012,18(2):136-138.
[4]周喜芬. 半夏泻心汤对糖尿病胃轻瘫大鼠胃动力调控机制研究[D].成都:成都中医药大学硕士论文,2013.
[5]刘新萍,张 凯,储全根,等.不同剂量链脲佐菌素腹腔注射制备大鼠糖尿病心肌病模型的病理学观察[J]. 生物学杂志,2013,30(6):14-16.
[6]谢 黎,刘纯伦,徐晓萌,等.外源性干细胞因子对糖尿病胃轻瘫大鼠Cajal 细胞的影响[J].世界科技研究与发展,2011,33(3):481-483.
[7]黄 焱,陈恩玉,陈雅芬,等.链脲佐菌素结合高糖高脂饮食诱导2型糖尿病大鼠模型[J].实用医学杂志,2010,26(13):2 299-2 301.
[8]陈 澍,刘雪芳.链脲佐菌素诱导大鼠糖尿病肾病模型的建立[J].实用医学杂志,2006,22(11):1 239-1 240.
