变形链球菌耐氟菌ffh基因siRNA干扰序列的筛选鉴定
2014-11-24张桐菲王城坤洪丽华张志民
张桐菲,王城坤,洪丽华,张志民
(吉林大学口腔医院,吉林 长春130021)
龋病是口腔最常见感染性疾病,变形链球菌是主要致龋菌,其致龋性主要取决于其产酸性和耐酸性。耐酸性是指细菌能在低环境中生长和代谢的能力[2]。氟化物作为有效的防龋药物,在临床广泛的应用,相关的口腔菌群为适应新环境产生了耐氟的变形链球菌株[3]。所以,探讨变形链球菌出现耐氟菌株后相关致龋基因就显得尤为重要了。目前已分离并克隆了多个与变形链球菌耐酸性相关的基因,其中耐酸相关基因ffh受到国内外学者的密切关注。本实验拟筛选鉴定出使ffh基因沉默的siRNA片段,为探讨变形链球菌耐氟菌株ffh基因在控制细菌耐酸性、产酸性以及生物膜形成等方面的作用奠定基础。
1 材料与方法
1.1 主要试剂与仪器
变形链球菌S.mutans UA159(购自上海交通大学口腔医学院);BHI培养基(购自青岛海博生物技术有限公司);RNA提取试剂盒、实时荧光定量通用试剂(购自 TaKaRa公司 大连);BIO-RAD MicroPulser电转仪;VITEK2-compact细菌鉴定仪(法国);ffh基因siRNA序列4组由上海吉玛公司合成:siRNA1:sense:GCUCAACUCUGACAUAUCUT,antisense:AGAUAUGUCAGAGUUGAGCTT;siRNA2:sense:GACUAGCCUUCUCAAUUAATT,antisense:UUAAUUGAGAAGGCUAGUCTT;siRNA3:sense:GCCAGACCUUGACUUACAATT,antisense:UUGUAAGUCAAGGUCUGGCTT;siRNA4:sense:GACCGACCAUCAUGAUAAUTT,antisense:AUUAUCAUGAUGGUCGGUCTT。
1.2 方法
1.2.1 变形链球菌耐氟菌株的诱导与鉴定 将-80℃甘油保存的S.mutans UA159取出,利用本实验室常规耐氟菌株诱导方法获得UA159-FR[4]。观察菌落形态、革兰染色鉴定、生化鉴定。
1.2.2 细菌转染 按200ml BHI培养液(含有5%5M 甘氨酸),加入4ml(OD600=0.2)UA159-FR细菌的比例接种,37℃厌氧培养(95%N2,5%CO2)16 h。放在冰上预冷10min,将菌液转移到离心管中,在4℃6 000rpm离心10min,弃上清。加入50ml无菌Elpo培养液,混匀,8 000rpm,离心10min,弃上清。加入30ml无菌Elpo培养液,12 000rpm离心10min,弃上清,将沉淀细菌放入含有1ml冰冷无菌Elpo培养液的EP管中,放在冰上,等待电转。按400μl细菌悬液加入200pmol siRNAoligo的比例充分混匀,加入0.2电转杯中,放在冰上10min。启动开关,将电压调整为1.6kV。取出电转杯[8],用移液器吸取300μl电转混合液,加入1ml BHI培养液中,37℃厌氧培养(95%N2,5%CO2)12h24 h分别收样,用于检测。
1.2.3 总RNA提取 将细菌用预冷PBS缓冲液洗2遍,加1ml Ezol裂解液重悬。加入0.2ml三氯甲烷,剧烈摇动10s,室温放置3min,4℃,12,000 x g离心20min。将上清水相转移至另一新的无RNA酶离心管中,并加入等体积的100%乙醇。吸取样品,加入带有2ml收集管的mini-spin离心柱。8,000xg,室温离心15s,弃尽流穿液。将剩余的样品转移至离心柱,重复第4步。往离心柱中加入700μl Wash Buffer,轻盖盖子,8,000xg,室温离心15s,弃尽流穿液。重复第6步,用500μl Wash Buffer洗涤离心柱三次。将离心柱转移至一新的无RNA酶的1.5ml离心管中,往硅胶膜中央滴加50 μl DEPC水,4℃,10,000xg离心3min洗脱RNA。测定OD260、OD280,计算RNA浓度。琼脂糖电泳检查RNA的完整性。
1.2.4 Real-time PCR 检测ffh基因 mRNA 的表达 PCR反应体系中所加入的引物分别为:ffh基因引物(上游引物 AGGCTAAGAAGATGATGCAAGG,下游引物 CACATCCATATTAGTACCGCTCA,扩增长度为176bp),内参16sRNA引物(上游引物 GTAGTTAGCCGTCCCTTTCTG,下游引物ACGATACATAGCCGACCTGAG,扩增长度为237bp)。具体操作见表1、表2。
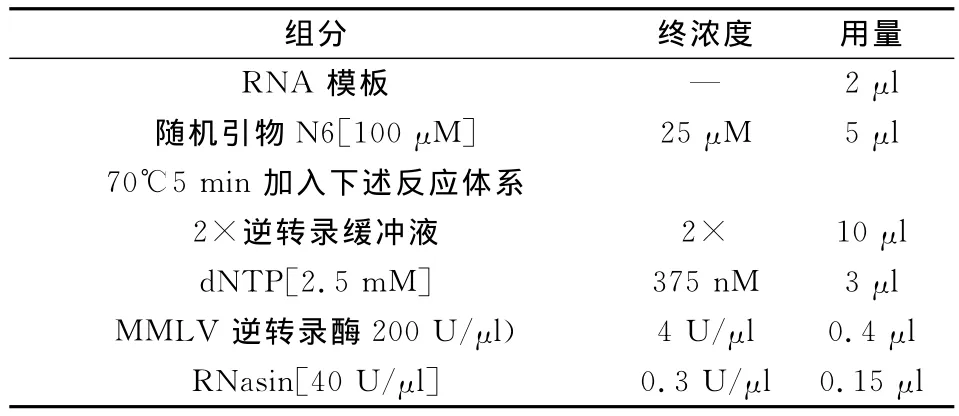
表1 mRNA逆转录反应体系

表2 mRNA实时荧光定量反应体系
反应产物经琼脂糖凝胶电泳,以16sRNA为内参,计算ffh基因的相对密度值。实验样品重复3次,以精确计算均值与标准差,用以表示基因的表达水平。
2 结果
2.1 变形链球菌耐氟菌株的诱导与鉴定 镜下观察UA159-FR,可见细菌革兰染色阳性,呈球状、短链状排列,与变形链球菌形态相符合(图1)。单菌经生化鉴定证实99.9%的可能性是变形链球菌。

图1 变形链球菌耐氟菌革兰染色
2.2 细菌转染 将带有荧光标记物的高浓度的空白对照NC-FAM oligo加入菌液中,可在荧光倒置显微镜下观察到当转染成功后有绿色点状荧光标记。图2A和B分别表示同一视野下,未经过电穿孔处理的混合液37℃厌氧培养(95%N2,5%CO2)24h后在荧光倒置显微镜下用日光和荧光照射的细菌的状态。可清晰看见图A内有大量细菌,图2B为单纯荧光反射未见类似细菌形态及荧光点。图2C和2D分别表示同一视野下,经过1.6kV电穿孔处理的混合液37℃厌氧培养(95%N2,5%CO2)24h后在荧光倒置显微镜下用日光和荧光照射的细菌状态。图2C中可观察到部分成团状的细菌团块,图2D中可观察到图2C中的大部分团块有荧光标记,少部分无荧光标记。由此可见电穿孔转染是可行的。
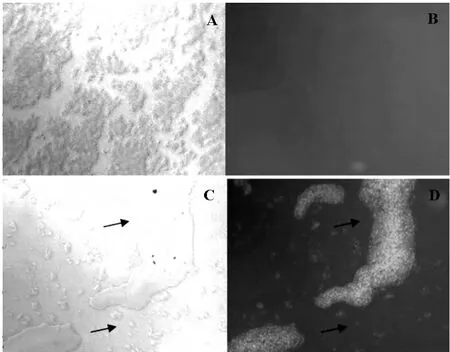
图2 细菌电转的图片
2.3 RT-PCR 检测RNA电泳28srRNA、18s rRNA条带清晰可见,说明RNA未降解;OD值测定 A260/A280在1.9-2.2之间,提取过程中没有蛋白污染,见图3。

图3 总RNA提取电泳图
用1.6kV电压转染ffh基因的靶向siRNA oligo,通过RT-PCR技术检测转染及沉默效果。以样品B-12和B-24为空白对照,图4B16srRNA为内参基因,分别观察转染后12和24h的ffh表达。图4A的电泳结果可以清楚观察到PCR产物大小正常,没有杂带,且空白对照组没有目的条带。f1-12表示ffh基因的靶向siRNA1转染12h,f1-24表示ffh基因的靶向siRNA1转染候24h,

图4A 12h,24hffh基因的靶向siRNA表达

图4B 内参16srRNA的表达
2.4 Real-time PCR相对定量柱状图结果 实时定量结果整理后用柱形图表示(如图5),以样品B-12和B-24为校准16srRNA为内参基因分别观察转染后12和24h的ffh表达,结果显示f2干扰片段干扰效果较稳定。
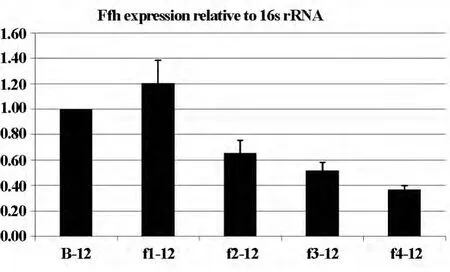
图5A 以B-12为校准12h16srRNA为内参stm-Ffh基因水平
3 讨论

图5B 以B-24为校准24h16srRNA为内参stm-Ffh基因水平
siRNA是一种以mRNA为基础的转录后基因沉默机制,具有高特异性可以抑制靶基因的表达,维持遗传物质的稳定性[5]。其作用原理是siRNA的反义链与mRNA分子的特异性序列结合,使得mRNA降解,所以siRNA和mRNA上的靶序列配对结合是发挥作用的关键。在同一基因不同位置的siRNA序列对该基因的沉默结果可以有很大差别[6]。广泛应用于抗病毒和抗肿瘤细胞的研究当中[7],但在真核生物研究方面进展较缓慢目前没有持久稳定表达且在治疗细菌感染方面的运用也很少[9]。电转化发转化效率高于化学方法,常用于对转化效率要求较高的实验中[10],本实验分别在转染后12h和24h收集数据显示siRNA可以有效抑制ffh基因的表达。本实验中,我们根据siRNA设计原则,参照ffh mRNA序列设计出4对siRNA序列及一对阴性对照序列通过电穿孔法转染变形链球菌耐氟菌UA159-FR菌株。结果显示在转染12h内除siRNA1外其他3对siRNA都可以抑制ffh基因的表达,而在转染超过12h达到24h后,只有siRNA2可以更稳定的抑制ffh基因的表达。
本实验证明,在研究细菌的基因沉默中,siRNA是可以有效抑制靶向基因表达的,但当转染时间超过24小时后部分转染的特意位点会恢复原有的表达,即siRNA在干扰过程中表现并不十分稳定。但针对UA159-FR菌株这类生长周期较短的细菌,siRNA干扰是可以起到有效抑制作用。siRNA技术可以有效的抑制变形链球菌耐氟菌株耐酸基因ffh的表达,为探讨UA159-FR菌株ffh基因是否调控产酸、耐酸作用奠定基础。
[1]Holen T,Amarzguioui M,Wiiger M T,et al.Positional effects of short interfering RNAs targeting the human coagulation trigger tissue factor[J].Nucleic Acids Reserch,2002,30(8):1757.
[2]Svensater G,Sjogreen B,Hamiltion IR.Multiple stress responses in streptococcus mutans and induction of general and stress-specific protein[J].Nature,2000,146(1):107.
[3]刘 莉,张志民,王丽颖,等.变形链球菌耐氟菌株中耐酸相关基因gluA突变的检测及其意义[J].吉林大学学报(医学版),2011,37(1):80.
[4]赵洪岩,张志民,朱来宽,等.变形链球菌耐氟菌株的体外诱导[J].中国实验诊断学,2010,14(7):1095.
[5]严燕国,詹文化,赵 刚,等.siRNA特异性抑制幽门螺旋杆菌CagA基因表达的实验研究[J].中国人兽共患病学报,2006,22(4):330.
[6]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in caenorhabditis elegans[J].Nature,1998,391(6669):806.
[7]Elbashir SM,Harborth J,Lendeckel W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,441:494.
[8]Liang W,Zhang WJ,Gao QM,et al.Silencing of surviving gene in jeko-1cell line with small interfering RNA[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2012,20(1):88.
[9]耿先龙,马筱玲.RNA干扰技术及其在抗微生物感染方面的进展[J].国际检验医学杂志,2007,28(8):733.
[10]顾长国,贾淑芳,刘 琛,等.外源性DNA电转化导入XL1-blue
菌株条件的优化[J].西南国防医药,2009,19(5):507.作者简介:张桐菲(1988-),女,吉林省长春市人,在读医学硕士,主要从事龋病病因学及临床研究。
