肝肾联合移植进展
2014-11-23滕大洪郑虹天津市第一中心医院器官移植中心天津300192
滕大洪,郑虹(天津市第一中心医院器官移植中心,天津 300192)
1983年奥地利Margreiter等[1]成功完成了世界首例肝肾联合移植,术后患者存活超过了9年,肝肾功能良好。此后,肝肾联合移植逐渐成为肝肾同时受损患者的重要治疗手段,并因其良好的远期疗效而获得了临床认可与实施。根据美国器官共享网络(UNOS)的数据,自2005年以来,美国每年施行的肝肾联合移植在340例以上,截止至2014年8月共施行了5 816例。
总的来说,同时存在不可逆转的肝脏和肾脏功能衰竭是肝肾联合移植的适应证。由于单独肝移植后,部分肾脏功能的异常可以得到改善,从而临床主张应在施行移植前对可逆性肾脏功能不全进行鉴别。
1 适应证
根据肝肾疾病的发病机制、受累程度与进展规律,肝肾联合移植的适应证可分类如下。
1.1 遗传性疾病同时累及肝肾两个器官
常染色体显性遗传多囊肾(ADPKD)是最常见的多囊肾性疾病,近一半病例进展至尿毒症。ADPKD常伴随肝脏囊肿,多囊肝不断增大者会出现占位效应,出现腹痛、腹胀,门静脉高压,腔静脉受压回流障碍等,常规外科治疗如注射硬化剂、囊肿开窗、部分肝切除术等均不能根除病因,症状反复,病情逐渐进展。对于肝肾同时严重受累的病例,施行肝肾联合移植可获得良好的治疗效果。而对于肾脏受累严重造成慢性肾功能衰竭而肝脏为受累或轻度受累病例,常仅施行肾移植术。
1.2 遗传性代谢性疾病伴有肾脏损害
Ⅰ型原发性高草酸盐尿症(type Ⅰ primary hyperoxaluria,PH1)是一种常染色体隐性遗传病,由于肝脏缺乏丙氨酸乙二醛转移酶导致乙二醛代谢异常,最终转化为羟乙酸盐和草酸盐的蓄积,严重者发展为系统性尿酸盐沉积症,90%的患者将发展为尿毒症。PH1患者单独肾移植的效果极差,肝肾联合移植能纠正患者的代谢紊乱,保护肾功能。欧洲PH1移植研究组结果显示,肝肾联合移植的5年生存率为80%,证实了肝肾联合移植对PH1的疗效[2]。
同类疾病还有糖原贮积症Ⅰ型(von Gieke病)、α-半乳糖苷脂酶A缺乏症、卵磷脂-胆固醇转酰酶缺乏症等,同样是由于缺乏某一种酶而引起机体多器官损伤,其中肝脏、肾脏的功能损伤最为明显,需要选择肝肾联合移植的治疗方案。
1.3 终末期肝病合并肾损伤或终末期肾病合并肝损伤
最常见的情况是终末期肾病的患者同时合并有慢性活动性肝病,如乙型肝炎或丙型肝炎等。肝肾联合移植对移植肾具有保护作用,且不会出现单器官移植后免疫抑制剂加重另一个器官功能损伤的情况。此外,合并Caroli's综合征的终末期肾病患者强烈建议行肝肾联合移植。
1.4 肝肾综合征(hepatorenal syndrome,HRS)
HRS是门静脉高压和肝功能衰竭所致的一过性肾功能损伤。因为由肝功能衰竭所致的肾功能损伤多为功能性的,随着肝移植术后肝功能逐渐恢复,肾功能多可恢复正常,因此,多数HRS仅行肝移植即可[3]。但近年来有研究显示,HRS有时可以在病理学上发现肾脏器质性病变,如免疫复合物的沉积、肾脏间质性改变等[4-5],因此对HRS患者选择肝肾联合移植还是肝、肾分次移植存在较大的争议,尚无定论[6-7]。
另外,肝肾联合移植可以作为治疗高致敏性尿毒症的有效手段。高致敏性患者由于既往肾脏移植、输血及妊娠等原因导致体内群体反应性抗体(PRA)水平显著高于正常人群,行肾移植术后极易出现超急性排斥反应,最终导致移植物功能丧失。因同源性移植物的肝脏对肾脏具有免疫保护作用,可以减少高致敏性患者肾移植术后超急性排斥反应的发生率,所以高致敏性尿毒症可以作为肝肾联合移植或辅助性肝肾联合移植的一个少见适应证[8-9]。
2 手术方法
肝肾联合移植手术采用与单纯的肝移植和肾移植相同的技术方法,采取先行肝移植后行肾移植的手术顺序,待肝脏恢复血液供应后再将肾脏移植于髂窝。因为肝脏对冷缺血时间更加敏感,冷缺血时间不能过长;移植肝对移植肾有免疫保护作用;移植肾难以耐受肝移植过程中腔静脉阻断所造成的淤血损伤。对于高致敏性尿毒症患者的联合移植,如果采用辅助性肝移植,可考虑在脾窝行部分肝移植术。如果联合移植器官还包括胰腺、小肠、心脏,则手术顺序值得推敲。通常先行心脏移植,腹腔器官移植则先行肝脏移植,其次肾脏,最后移植其他器官。需要强调的是,联合移植需要格外注意肝脏流出道的建立,一旦出现因腔静脉狭窄导致的肝脏流出道梗阻,则会造成移植肾回流受阻,导致移植肾功能衰竭。对于异时性肝肾联合移植,如肝移植在肾移植之后进行,尽量采用背驮式肝移植,以减少移植肾的血流动力学紊乱。由于肝肾联合移植涉及多器官捐献,一般供体来源于尸体捐献,活体捐献难度较大,文献报道较少[10-11]。
3 免疫抑制剂使用
因为相同供体来源的移植肝脏对移植肾脏具有一定的免疫保护作用,联合器官移植术后多采用与单纯肝移植相同的免疫抑制方案,术前及术后早期选择性使用抗CD25单克隆抗体,术中给予应激剂量糖皮质激素,术后常规使用以他克莫司(FK506)或环孢素为主的三联免疫抑制方案,即FK506或环孢素+霉酚酸酯+激素。
4 肝脏联合肾脏移植的适应证把握
针对任何原因导致的肝脏和肾脏不可逆转的器官功能不全或衰竭,施行肝肾联合移植是临床上普遍认可的治疗方式。而对于合并肾脏功能损伤的终末期肝病患者,肾脏功能受损是否可逆决定了手术方式的选择。研究表明,由肝功能衰竭所致的肾功能损伤多为功能性的,随着肝移植术后肝功能恢复,肾功能多可逐渐恢复正常,因此,多数HRS可单独进行肝脏移植。但对于部分患者,肾功能在肝移植术后并不能够得到恢复,单独肝移植术后可能导致早期甚至长期肾功能障碍,需要肾脏替代治疗,即使其后获得肾脏移植,这一部分患者的死亡风险仍显著升高[12-14]。
2002年,美国启用终末期肝病模型(Model for end-stage liver disease,MELD)来评价肝脏移植的紧急度,并根据MELD评分决定器官分配,其中血肌酐(SCr)水平为MELD评分的主要计分项。采用MELD评分进行肝脏分配的规则使得肝移植受者中肾功能损伤的比例较MELD时代前明显增加,资料显示肝肾联合移植在MELD时代增长了3倍(图1),占到肝移植总量的6%[15-16]。
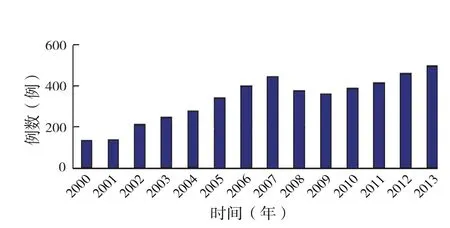
图1 2002年引入MELD评分前后美国器官获取和移植网络(OPIN)肝肾联合移植数量比较
肝肾联合移植患者往往年龄更大,病情更重,合并HRS,MELD评分较高,同时更易于获得高质量的供体。研究发现,术前无透析的患者行单独肝移植者术后生存率高于肝肾联合移植患者,而术前透析的患者行单独肝移植者术后生存率最低。还有研究提示,肝肾联合移植患者的移植肾脏存活率低于单独肾脏移植者,认为其与联合移植者术前高MELD 评分有关[17-18]。
术前评价终末期肝病患者的肾功能对预测肝移植术后肾功能能否恢复非常关键。目前,何种程度的肾功能损伤需要施行肝肾联合移植,尚缺少公认标准;现就相对有影响的判定标准简介如下(见表1)。

表1 已发表的肝肾联合移植指导建议
2006年,美国移植协会建议:SCr接近或超过正常上限的患者需要慎重评估[3]。肌酐清除率<30 ml/min的患者应施行肝肾联合移植。由HRS或AKI导致的急性肾脏功能丧失需行血液透析治疗者,被认为肾功能恢复的机会很小。建议透析6周可以作为行肝肾联合移植的适应证。对于未行血液透析的AKI患者,不需要行联合器官移植。对于肾小球滤过率(GFR)>30 ml/min的患者单独行肝脏移植,术后1年的生存率为82%,而仅有1.5%的患者需要追加肾脏移植。肾脏穿刺活检表现为持续损伤是施行肝肾联合移植的指征。肾脏穿刺活检并非常规检查项目,因为上述患者通常存在显著的凝血功能障碍,而关于活检的并发症并无明确报告。
2007年,美国移植协会等再次提出新的联合移植建议:SCr>132.6 μmol/L或超过基线0.8倍,持续超过1个月,具有肾损伤的危险因素如糖尿病、高血压、蛋白尿、肾脏替代治疗超过3周者需进行肝肾联合移植[19]。
2011年,OPTN制定了等待肝移植患者行肝肾联合移植的适应证原则[20-22]。即:① 持续4周以上的AKI(AKI定义和分级见表2)[23],并伴随以下条件之一者:a.AKI 3级;b.GFR≤35 ml/min(MDRD-6公式)或GFR≤25 ml/min(碘酞酸盐肾脏清除率);② 慢性肾病持续3个月并伴随以下条件之一者:a.GFR≤40 ml/min(MDRD-6公式)或GFR≤30 ml/min(碘酞酸盐肾脏清除率);b.蛋白尿>2 g/d;c.肾活检显示肾小球硬化≥30%或纤维化≥30%;d.代谢性疾病。
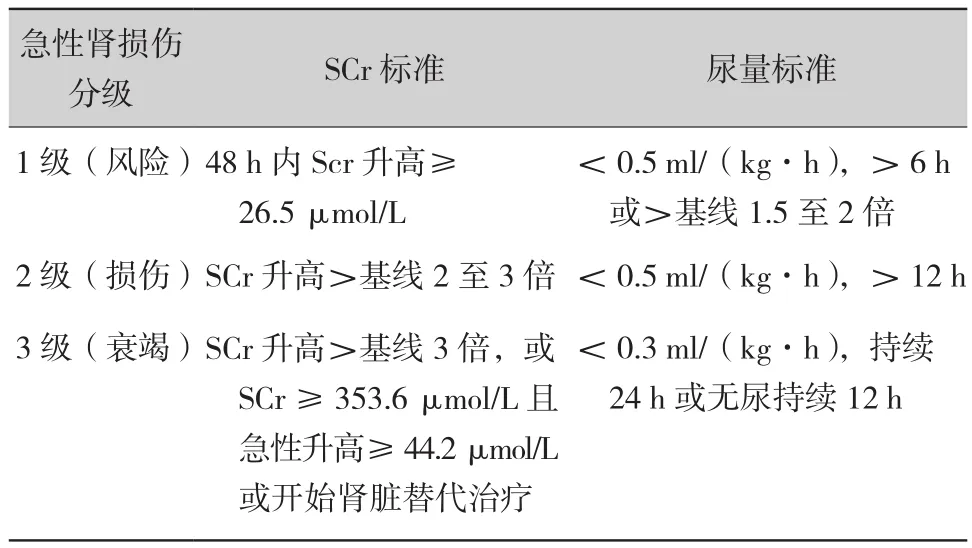
表2 改良RIFLE/AKIN制定的AKI定义和分级[23]
上述标准多以肌酐清除率作为判定指标;但以肌酐清除率评价肾功能的敏感性与特异性并不高。芝加哥西北大学移植中心Levitsky等[24]对665例肝移植患者及155例肝肾联合移植患者进行研究,通过对原肾及移植肾核素扫描检查,发现联合移植术前肾图异常小于3个月与术后原肾功能恢复异常密切相关,与术前GFR≤20 ml/min相比更具敏感性,提示术前肾图评价原肾功能对于预测肝移植术后恢复程度具有帮助。还有研究者尝试利用其他生物标志物来判断肾脏损害程度,其中包括中性粒细胞明胶酶相关脂质运载蛋白、半胱氨酸蛋白酶抑制剂cystatin C、白细胞介素-18、A1微球蛋白、B2微球蛋白、三叶因子3以及脂肪酸结合蛋白等,但尚未获得更为满意的效果[25-29]。
肝肾联合移植开展至今已有30年历史,取得了很大的成绩。但对终末期肝病患者施行肝肾联合移植术前仍面临多种抉择:是否需要进行联合移植或单独肝移植,联合移植术后是否出现原肾功能恢复造成器官浪费,单独肝移植是否会加速原肾功能衰竭,联合移植或有目的序贯的肝肾移植哪一种治疗方式更合理,术前肾活检对决策有多大程度的帮助,活检安全性评价等等诸多问题还需要我们进一步研究探讨。
