利用供者髂动脉搭桥的腔静脉回流式胰肾联合移植术
2014-11-23宋文利郑建明赵杰冯钢莫春柏沈中阳天津第一中心医院移植外科天津市器官移植重点实验室天津100039
宋文利,郑建明,赵杰,冯钢,莫春柏,沈中阳(天津第一中心医院移植外科,天津市器官移植重点实验室,天津100039)
胰肾联合移植是糖尿病合并终末期肾病患者的有效治疗方法,成功的胰肾联合移植不仅能治愈糖尿病、终末期肾病,而且能延缓甚至逆转糖尿病相关并发症。目前胰腺移植的手术方式多种多样,移植胰腺内分泌部分的静脉回流方式一直是胰腺移植技术争论与讨论的焦点。移植胰腺的内分泌回流方式分为体静脉回流术式与门静脉回流术式。体静脉回流又可分为髂静脉回流和下腔静脉回流。本中心从2009年1月至2011年12月,对所有拟行胰肾联合移植术的35例患者施行了利用供者髂动脉搭桥的腔静脉回流式胰肾联合移植术,取得了满意的临床效果,现报告如下。
1 资料与方法
1.1 患者资料
糖尿病合并终末期肾病患者35例,男性28例,女性7例;年龄30~65岁,平均46.4岁。患者中1型糖尿病2例,2型33例;糖尿病病史10~36年,平均17.5年,应用胰岛素20~80 U/d。所有患者均已接受透析治疗,时间为1~22年。并发症包括高血压、视网膜病变、周围神经病变、周围血管病变。所有患者均为首次接受胰肾联合移植术,均为尸体供肾,供者年龄23~44岁,热缺血时间3~5分钟,冷缺血时间6~18小时。患者在人类白细胞抗原(HLA)配型为2-4-Ag-MM,术前群体反应性抗体(PRA)均<5%,淋巴毒试验阴性。
1.2 手术方式
1.2.1术前准备
术前1日充分透析;手术前夜进流食,并口服硫酸镁导泻,术前12小时禁食,术前6小时禁水,手术当日早晨清洁灌肠,术前留置胃管及尿管。
1.2.2供体切取
供体均来源于尸体供者,采用肝胰肾多器官联合切取法,灌注液为0~4℃UW液及肾保存液。供者采用腹部十字切口,进腹后游离腹主动脉,于腹主动脉分叉处插管开始灌注,初始灌注采用肾保存液2 000 ml,后期灌注采用UW液2 000 ml。于胰腺下缘肠系膜根部游离肠系膜上静脉插管灌注UW液,切开供体膈肌,剪开心耳建立流出道,切开供体胃窦部并置管,以0~4℃甲硝唑盐水(0.4 g/500 ml) 冲洗供体十二指肠,于空肠上段结扎、离断,十二指肠两端套入无菌手套以防止肠内容物外溢污染保存液。游离供体肝脏、肾脏、脾脏,整块切取肝胰肾脾,注意操作轻柔,防止胰腺损伤。供体器官切取完成后,剪开供体胆囊,排空胆汁后以冰盐水及UW液冲洗胆道,供体器官与完整切取的供者髂血管置于0~4 ℃UW液中保存。
1.2.3血管分配及供体修整
1.2.3.1供体肝脏及胰腺血管分配
距肝总动脉和胃十二指肠动脉分叉部0.5 cm处切断相关动脉,在十二指肠外缘处离断门静脉及胆总管,将肝脏与胰腺分离。
1.2.3.2供体修整
剔除胰腺及血管周围脂肪组织,切除脾脏,沿胰腺下缘分别结扎肠系膜下静脉、肠系膜上静脉及肠系膜上动脉,勿伤及脾静脉及肠系膜上动脉第一空肠支。结扎胆总管。端-端吻合肝总动脉及胃十二指肠动脉断端以重建供体十二指肠动脉弓。以闭合器闭合十二指肠幽门端,并浆肌层包埋。修剪供体胰腺的腹腔干-肠系膜上动脉之腹主动脉袖片。修整供体髂总静脉,与供体胰腺门静脉端-端吻合延长1~2 cm,其中30例患者没有进行门静脉延长。修整供体髂动脉,将供体髂内动脉断端与供肾动脉行端-端吻合备用,髂外动脉残端修整成斜面。
1.2.4受者手术
受者全身麻醉后取平卧位,手术切口选用腹部右侧经腹直肌切口进入腹腔,游离右侧髂外动脉、髂外静脉及下段腔静脉备用。将供肾静脉与受者髂外静脉行端-侧吻合,将供体髂总动脉与受者髂外动脉行端-侧吻合,供体髂外动脉以动脉夹暂时夹闭,开放血管恢复移植肾血供。右侧髂窝侧腹膜行十字切开后钝性游离,将供肾置于腹膜外,缝合腹膜数针以固定供肾,切开膀胱区腹膜约4 cm,将供肾输尿管经腹膜外隧道穿至膀胱底与膀胱吻合,缝合膀胱区腹膜。取供体胰腺,将供体胰腺门静脉与受者腔静脉行端-侧吻合,将腹腔干-肠系膜上动脉之腹主动脉袖片与备用之供体髂外动脉残端行端-端吻合,开放胰腺血流,彻底止血。供体十二指肠与受者的回肠段,以21#吻合器行侧-侧吻合术,闭合供体十二指肠残端,并浆肌层包埋。腹腔内彻底止血后放置肠道吻合口后方及盆腔引流管。具体见图1。
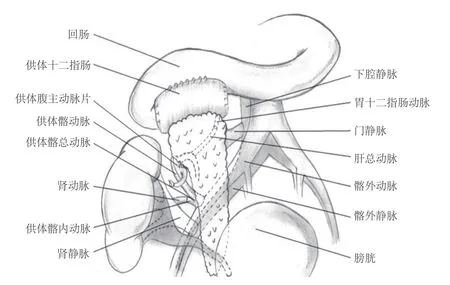
图1 受者手术示意图
1.3 术后处理
1.3.1术后一般处理
术后保留胃肠减压,待患者胃肠道功能恢复后拔除胃管。术中及术后采用第三代头孢菌素及甲硝唑预防感染,如出现感染,则根据细菌培养及药敏结果调整抗菌药物。每4小时测血糖1次,每6小时测血清及引流液淀粉酶1次,每日超声监测胰腺及肾脏血流。生长抑素0.1 mg皮下注射,每8小时1次,2周后停用。术后常规给予低分子右旋糖酐抗凝,术后1周加用拜阿司匹林100 mg,每晚1次,如患者巨细胞病毒(CMV)-pp65和(或)CMV-DNA结果阳性,可按照10 mg/(kg·d)的剂量静脉滴注更昔洛韦。
1.3.2免疫抑制方案
免疫诱导采用抗胸腺细胞球蛋白(ATG)减激素方案:手术当天及术后1、2、3天给予ATG,总量6 mg/kg,术后4天开始口服泼尼松10 mg/d,术后1天开始加用骁悉750 mg,每12小时1次,血清肌酐下降至270 μmol/L后加用他克莫司(FK506)或者环孢素A。
2 结 果
2.1 一般结果
所有患者的移植胰腺及肾脏均于术后1周内恢复正常。术后住院时间为10~33天,平均22天,住监护室时间为1~4天,平均2.4天。所有患者中,采用FK506 +吗替麦考酚酯( MMF) +泼尼松(Pred)联合免疫方案33例,其中1例术后1年因血糖偏高将FK506改为雷帕霉素;采用环孢素A +MMF +Pred联合免疫方案2例。所有患者中发生移植肾功能延迟恢复3例,排斥反应发生率为0。患者出院时平均血清肌酐为78 μmol/L,空腹血糖为4.4 mmol/L,糖化血红蛋白为4.3%。
2.2 术后并发症
供体十二指肠与受者回肠吻合口出血2例,其中1例表现为黑便,血红蛋白无明显下降,未予特殊处理;另外1例表现为暗红色血便,血红蛋白下降,输注红细胞(RBC)4 U后治愈。伤口愈合不良4例。术后腹腔感染4例,均为手术部位的感染,腹腔感染发生率为11.4%;其中2例在给予抗菌药物治疗后治愈;1例合并伤口愈合不良,手术清理后治愈;1例穿刺引流后治愈。3例患者出现需手术干预的外科并发症,术后再次手术率为8.6%;其中1例患者术后4个月发生粘连性肠梗阻,予手术松解后治愈;1例患者术后1周内出现胰腺广泛血栓形成,予手术切除移植胰腺,后出现腹腔感染,切口裂开,予手术清理、缝合后治愈;1例患者术后7小时出现移植肾破裂,切除,胰腺移植后5个月行二次肾移植术(左侧腹)。
2.3 远期并发症
肺感染5例,死亡1例;泌尿系统感染1例,CMV感染2例;FK506的脱髓鞘病变1例。
2.4 随访
术后随访32~58个月,术后6个月的平均血清肌酐为82 μmol/L,空腹血糖为4.8 mmol/L,糖化血红蛋白为4.5%;1例患者术后4个月死于肺感染,其余全部存活,患者、胰腺、移植肾的1年存活率分别为97.1%、94.2%、94.2%。
3 讨 论
胰肾联合移植是目前国际上最常用的胰腺移植方式,不仅可以提高患者的生活质量,延长糖尿病肾病患者的生存期[1],而且可以阻止和逆转糖尿病的并发症[2]。其优点是只需一次手术能同时根治糖尿病及终末期肾病,只有一种异体组织相容性抗原来源,手术效果较好,免疫抑制治疗与单纯肾脏移植(KTA)相似,比KTA有更好的患者存活率及移植物的半寿期[3-4]。对于2型糖尿病,胰腺移植有着与1型糖尿病相似的远期效果[5],胰岛细胞移植也是目前较为有效的治疗方法[6]。
以往的研究侧重于胰腺外分泌的处理及静脉回流方式的选择,对于动脉重建的研究相对较少。Pintilie等[7]研究发现部分病例的胰十二指肠上下动脉并不在胰头形成完整的动脉弓,而是由胰十二指肠上下动脉分别供血。李杰群等[8]对300例胰腺动脉造影进行回顾性分析,发现胃十二指肠动脉分支胰十二指肠上前动脉及胰十二指肠上后动脉与胰十二指肠下前动脉及胰十二指肠下后动脉分别有15.19%及24.05%的缺失率,此外,胃十二指肠动脉尚发出胰横动脉(12.98%)供血于胰体尾部,显示在胰腺移植手术中放弃重建胃十二指肠动脉具有很大的风险性。目前多数移植中心采用将供体脾动脉吻合至供体肠系膜上动脉侧壁,将腹腔干留给供肝,这种动脉分配方法存在一定的缺陷。因此,我们在供体胰腺修整过程中将肝总动脉与胃十二指肠动脉分叉部留给供肝,供体胰腺采用肝总动脉-胃十二指肠端-端吻合重建供体十二指肠动脉弓,改善了十二指肠的血液供应,避免了因供体修整过程中误伤胰十二指肠下动脉(发自肠系膜上动脉)导致的十二指肠缺血坏死,并且可增加供体胰腺门静脉的回流血量,有利于减少门静脉血栓的发生。
目前,胰肾联合移植手术多是利用左髂动脉系统及右髂动脉系统分别提供移植肾及移植胰腺动脉血供,而对于糖尿病患者来说,往往存在较严重的周围血管病变,在此,我们利用单一的供体髂动脉系统同时供应移植胰腺、肾脏,不仅可以减少在受体严重钙化周围血管上的操作次数,从而避免血管钳夹闭不全、髂动脉内膜剥脱、远端栓子形成等并发症的发生,而且,手术操作均位于右侧中下腹,使移植物特别是移植胰腺的血管吻合相对表浅,操作简单,尤其是对于骨盆狭小或肥胖患者。Tso等[9]2003年最先报道了以供体髂总动脉搭桥,移植肾动脉吻合到供体髂内动脉的胰肾联合移植术式,但该术式对于移植胰腺的静脉回流选择了受者的肠系膜上静脉,供体胰腺位于上腹部,一旦受者术后出现肠瘘或腹腔感染会导致弥漫性腹膜炎,威胁患者生命,这是胰腺移植术后造成移植物丢失及患者死亡的重要原因[10-14]。本中心的该术式手术操作局限于右中下腹,减少了手术对腹腔的干扰及严重腹腔感染的发生率,本组手术腹腔感染发生率为11.4%,从本组临床资料看均提示感染局限于移植胰腺的胰头位置,而且预后良好。
而传统的肠道引流的胰肾联合移植胰头十二指肠指向上方,供体门静脉与受者髂外静脉吻合口位置深,操作困难,易导致门静脉冗长,在摆放胰腺时极易导致门静脉扭转或者脾静脉与门静脉夹角过小,导致静脉血栓形成的机会较大。本中心将供体门静脉与受者肠系膜上静脉吻合改为供体门静脉与受者腔静脉吻合后,移植胰腺可置于下腹部,使手术操作相对表浅,手术难度明显下降,而且采用腔静脉回流的方式可能使胰腺摆放后其脾-门静脉夹角符合生理,增加了胰腺的门脉血流量,降低胰腺静脉血栓形成的发生率[15],本组患者术后均未采用肝素抗凝,仅使用低分子右旋糖酐和拜阿司匹林,本组患者1例出现血管栓塞情况,考虑与该病例供体胰腺冷缺血时间较长(18小时)有关。
总之,笔者认为该术式有以下优点:① 仅需使用一侧髂血管,对于左侧存在严重髂血管病变,无法进行血管吻合的患者同样可以手术[9];② 减少了1次在受者病变血管上进行吻合的过程,降低了血管吻合并发症的发生率[9];③ 为患者再次肾移植保留了一侧血管;④ 对于在左髂窝曾经进行过肾移植的患者仍然可以施行胰肾联合移植术;⑤ 由于移植胰腺的位置在右中下腹,使术后可能发生的腹腔感染易于局限化,降低了手术干预率及移植物丢失的发生率。当然,由于该技术为首次应用,病例数量相对较小,在对胰肾联合移植术后移植物的远期存活的影响方面仍需进一步研究。
