重组大肠杆菌DE-pET-P46的培养基优化和高密度发酵
2014-11-23沈青春张纯萍高和义李聪研魏晶晶宋萧婷宁宜宝
沈青春,王 芳,张纯萍,高和义,宋 立,李聪研,魏晶晶,宋萧婷,苏 鹏,宁宜宝∗
(1.北京中海生物科技有限公司,北京100081;2.中国兽医药品监察所,北京100081)
重组DNA技术和发酵工程的快速发展和结合,使得大量制备某种特定蛋白成为可能。大肠杆菌和酵母菌是当前表达外源蛋白的两种常用宿主细胞,高细胞密度发酵(high cell density cultivation,HCDC)是指在一定条件和培养体系下,使菌体密度较普通培养有显著提高,从而更多地或更高效地获得目的产物的发酵技术,其在工业化上的应用带来的经济效益十分显著[1-2]。
影响发酵过程的因素很多,包括培养基组成、pH、温度、装液量、接种量、种龄、搅拌与通气等条件,而这些条件通常并不独立影响发酵过程,而是存在交互作用。发酵工艺的优化就是将影响过程的所有关键因素达到最佳值,从而使产率最大化,一般步骤包括:影响因子的确认;确定各影响因子的影响程度并筛选因子;根据试验目的和影响因子影响程度,确定优化方案进行试验;对实验结果进行数学统计分析,确定其最佳条件;最后对最佳条件进行验证[3-4]。
随着统计学和计算机应用技术的发展,新的优化方法不断涌现,但总体上可分为非统计学优化技术和统计学优化技术两类。非统计学优化技术,即传统的单次单因子法(One Factor at One Time),每次只改变一个因子而其它因子保持不变,优化方法直观有效。统计学优化技术是利用统计学原理对多个因素进行试验设计,再对结果进行统计分析得到最佳配比,主要方法包括响应面法[5-6]、最陡爬坡法[7-8](Steepest Ascent)、进化操作法[9](Evolutionary Operation)、典型分析法[10](Canonical Analysis)、Gauss-Seidel法、Nelder-Mead单纯形法等,其中响应面法是近年来应用最多的一种优化技术[11]。该方法是1951年Bos-Wilson研究用于化学过程因子优化的一种综合性方法,其基本原理是用数学模型来描述实验的影响因子与目标响应值间的关系,并以此为据,确定在目标响应值达到最高或最低时各因子的最佳条件。该方法能在有限实验次数下,确定各因子对目标响应值的影响,探清其交互作用的程度,最后求得其最优化条件[12-13]。
大肠杆菌DE-pET-P46是可以高效表达猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)的 P46蛋白的重组基因工程菌。Mhp是引起猪地方流行性肺炎(Swine Enzootic Pneumoniae of Swine,EPS)的一种病原微生物,其P46蛋白是其独有的种特异性蛋白。将P46基因亲水区克隆到pET28a(+)质粒上,再转化BL21(DE3)大肠杆菌得到重组大肠杆菌DE-pET-P46,通过IPTG诱导可实现重组蛋白rP46的高效表达[14]。本研究拟以重组大肠杆菌DE-pET-P46为例,主要针对培养基进行优化,以期望得到一种可以在生物反应器中实现重组大肠杆菌高密度发酵的培养基配方。试验首先对各类营养成分进行考察并确定哪些为影响因子,再采用响应面法设计并进行实验,使用SAS统计学软件对实验结果进行统计分析,确定各营养成分的最佳配比,以实现当前实验室培养条件下大肠杆菌重组菌培养密度的显著提高,并初步探索使用生物反应器培养所能达到的菌体浓度及其对重组菌的表达是否存在影响。
1 材料与方法
1.1 材料
1.1.1 菌种 重组大肠杆菌DE-pET-P46由本实验室构建并保存。
1.1.2 主要仪器 恒温摇床(上海苏坤SYY-200B)、电子分析天平(赛多利斯 AL104)、紫外分光光度计(BENKMAN公司UV-800型)、台式高速冷冻离心机(Sigma 3K-18)、生物反应器(NBS Bioflo410型)。
1.1.3 主要试剂 蛋白胨、酵母粉购自GIBICO公司;葡萄糖、蔗糖、乳糖及无机盐等购自北京化学试剂公司。
1.2 方法
1.2.1 重组菌培养和光密度测定 将新转化的DE3-pET-p46菌挑单菌落,接入20 mL LB(Kan+)培养基中37℃ 200 r/min振摇培养18~20 h后作为试验用菌种。按照0.5%的接种量将新转化的DE3-pET-p46菌液接入3个装有50 mL试验发酵培养基的三角瓶中,37℃ 200 r/min振荡培养16 h后,取3个重复样品,分别测定其光密度A600值或湿菌重,计算平均值。
1.2.2 培养基成分的确定
1.2.2.1 25%酵母浸出液和酵母粉对比试验 使用25%酵母浸出液替代LB培养基中的酵母粉成分配制培养基,分别按5%、10%、、15%、20%、30%的比例设立6个梯度配制培养基,其他成分不变,并设普通LB培养基作为对照,按照1.2.1的方法培养和测定DE-pET-P46重组菌,以确定最佳的添加浓度。
1.2.2.2 缓冲系统的选择 根据25%酵母浸出液和酵母粉对比试验结果,将使用酵母浸出液的LB培养基,分别使用钾离子磷酸盐和钠离子磷酸盐以及二者搭配组成pH缓冲系统,按照以下配方配制培养基。
培养基 1(g/L):蛋白胨 10.0 g、25%酵母浸出液 100 mL、葡萄糖 5.0 g、K2HPO4·3H2O 18.0 g,KH2PO43.0 g,即钾盐缓冲体系培养基。
培养基 2(g/L):蛋白胨 10.0 g、25%酵母浸出液 100 mL、葡萄糖 5.0 g、Na2HPO4·12H2O 12.0 g,NaH2PO4·2H2O 2.0 g,即钠盐缓冲体系培养基。
培养基 3(g/L):蛋白胨 10.0 g、25%酵母浸出液100 mL、葡萄糖 5.0 g、Na2HPO4·12H2O 16.5 g,KH2PO41.5 g,即钠盐缓冲体系培养基。
培养基 4(g/L):蛋白胨 10.0 g、25%酵母浸出液100 mL、葡萄糖 5.0 g、NaCl 10.0。
以上4种培养基分别调pH至7.2后,116℃30 min高压灭菌,按照1.2.1的方法培养和检测DE-pET-P46重组菌。
1.2.2.3 能量组分的优化 在培养基1配方中,对葡萄糖的浓度进行优化和替换,分别加入葡萄糖、蔗糖和乳糖至终浓度5 g/L。根据以上实验结果设计培养基配方,培养16 h后测定其细胞密度A600值。
1.2.3 培养基的优化 根据Box-Behnken的中心组合设计原理,设计了四因素三水平的响应面分析(RSA)试验,共有 27 个试验[5,11-13]。 本实验为了简便起见,省去第一步直接选用蛋白胨(X1)、25%酵母浸出液(X2)、蔗糖(X3)、10×钾离子平衡盐(X4)4个因素为自变量,以培养物菌体密度为响应值。试验因素与水平的选取见表1。
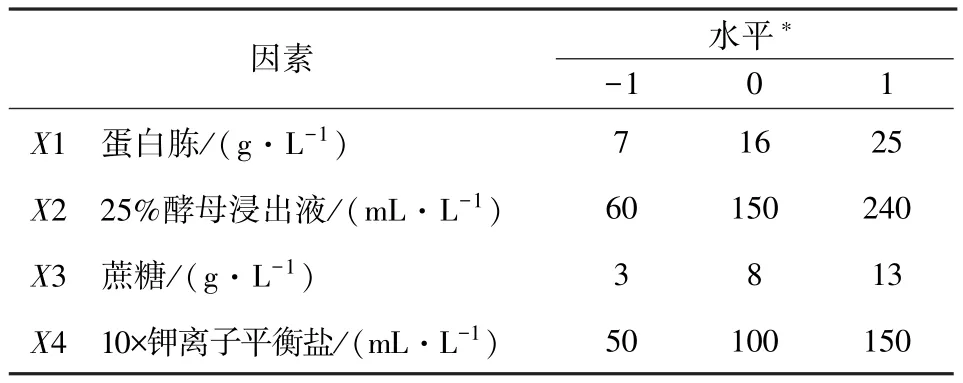
表1 试验1 Box-Behnken设计的因素与水平取值表
对27个试验进行实验,将每组实验吸光值A600的测定结果作为反应值,使用SAS软件对其进行响应面分析,得到反应值的回归方程,通过求一阶偏导数得到各因素的最佳值和对应的最高反应值。
根据试验1的优化结果进行二次优化,由于25%酵母浸出液最佳添加量可能很大,不符合降低成本的要求,将其固定在10%,重新引入酵母浸出粉,考虑到蛋白胨与25%酵母浸出液的互作关系极显著(X1∗X2的P值小于0.01),新设计的试验包括3个因素,即蛋白胨、酵母浸出粉和蔗糖,见表2。
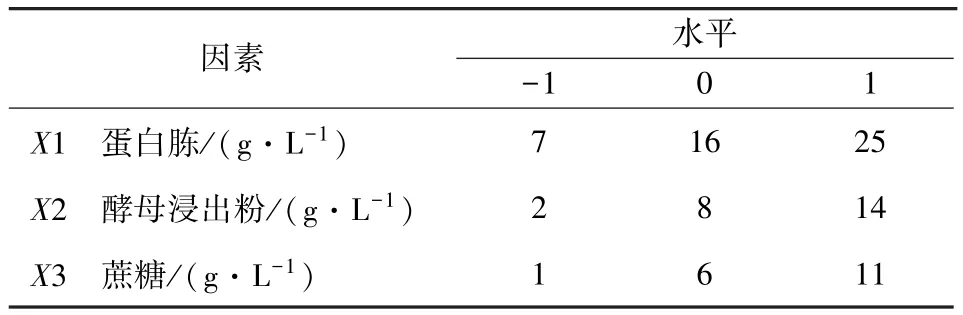
表2 试验2 Box-Behnken设计的因素与水平取值表
对三因素三水平试验设计,共需15个试验,反应值为每组的吸光值A600测定结果,使用SAS软件对其进行响应面分析,得到反应值的回归方程,通过求一阶偏导数得到各因素的最佳值和对应的最高反应值。
1.2.4 优化后培养基的验证 为试验模型的准确性,按照优化的培养基配方配制5瓶100 mL培养基,37℃振摇培养16~18 h后收获,测定其细胞密度值A600和湿菌重。
1.2.5 生物反应器高密度培养初步试验 按照优化的培养基配方配制发酵培养基,使用NBS Bioflo 410型生物反应器(最大容积14 L)进行发酵,接种量0.5%,发酵总体积8 L,反应温度37℃,溶氧控制20%,使用20%葡萄糖和氨水维持pH 6.4~7.6,反应24 h加入IPTG诱导,32 h收获。将收获的菌液进行A600测定细胞密度,算出每毫升菌体湿重。将收获的菌体洗涤、裂解、离心提取包涵体,使用SDS-PAGE检测,比较其与通过振摇培养的DE-pET-P46重组菌间是否存在差别。
2 结果与分析
2.1 培养基成分确定 以不同浓度25%酵母浸出液替代LB液体培养基中酵母粉,对基因重组菌培养效果的影响见图1。可以看出,使用酵母浸出液替换LB中酵母粉可明显增加大肠杆菌的细胞浓度,随着酵母浸出液的量增加,细胞浓度先增加后下降,最佳添加量为10%。
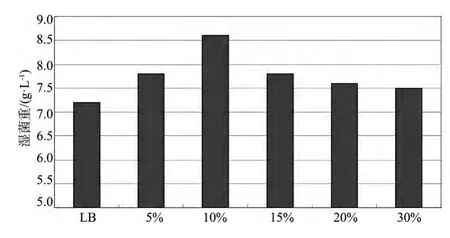
图1 不同比例的25%酵母浸出液替换LB中酵母粉对大肠杆菌重组菌生长的影响
在改良的LB培养基中引入钾盐或钠盐缓冲系统,其培养效果如图2。可以看出,引入磷酸盐缓冲体系能显著改善培养基的大肠杆菌培养浓度,其中培养基1(磷酸钾盐缓冲体系)好于磷酸钠盐及钾钠混合缓冲体系,培养基1、2、3均好于无缓冲体系的培养基4。
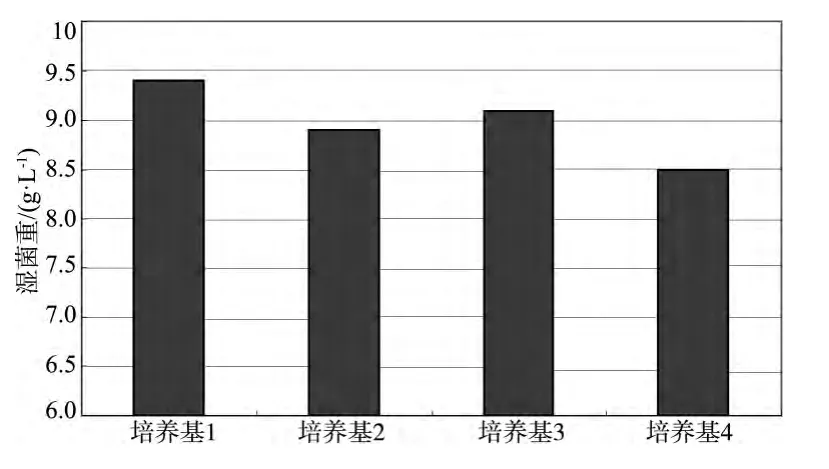
图2 引入缓冲系统后的改良培养基对大肠杆菌重组菌生长的影响
在培养基1的基础上,分别使用5 g蔗糖或乳糖替代葡萄糖,以比较3种糖作为碳源对重组菌培养密度的影响,结果如图3。结果表明,培养基中加入3种糖对培养效果没有明显区别,但从生产的角度上讲,蔗糖最经济。
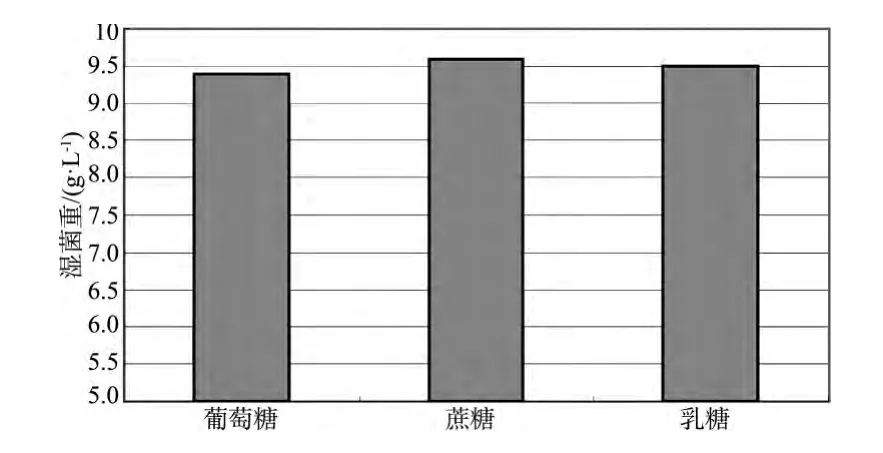
图3 使用葡萄糖、蔗糖和乳糖作为碳源的改良培养基对大肠杆菌重组菌生长的影响
2.2 培养基优化结果 根据Box-Behnken的中心组合设计原理,设计的四因素三水平的响应面分析(RSA)试验,共有27个试验的相应值(A600)的测定结果见表3。
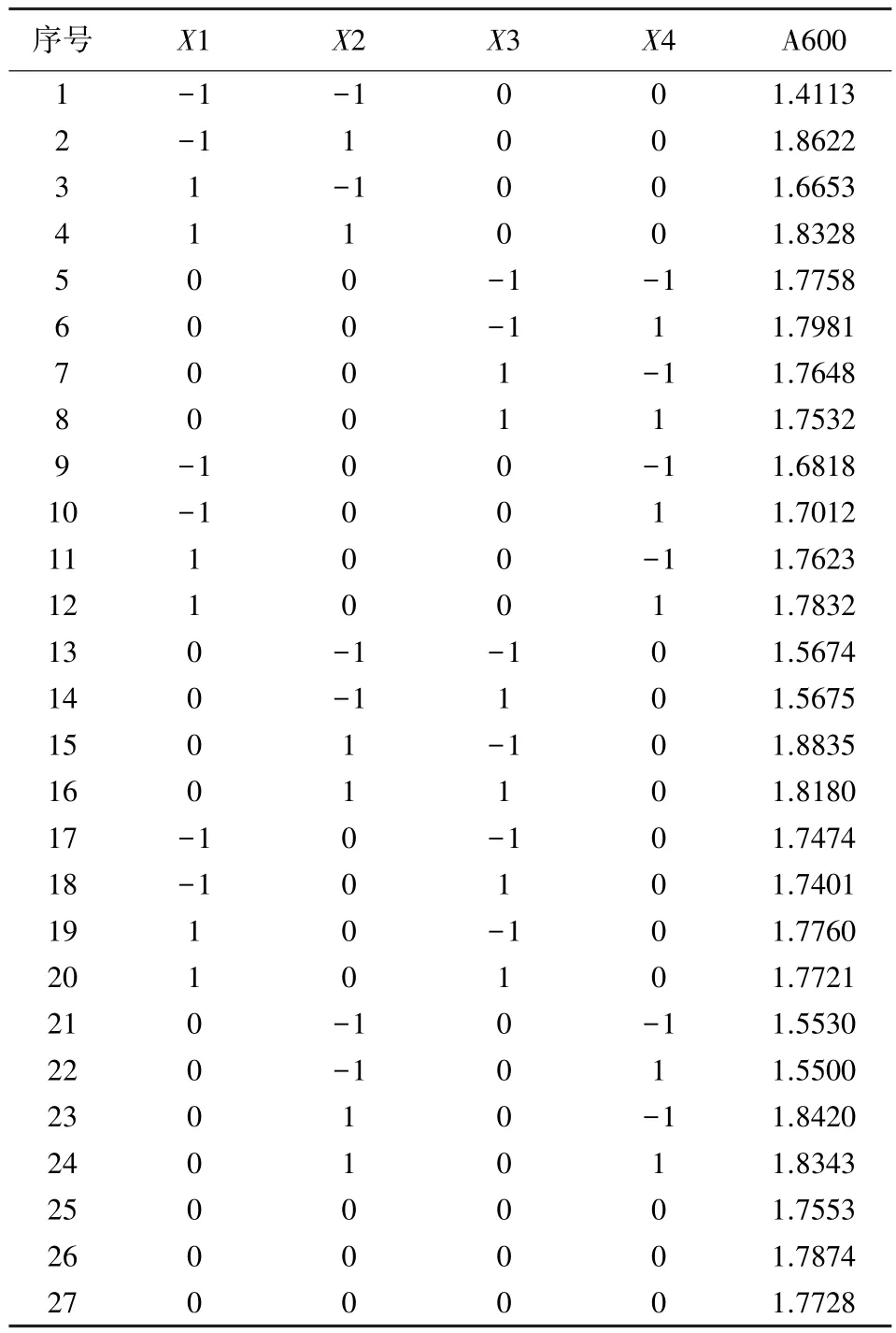
表3 优化试验1响应面分析试验设计及结果
通过SAS的响应面回归(RSREG)进行数据分析,建立二次响应面回归模型,并进而寻求最优响应因子水平。经整理后所得的分析结果如表4。
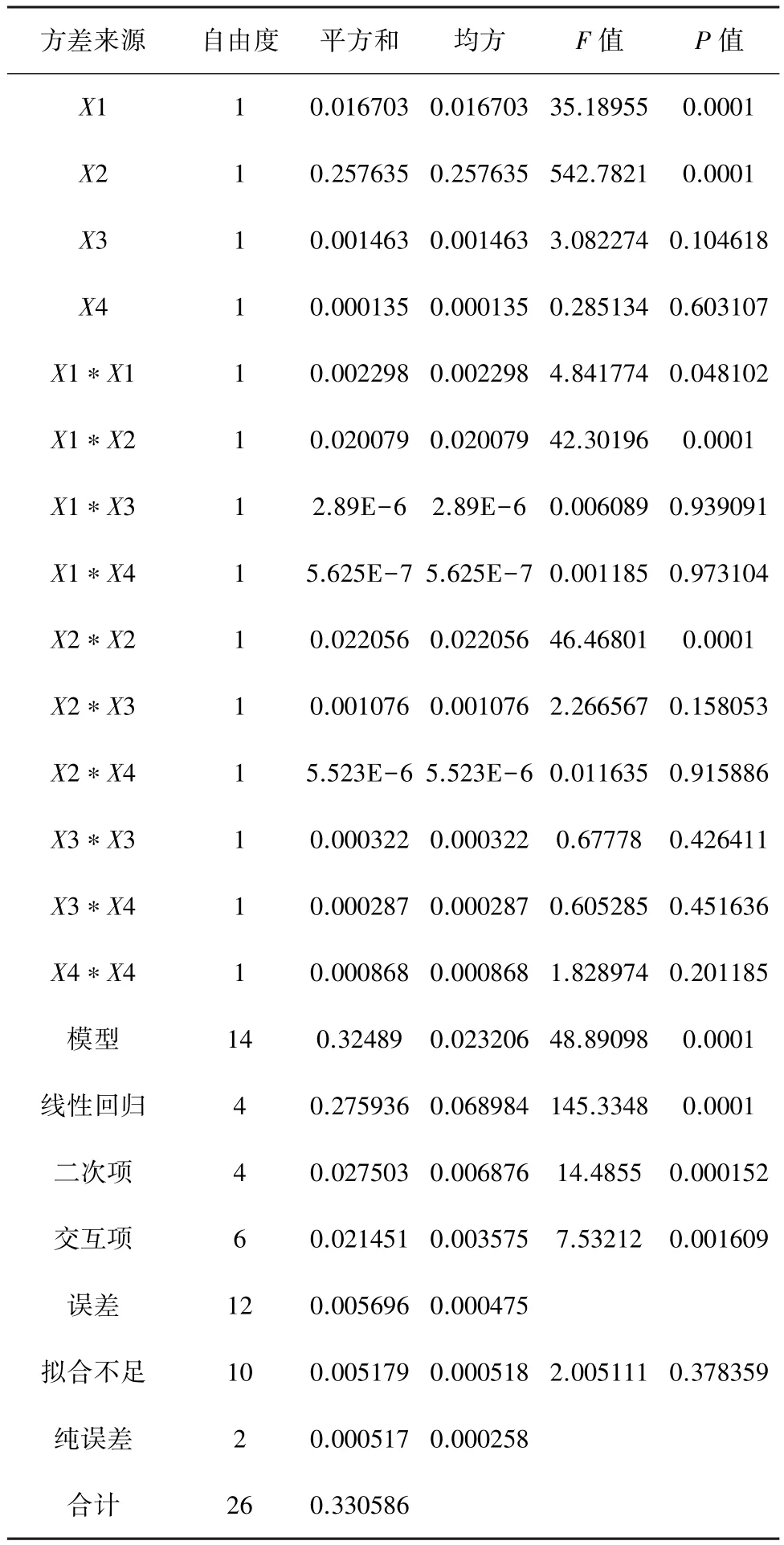
表4 二次多项回归模型方程方差分析
四个因素中X1、X2的P值仅为0.001,也均远小于0.01,表明 X1(蛋白胨)和 X2(25%酵母浸出液)对反应值Y(A600)的影响极显著;X3的P值为0.105,大于 0.05,表明 X3(蔗糖)对反应值Y(A600)有一定的影响,但不显著;X4的P值为0.603,表明X4(10×钾盐平衡盐浓度)对反应值 Y(A600)的影响不明显;X1∗X2的P值也仅为0.001,表明 X1(蛋白胨)和X2(25%酵母浸出液)相互间影响极显著。
二次项和交互项的P值也均远小于0.01,说明二次项和交互项的拟合程度很好。
使用SAS软件对上述试验结果作RSREG多元回归分析,得出以 Y为因变量,X1、X2、X3、X4为自变量的四元二次回归方程,对其求极值,得出Y的最大值为1.91,对应各因素的值的位点分别为X1=-0.825,X2=1,X3=-1,X4=0.406,转换成培养基成分即为蛋白胨 8.6 g/L、25%酵母浸出液240 mL/L、蔗糖 3.0 g/L、钾离子平衡盐 1.2 mL/L。由此可见25%酵母浸出液和蔗糖分别取了试验最高值和最低值,即这两个因素的最佳值可能在试验水平范围之外,重新设计试验。
根据试验1的结果进行二次优化,25%酵母浸出液添加量,重新引入酵母浸出粉。新设计的试验包括3个因素,即蛋白胨、酵母浸出粉和蔗糖。再次按照Box-Behnken的中心组合设计原理,设计的三因素三水平的响应面分析(RSA)试验2,共有15个试验,试验结果如表5。
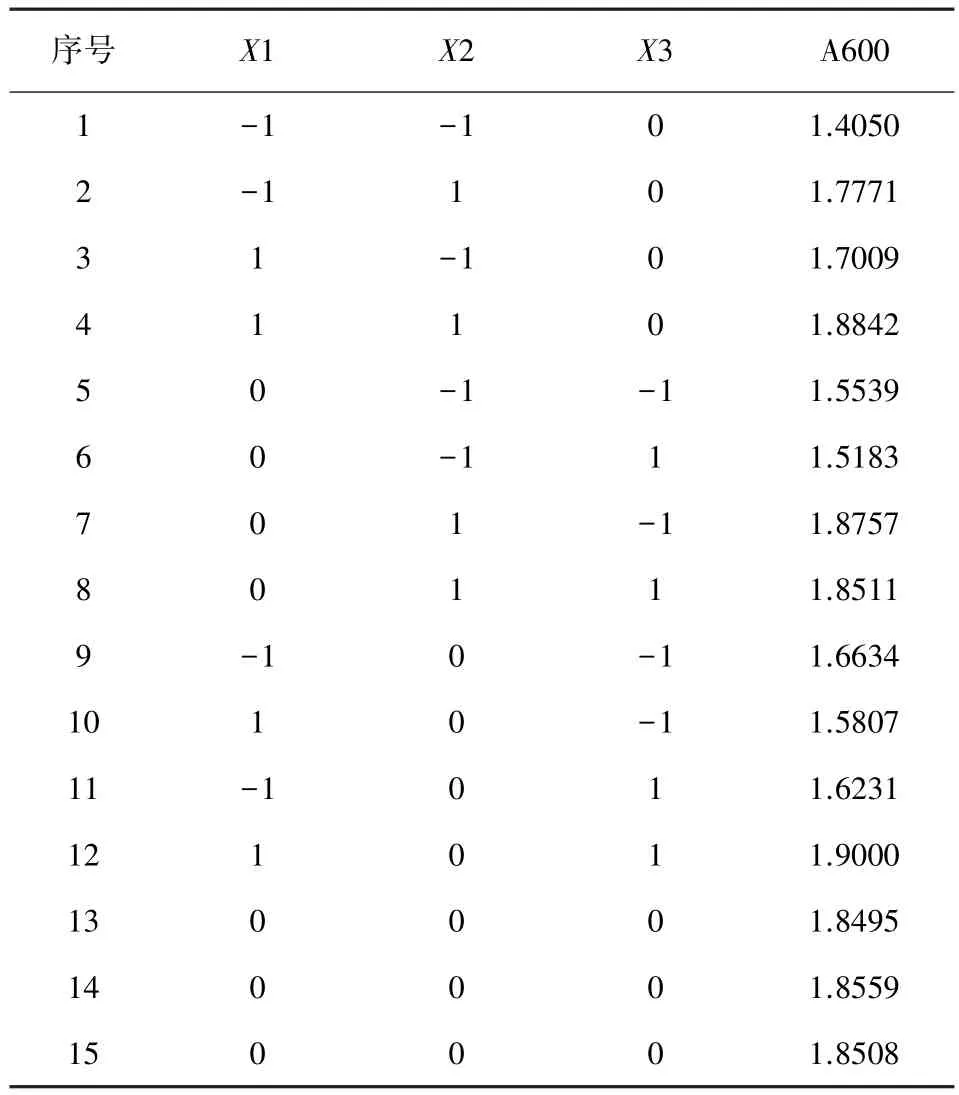
表5 优化试验1响应面分析试验设计及结果
通过SAS的RSREG功能进行数据分析,建立二次响应面回归模型,并进而寻求最优响应因子水平,经整理所得的分析结果如表6。

表6 二次多项回归模型方程方差分析
三个因素中X1、X2的P值小于0.05,表明X1(蛋白胨)和X2(酵母浸出粉)对反应值 Y(A600)的影响显著;X3的P值为0.287,大于0.05,表明X3(蔗糖)对反应值Y(A600)有一定的影响,但不显著;X1∗X3的P值小于0.05,表明X1(蛋白胨)和X3(蔗糖浓度)相互间影响显著。
使用SAS软件对上述试验结果作RSREG多元回归分析,得出以Y为因变量,X1、X2、X3为自变量的三元二次回归方程,对其求极值,得到Y的最大值为1.94,对应各因素的值的位点分别为 X1=0.447,X2=0.863,X3=0.459,转换成培养基成分,即为蛋白胨蛋白胨20.1 g/L、酵母浸出粉13.2 g/L、蔗糖8.3 g/L。结合试验设计所固定的条件和培养基配制的方便性,优化后的培养基配方为:胨蛋白胨 20.0 g/L、酵母浸出粉13.0 g/L、25%酵母浸出液100 mL/L、蔗糖 8 g/L、K2HPO4·3H2O 10.0 g,KH2PO43.0 g。
2.3 优化后的培养基验证结果 按照优化的培养基配方配制3瓶100 mL培养基,设置LB和培养基1作为对照,按0.5%的接种量接种DE-pET-P46重组菌,37℃振摇培养16~18h后收获,测定其细胞密度值A600,计算湿菌重。表7结果显示,经过优化后的培养基较LB培养基的菌体浓度高出一倍左右,培养基优化试验基本达到预期目标。
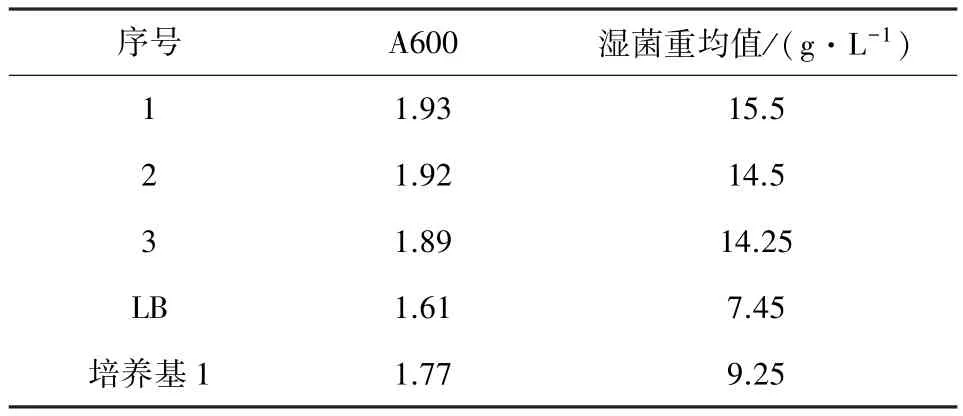
表7 优化培养基的验证试验结果
2.4 生物反应器高密度培养初步试验结果 采用优化后的培养基配方配制发酵培养基,使用生物反应器培养DE-pET-P46重组菌菌体,培养24 h后,取样测定吸光值A600和菌体湿重,结果分别为2.52和39.5 g/L,菌体浓度是振摇培养的2.7倍。
将生物反应器培养、IPTG诱导后收获的DE-pET-P46重组菌菌体与普通振荡培养诱导的重组菌体分别进行洗涤、裂解后提取包涵体,使用SDS-PAGE检测结果如图4。图4结果表明,使用生物反应器培养的重组大肠杆菌DE-pET-P46相比振摇培养,在重组蛋白rP46的表达量和包涵体占细胞总蛋白的比例上均没有明显的差异。
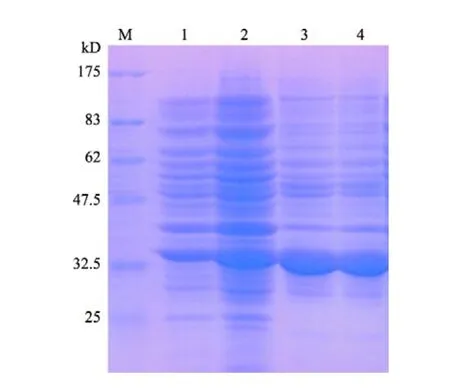
图4 使用生物反应器和振摇方法培养的DE-pET-P46重组菌SDS-PAGE电泳图
3 讨论
高密度发酵不仅可以减少培养体积,便于下游分离纯化,还能缩短生产周期,提高培养基使用效率。通常认为大肠杆菌菌体干重达到或超过50 g(DCW)/L即为高密度发酵。根据Riesenberg的计算结果,大肠杆菌发酵理论上能达到的最高菌体密度为 400 g(DCW/L)[15],考虑到实际培养中受到各种条件限制,Markel等认为最高的菌体密度为200 g(DCW/L),此时发酵液的 25% 充满了长3 μm、宽1 μm的大肠杆菌,发酵液粘度很高,几乎丧失流动性[16]。迄今为止,大肠杆菌发酵菌体密度最高的两例报道,一例是非重组E.coli W3110的高细胞密度发酵,每升干细胞重达到174 g[16-17];另一例是生产聚-3-羟基丁酸的重组菌达,每升干细胞重达175.4 g[18],但近年来没有干重超过100 g/L的报道。
通过统计学方法设计试验对培养基的成分和添加量进行优化,在国内外已有很多的报道[15,19-20]。 本研究主要是对发酵培养基进行优化研究,以期望实现实验室内的重组大肠杆菌DE-pET-P46的高密度发酵。采用的策略是以LB培养基为基础,对几种常用营养成分及pH缓冲体系进行试验,然后确定关键的组份使用SAS统计软件的响应面试验设计进行试验,通过对试验结果进行统计分析,得到最佳的各培养基组份的添加量。
在菌液中细菌浓度可通过光密度值来体现,国内外相关文献显示测定所使用的波长有两种,即560 nm和600 nm,但二者间有何差别与优势,未能找到相关文献说明。在本研究开始之前,本实验室对560 nm和600 nm两种波长测定重组大肠杆菌DE-pET-P46培养物光密度的差异进行了比较,结果发现二者在所测范围内与湿菌重均具有很好的平行关系,但后者稍占优,表明A600更适合于测定本株重组大肠杆菌细胞密度,以LB不同培养时间的吸光值和菌体重建立的标准曲线,基本为一条直线,R2值达99%。
本研究在对营养成分进行筛选中发现,使用25%酵母浸出液替代酵母粉可获得更好的菌体密度,蔗糖替代葡萄糖培养效果相当,引入钾离子pH缓冲体系对培养基也有一定的改善,但通过对第一轮的响应面试验结果的统计分析发现,25%酵母浸出液的最佳添加量在24%以上,超过预期,可能与其干物质太少有关。在第二轮优化过程中,固定25%酵母浸出液的添加量,引入酵母浸出粉,以蛋白胨、酵母粉和蔗糖作为因变量,细胞密度A600为响应量,重新设计试验并对实验结果进行统计分析与计算得到最优各因素的优化值,转换成培养基成分后得到最佳配方。通过对最优配方进行验证,发现其菌体湿重相比普通LB培养基有大幅度增加。使用响应面试验设计进行培养条件和生产工艺优化在国内已有很多报道,尽管目标不尽相同,但所用的方法、统计分析与计算基本相同[21-22]。
使用生物反应器进行生物发酵是现代生物工程的微生物生产工艺的典型方式。相比实验室的摇菌培养,生物反应器可以实时控制温度、pH、溶氧等培养参数,并能根据需要进行补料控制,使培养物保持在一个优良的生长环境中,从而达到高密度发酵的目的。本文只是使用优化后的培养基在生物反应器中对重组菌DE-pET-P46进行发酵培养,结果培养产物湿菌重达到近40 g/L,这是振摇培养所难以达到的水平,尽管与菌体干重超过100 g/L的文献报道差距甚远。为了确定高密度发酵条件下,重组菌是否还能像振摇培养一样大量表达目的蛋白,通过SDS-PAGE进行了对比检测,结果表明二者在外源蛋白表达上没有明显差别。
高密度发酵技术是一个系统性的工程,随着生物技术的快速发展,其优越性和巨大的经济潜力将越来越被人们重视。
[1]Hannig G, Makrides S C.Strategies for optimizing heterologous protein expression in Escherichia coli[ J].Trends Biotechnol,1998, 16(2): 54-60.
[2]刘子宇,李平兰,郑海涛,等.微生物高密度培养的研究进展[J].中国乳业,2005, (12):47-51.
[3]Siurkus J, Panula-Perala J, Horn U, et al.Novel approach of high cell density recombinant bioprocess development:optimisation and scale-up from microliter to pilot scales while maintaining the fed-batch cultivation mode of E.coli cultures[J].Microb Cell Fact, 2010, 9: 35.
[4]Matsui T,Sato H,Yamamuro H,et al.High cell density cultivation of recombinant Escherichia coli for hirudin variant 1 production[J].J Biotechnol, 2008, 134(1/2): 88-92.
[5]Chennupati S, Potumarthi R, Gopal Rao M, et al.Multiple responses optimization and modeling of lipase production by Rhodotorula mucilaginosa MTCC-8737 using response surface methodology[J].Appl Biochem Biotechnol, 2009, 159(2):317-329.
[6]Ryan J E,Dhiman N,Ovsyannikova I G,et al.Response surface methodology to determine optimal cytokine responses in human peripheral blood mononuclear cells after smallpox vaccination[J].J Immunol Methods, 2009, 341(1/2): 97-105.
[7]Sabirov S, Kuznetsov V D, Filippova S N, et al.Optimization of the nutrient medium for the biosynthesis of albofungin by the steep est ascent procedure[J].Antibiotiki 1978; 23(7):590-592.
[8]Liu C, Chu I, Hwang S.Factorial designs combined with the steepest ascent method to optimize serum-free media for CHO cells[J].Enzyme Microb Technol, 2001, 28(4/5): 314-321.
[9]Banerjee R, Bhattacharyya B C.Evolutionary operation (EVOP)to optimize three-dimensional biological experiments[J].Biotechnol Bioeng, 1993, 41(1): 67-71.
[10]Rhee J K,Joung J G,Chang J H,et al.Identification of cell cycle-related regulatory motifs using a kernel canonical correlation analysis[J].BMC Genomics, 2009,10(Suppl 3): S29.
[11]El-Malah Y, Nazzal S.Hydrophilic matrices: application of Placket-Burman screening design to model the effect of POLYOX-carbopol blends on drug release[J].Int J Pharm,2006, 309(1/2): 163-170.
[12]Wen Z Y,Chen F.Application of statistically-based experimental designs for the optimization of eicosapentaenoic acid production by the diatom Nitzschia laevis[J].Biotechnol Bioeng, 2001, 75(2): 159-169.
[13]Liu C,Liu Y,Liao W,et al.Application of statistically-based experimental designs for the optimization of nisin production from whey[J].Biotechnol Lett, 2003, 25(11): 877-882.
[14]沈青春,王 芳,韩明远,等.猪肺炎支原体P46基因的原核表达与间接ELISA方法的建立[J].畜牧兽医学报,2012,(03): 431-437.
[15]Riesenberg D,Schulz V,Knorre W A,et al.High cell density cultivation of Escherichia coli at controlled specific growth rate[J].J Biotechnol, 1991, 20(1): 17-27.
[16]Markl H, Zenneck C, Dubach A C, et al.Cultivation of Escherichia coli to high cell densities in a dialysis reactor[J].Appl Microbiol Biotechnol, 1993, 39(1): 48-52.
[17]Makrides S C.Strategies for achieving high-level expression of genes in Escherichia coli[J].Microbiol Rev, 1996, 60(3):512-538.
[18]Lee S Y.High cell-density culture of Escherichia coli[J].Trends Biotechnol, 1996, 14(3): 98-105.
[19]Alper H, Miyaoku K, Stephanopoulos G.Characterization of lycopene-overproducing E.coli strains in high cell density fermentations[J].Appl Microbiol Biotechnol, 2006, 72(5):968-974.
[20]Fuchs C, Koster D, Wiebusch S, et al.Scale-up of dialysis fermentation for high cell density cultivation of Escherichia coli[J].J Biotechnol, 2002, 93(3): 243-251.
[21]王欢欢,徐小枫,余 蓉.响应面法优化HV12p-rPA工程菌的发酵条件[R].2013年中国药学大会暨第十三届中国药师周,中国广西南宁,2013.
[22]陆 燕,梅乐和,陆悦飞,等.响应面法优化工程菌产细胞色素P450 BM-3的发酵条件[J].化工学报, 2006, (05):1187-1192.
