布鲁氏菌A、M因子血清的研制
2014-11-23张金亚程君生丁家波皮向成张东东朱良全毛开荣
张金亚,程君生,冯 宇,丁家波,王 楠,皮向成,吴 竞,张东东,朱良全∗,毛开荣∗
(1.中国兽医药品监察所,北京100081;2.山东农业大学动物科技学院,山东泰安271018;3.中国农业科学院北京畜牧兽医研究所,北京100193)
布鲁氏菌是革兰氏阴性、胞内寄生兼性需氧菌,可导致多种动物和人患布鲁氏菌病(布病),造成严重的公共卫生问题和经济损失。布鲁氏菌目前分为6种陆生、4种海洋布鲁氏菌[1-2]。牛种布鲁氏菌、羊种布鲁氏菌、猪种布鲁氏菌是流行广泛的经典布鲁氏菌[3-5]。
1932 年Wilson和Miles提出布鲁氏菌A、M抗原决定簇的假设。经试验证实S-LPS含四种抗原决定簇:A、M、C、C/Y,并根据A 和M 比例,分为 A、M、C(M>A)、C(M=A)、C/Y(M>A)、C/Y(M=A)、C/Y(A>M)等 7 类[6-7]。
田间布鲁氏菌血清学检验时,菌株间交叉反应会影响布病病原的鉴别诊断。通过A、M因子血清,可辅助布病病原的种属鉴别。Pandit等[8]提出了血清与异种抗原交叉吸收的方法,Jones等[9]用活菌2308株和 16M 株、Wilson等[10]用活菌 A544株和16M株制备过因子血清,但国内未见制备因子血清的文献报道。本试验选用灭活的16M株和2308株布鲁氏菌免疫家兔制备了A、M因子血清,并优化了交叉吸收条件。
1 材料与方法
1.1 材料
1.1.1 菌株及来源 牛种布鲁氏菌2308株(CVCC788)、羊种布鲁氏菌 16M 株(CVCC70002)均来自国家兽医微生物菌种保藏中心。
1.1.2 主要试剂和仪器 大豆酶消化蛋白胨琼脂(Tryptic Soy Agar,TSA)培养基,购自BD公司。布鲁氏菌病试管凝集试验抗原参考品(简称“抗原参考品”) ,规格:5 mL/瓶,批号:S0100220130312;布鲁氏菌病阳性血清,规格:1 mL/瓶,批号:2001-5;布鲁氏菌病试管凝集试验阴性血清,规格:1 mL/瓶,批号:2001-5;均由中国兽医药品监察所人畜共患病实验室提供。16M试管凝集试验抗原、2308试管凝集试验抗原(简称“16M抗原、2308抗原”)按照《兽用生物制品规程》(2000年版)制备[11]。疫苗佐剂(纳米703佐剂)由北京生泰尔生物科技有限公司提供。
1.1.3 实验动物 1.5~2 kg雄性新西兰大耳白兔,普通级,购自北京维通利华实验动物技术有限公司。
1.2 方法
1.2.1 高免血清的制备
1.2.1.1 种子制备 取2308、16M菌株冻干用菌种各1支,分别启封后,用1 mL蛋白胨水稀释,参考OIE方法[12]划线接种TSA琼脂平板各2块,37℃培养72 h,低倍显微镜观察各平板菌落形态,选取10个各典型菌落分别划线接种TSA琼脂斜面3支,置2~8℃保存不超过1个月,备用。
1.2.1.2 细菌悬液及灭活疫苗的制备 分别将各布鲁氏菌菌株密集划线接种于TSA琼脂扁瓶,置37℃培养48~72 h,每个扁瓶用3~5 mL 0.5%的苯酚生理盐水冲洗培养物制成悬液,经4层灭菌纱布过滤,去除残留琼脂。其余菌液80℃水浴2 h灭活[12]。灭活菌液用灭菌生理盐水洗涤3~4次后,重新悬浮,调整菌液浓度至 1.2×1011CFU/mL。取适宜体积的该浓度的菌悬液与纳米703佐剂按2∶1比例(V∶V)制成灭活佐剂苗。
1.2.1.3 动物免疫及血清抗体消长规律监测 以6×1010CFU/只颈背部皮下分点注射1.5~2 kg家兔各5只。一免后40 d,以2倍剂量进行二免。二免5 d后,耳缘静脉采血,2 mL/次,常规方法分离血清并用微量试管凝集试验(MAT)监测抗体效价消长规律。MAT试验参照OIE法[12]进行,将待检血清用0.5%苯酚生理盐水作1∶10倍稀释,然后倍比稀释至1∶5120,在96 U孔凝集板中加入待检血清50 μL,然后分别加入用0.5%苯酚生理盐水作1∶20稀释的抗原参考品、16M抗原和2308抗原,37℃孵育22 h,观察结果,并设立阴、阳性血清对照。
1.2.2 单因子血清的制备
1.2.2.1 血清交叉吸收条件的优化 将布鲁氏菌菌液用PBS缓冲液洗涤2~3次,8000 r/min离心15 min,弃上清,然后将待吸收血清与吸收用抗原充分混合。制备因子血清的交叉吸收体系见表1。

表1 血清抗原交叉吸收体系
按以下3组单项参数进行血清交叉吸收条件的优化:(1)异种抗原/血清质量体积比(W/V)分别为1 ∶5、1 ∶10及 1 ∶20;(2)吸收温度及时间分别为4℃吸收2 h、4℃吸收12 h及37℃吸收2 h;(3)吸收过程中混匀方式分别采取每20 min混匀1次以及130 r/min振荡孵育。
1.2.2.2 血清交叉吸收后凝集价的测定 吸收后的菌液以 8000 r/min离心 15 min,弃菌体。按1.2.1.3项方法通过MAT检测血清对抗原标准品、16M抗原和2308抗原的抗体反应效价,比较分析并确定最适单因子血清制备参数。
1.2.2.3 最佳反应稀释浓度的确定 取经灭菌生理盐水适当稀释的因子血清30 μL,加入30 μL凝集试验抗原进行玻片凝集试验,以1~2 min内出现凝集判为阳性,判定单因子血清对16M抗原和2308抗原的反应情况,从而确定最佳反应稀释浓度。
1.2.3 血清分装、冻干及鉴定 将优化条件下制取的A、M因子血清,加入适量硫柳汞,使其终浓度为0.01%。按1 mL/瓶分装、冻干。
1.2.3.1 无菌检验 随机取冻干血清3瓶,每瓶用1 mL灭菌生理盐水溶解后,按现行《中国兽药典》进行无菌检验[13]。
1.2.3.2 特异性检验 任取1瓶冻干因子血清,按照1.2.2.3的方法进行特异性检验。观察并记录结果。
1.2.3.3 效价测定 参考OIE方法[12],采用抗原参考品、16M抗原、2308抗原进行MAT试验。
2 结果与分析
2.1 家兔抗体效价变化情况 分别用抗原参考品、2308抗原、16M抗原监测2308株和16M株免疫的家兔的抗体消长规律,结果见图1。可以看出,对2308试验组,三者测得的抗体变化趋势基本一致;对16M试验组,16M抗原与抗原参考品监测得到的抗体效价消长规律一致,且与2308试验组相似,基本表现为一免后20 d抗体效价处于较高水平,随后开始下降,到二免前(首免第40 d)已经明显下降到较低水平,二免后5 d抗体水平显著上升,15日抗体水平达到较高水平,随后下降。由于2308抗原与16M抗血清的反应性不佳,故用2308监测16M抗体产生规律时,其结果偏离以16M或以抗原参照品监测的结果(图1)。
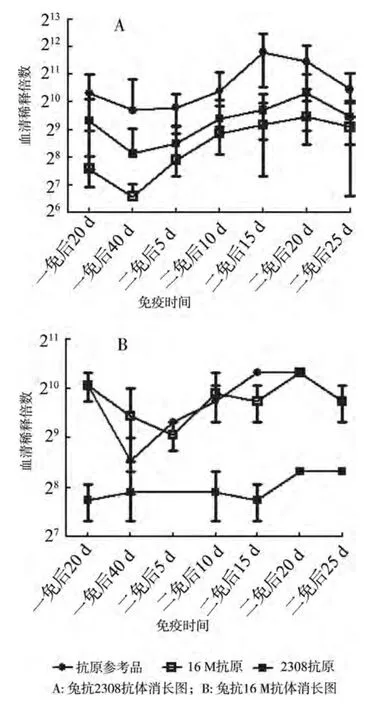
图1 家兔抗体消长图
2.2 血清中抗体的交叉吸收
2.2.1 血清吸收条件的优化 以用16M抗原吸收兔抗2308血清为例,按表2的吸收条件分别进行预实验。吸收前兔抗2308血清对抗原参考品、16M抗原、2308抗原的凝集价分别为1∶1280、1∶320、1∶640。血清交叉吸收后用MAT测吸收后血清对抗原参考品、16M抗原、2308抗原的凝集价,结果见表2。
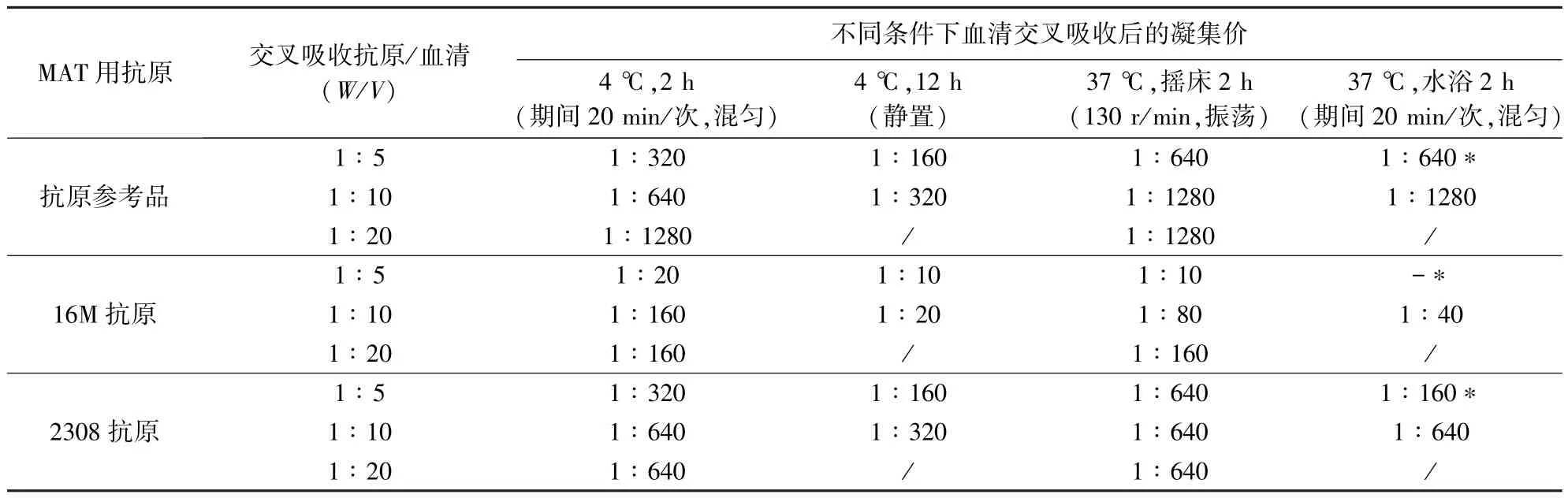
表2 血清吸收条件的方法优化及结果
比较血清交叉吸收后的对不同抗原的凝集价,确定当抗原与血清质量体积比(W/V)为1∶5时,37℃水浴2 h,期间每隔20 min振荡混匀1次为最适交叉吸收条件。
2.2.2 血清交叉吸收后凝集价的测定 经优化条件制备得单因子血清后,对因子血清进行特异性的鉴定,结果见表3和表4。
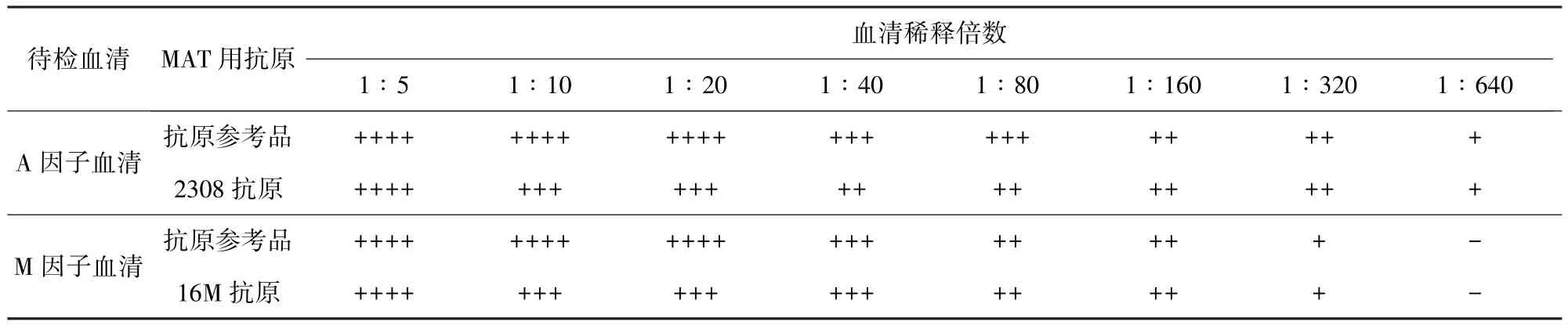
表3 因子血清对参考抗原及同种抗原的凝集价(MAT)

表4 因子血清对异种抗原的凝集价(MAT)
MAT结果显示:A因子血清对抗原参考品和2308抗原的凝集价均为1∶320(++),对16M抗原凝集价为1∶2.5不凝集;M因子血清对抗原参考品和16M抗原的凝集价均为1∶160(++),对2308抗原的凝集价为1∶2.5为凝集。
2.2.3 因子血清最佳稀释倍数的确定 经优化条件制备得因子血清后,对因子血清进行最佳稀释倍数的确定,结果见表5。
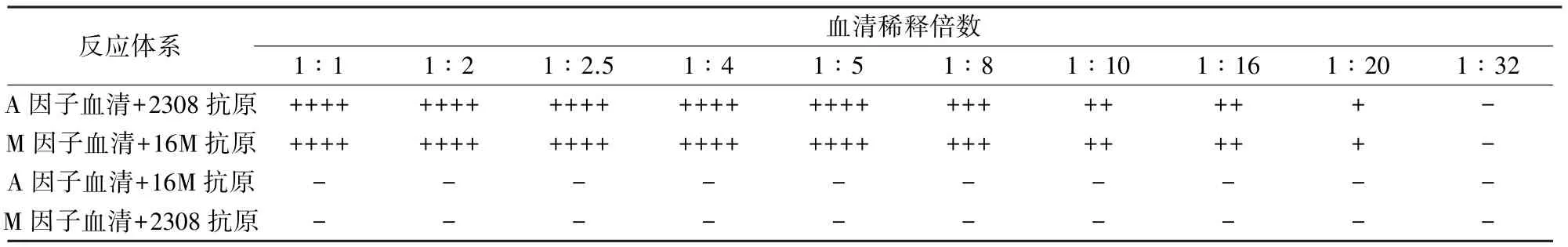
表5 因子血清稀释倍数的确定
玻片凝集试验显示,A因子血清对16M抗原在1∶1时无凝集,对2308抗原在1∶16时有较明显凝集颗粒,1∶32稍凝集;M因子血清对2308抗原在1∶1时无凝集,对16M抗原在1∶16时有较明显凝集颗粒,1∶32稍凝集。因子血清对异种抗原在血清原倍的情况下已无凝集现象,但仍建议在进行玻片凝集试验时对血清进行1∶2的稀释。
2.3 单因子血清的鉴定 对经分装冻干的因子血清进行无菌检验,证实无菌。经MAT检测因子血清冻干后对不同抗原凝集价,结果显示:分装冻干后的A因子血清对2308抗原的凝集价为1∶320(++),对16M 抗原为 1 ∶2.5不凝集;M 因子血清对16M抗原的凝集价为1∶160(++),对2308抗原的凝集价为1∶2.5不凝集;与冻干前凝集价比较,发现冻干对A因子血清和M因子血清对抗原的的凝集价无影响。经玻片凝集试验测定血清的最佳稀释比例,结果显示:分装冻干后的A因子血清对16M抗原在1∶1时无凝集,对2308抗原在1∶16时有较明显凝集颗粒,1∶32稍凝集;分装冻干后的M因子血清对2308抗原在1∶1时无凝集,对16M抗原在1∶16时有较明显凝集颗粒,1∶32稍凝集;与冻干前比较,发现冻干对A因子血清和M因子血清的最佳稀释比例无影响。
3 讨论与小结
3.1 最适吸收条件的确定 参照文献报道的因子血清交叉吸收条件[8-10]并进行了优化。本试验选用37℃和4℃两种温度,2 h和12 h两种时间,1∶5、1∶10、1∶20三种抗原血清质量比,以及恒温摇床振荡及每20 min振荡混匀两种孵育模式分别进行了试验,对比吸收后因子血清的抗体效价及对同种抗原、异种抗原的反应情况,最终确定在抗原与血清质量体积比(W/V)为1∶5时,37℃水浴2 h,期间每隔20 min振荡混匀1次为最适宜的吸收条件。
3.2 最适采血时间的确定 文献报道活菌一免后6 d,不经二免,最适宜采血并进行交叉吸收[9]。但试验发现,如免疫后较短时间内采血,此时血清对异种抗原的凝集价相对较低,但血清的抗体效价并不很高,经异种抗原交叉吸收后对同种抗原的凝集价也较低(1∶80左右)[10];而二免后抗体效价上升,尽管血清对异种抗原凝集价升高,但血清经交叉吸收后对同种抗原的凝集价较高(1∶160和1∶320),故建议先获得高免血清(≥1∶2560),再进行血清的交叉吸收。
3.3 本试验的优点 以往制备因子血清大都采用活菌免疫[8-10],而本试验选用灭活的 16M株和2308株免疫家兔,操作安全。对比文献制备的因子血清与试验制备的因子血清发现,试验制备的因子血清特异性更强,抗体效价高。
[1]Foster G, Osterman B S, Godfroid J, et al.Brucella ceti sp.nov.and Brucella pinnipedialis sp.nov.for Brucella strains with cetaceans and seals as their preferred hosts[J].Int J Syst Evol Microbiol, 2007, 57: 2688-2693.
[2]Whatmore A M.Current understanding of the genetic diversity of Brucella, an expanding genus of zoonotic pathogens[J].Infect Genet Evol, 2009, 9: 1168-1184.
[3]Alton G G, Jones L M, Angus R D, et al.Techniques for the brucellosis laboratory[M].Paris: Institut National de la recherch Agronomique,1988.
[4]Corbel M J, Banai M.Genus I.Brucella Meyer and Shaw Bergey’s manual of systematic bacteriology[M].Springer, 2005: 370-386.
[5]Manual of standards for diagnostic tests and vaccines[M].Pairs:Office International des Epizooties,2009.
[6]Wilson G S, A A Miles.The serological differentiation of smooth strains of the Brucella group[J].Br J Exp Pathol, 1932, 13:1-13.
[7]Weynants V, Gilson D, Cloeckaert A, et al.Characterization of smooth lipopolysaccharides and O polysaccharides of Brucella species by competition binding assays with monoclonal antibodies[J].Infect Immun, 1997, 65: 1939-1943.
[8]Jointment FAO/WHO Expert Committee on Brucellosis[M].Wld Hlth Org techn, 1953: 67.
[9]Jones L M A.Recommended method for the preparation of monospecific Brucella sera[M].Bull.World Health Org, 1958, 19:177-186.
[10]Diaz R, L M Jones, D Leong, et al.Surface antigens of smooth Brucellae[J].Bacteriol, 1968, 96: 893-901.
[11]农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程 二○○○版[M].北京:化学工业出版社,2010:273-277.
[12]Office International Des Epizooties.OIE terrestrial manual[M].World Organization for Animal Health, 2009: 15-16.
[13]中国兽药典委员会.中华人民共和国兽药典二○一○版三部[S].北京:中国农业出版社,2011:68-69,附录26.
