大球盖菇栽培期间胞外酶活性变化研究
2014-11-21傅常娥陈艳秋尹勇刚
于 萍,孙 萌,傅常娥,陈艳秋,尹勇刚
(延边大学农学院,吉林 延吉 133002)
大球盖菇 (Stropharia rugosoannulata Farlow),别名皱环球盖菇、皱球盖菇、酒红大球盖菇、裴氏球盖菇、裴氏假黑伞,属于担子菌亚门 (Basidomycota)、层菌纲 (Hymenomycetes)、伞菌目 (Agaricales)、球盖菇科 (Strophariaceae)、球盖菇属 (假黑伞属)(Stropharia)[1]。大球盖菇色泽艳丽,子实体肉质嫩滑、爽口,菌盖细腻软滑,菌柄清香脆甜,干菇香味浓郁。大球盖菇主要分布于欧洲、北美洲、亚洲等地,是许多欧美国家人工栽培的食用菌之一,也是国际菇类交易市场的十大菇类之一和联合国粮农组织(FAO)向发展中国家推荐栽培的重要食用菌之一[2]。大球盖菇是一种美味食用菌,营养价值较高,而且还有一定的保健和药用价值[3,4]。
大球盖菇对秸秆、树枝等农林废弃物具有很好的降解能力,可生料栽培,但与其降解木质纤维素密切相关的胞外酶活性变化的研究至今未见报道。虽然我国引种大球盖菇较晚,但地理气候适宜,并且秸秆、稻草等农业废弃物来源丰富,成本低廉,具有极大的栽培大球盖菇的优势和潜力。大力发展大球盖菇,可促进农业废弃物的合理利用,减少其带来的环境污染,同时减少对木材及木材下脚料的应用,避免由于发展食用菌产业而造成的毁林现象,可带来可观的经济效益和社会效益[5]。大球盖菇生料栽培期间胞外酶活性变化的研究,将对深入研究其营养生理和指导其栽培具有重要意义。
1 材料与方法
1.1 菌种来源
供试的大球盖菇菌株采自长白山地区,经组织分离后获得纯菌株,由延边大学农学院应用真菌实验室保存。
1.2 大球盖菇栽培种制作
栽培种共设置5种培养料配方,以稻草、豆秸秆、玉米秸秆、玉米芯及木屑为主料,蔗糖、石膏粉为辅料,按照栽培种培养料配方进行常规拌料、装桶,含水量保持在65%~75%,选取菌丝长势优良且一致的大球盖菇原种制作栽培种,每个处理重复3次。
栽培种培养料分为1号:木屑98%、蔗糖1%、石膏粉1%;2号:稻草98%、蔗糖1%、石膏粉1%;3号:豆秸秆98%、蔗糖1%、石膏粉1%;4号:玉米秸秆98%、蔗糖1%、石膏粉1%;5号:玉米芯98%、蔗糖1%、石膏粉1%。
1.3 取样时期
在大球盖菇生长过程中,分别在接种期、发菌期、菌丝生长前期、菌丝生长中期、菌丝生长后期、满桶期、覆土期、原基期、子实体成熟期及间期共10个时期进行取样。
1.4 粗酶液的提取
在菌丝生长发育的不同阶段,分别在3个重复中取发菌料充分混匀,然后准确称取20 g加蒸馏水100 mL,20℃下浸提4 h,过滤,4 000 r·min-1离心5 min,取上清液即为粗酶液。另外同样称取20 g发菌料于热鼓风干燥箱中80℃烘干至恒重。
1.5 酶活性的测定
羧甲基纤维素酶 (CMC酶)和滤纸纤维素酶 (FP酶)活性测定参照Mandels等[6]的方法;β-葡糖糖苷酶活性测定参照Saswati等[7]的方法;半纤维素酶 (HC酶)活性测定参照Shamala等[8]的方法;漆酶活性测定:向3支样品管中加入0.5 mL的3.36 mmol·L-1邻联甲苯胺 (用95%的乙醇溶解)作为底物,随后向4支试管中加入3.4 mL的0.1 mol·L-1乙酸盐缓冲液 (pH4.6)及0.5 mL粗酶液,置于28℃恒温水浴锅中反应30 min,取出后在600 nm处测定吸光值。
漆酶活力单位定义:1 g干培养物中的酶量每分钟使OD600值改变0.01为1个活力单位。
2 结果与分析
2.1 不同培养料栽培大球盖菇期间CMC酶活性变化
测定不同培养料栽培大球盖菇期间CMC酶活性变化,结果见图1。
由图1可见,大球盖菇在不同培养料中均在菌丝生长中期、子实体成熟期产生了酶活性高峰。其中2号和4号培养料中酶活性最强,在菌丝生长中期分别达到了44.8 U和44.5 U。随后,酶活性急速下降,在产生原基后再次上升,在子实体成熟期达到第2个峰值,其中2号稻草培养料酶活性最高,为39.0 U。1号和5号培养料中CMC酶活性相对较低。
2.2 不同培养料栽培大球盖菇期间FP酶活性变化
不同培养料栽培大球盖菇期间FP酶活性变化见图2。
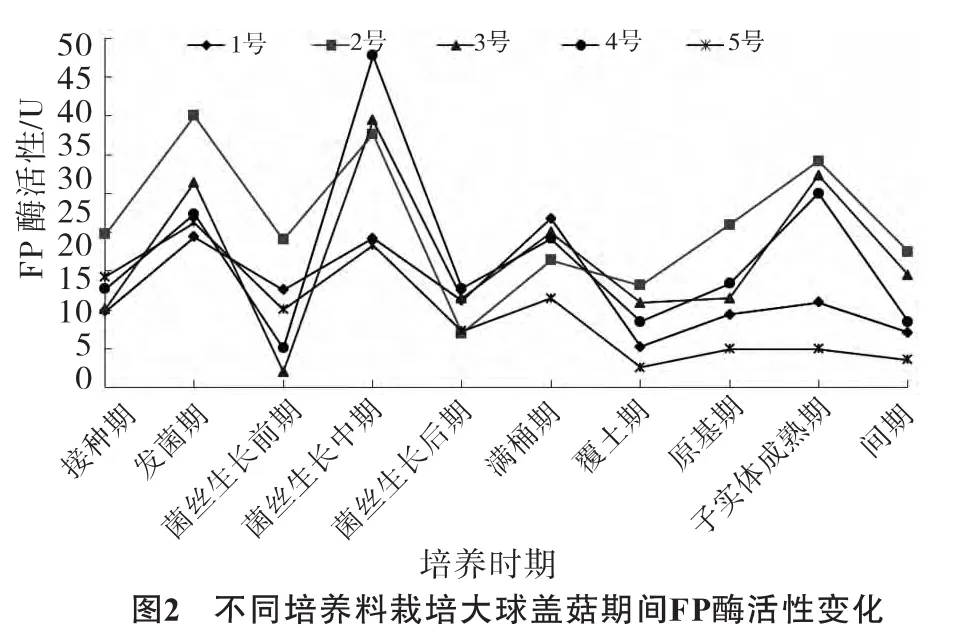
由图2可见,不同培养料中大球盖菇产生的FP酶活性差异较大,但变化趋势相似。在发菌期2号培养料中酶活性最大 (35.2 U);在菌丝生长期4号培养料中酶活性达到最大,为42.7 U;在子实体成熟期酶活性再次升高,随后下降。这说明在发菌期、菌丝生长期和子实体成熟期纤维素被大量分解利用,间期酶活性下降,菌丝对纤维素的分解能力降低。1号与5号培养料中FP酶活性没有明显的波动,酶活性一直较低。
2.3 不同培养料栽培大球盖菇期间β-葡萄糖苷酶活性变化
不同培养料栽培大球盖菇期间β-葡萄糖苷酶活性变化情况见图3。
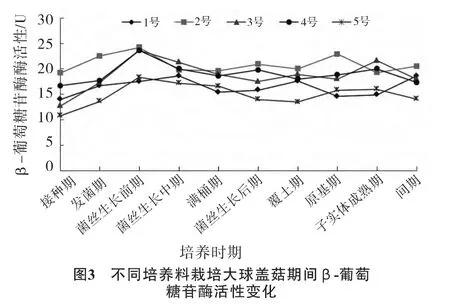
由图3可以看出,在大球盖菇整个栽培过程中,不同培养料中β-葡萄糖苷酶活性趋势趋于一致,没有明显的酶活性高峰和明显的阶段性变化。最大值出现在菌丝生长前期,2号培养料中酶活性达到24.2 U。
2.4 不同培养料栽培大球盖菇期间HC酶活性变化
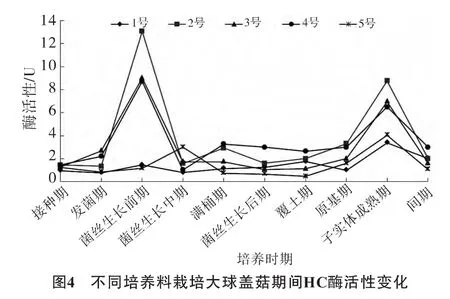
不同培养料栽培大球盖菇期间HC酶活性变化情况见图4。
由图4可见,大球盖菇生长过程中,HC酶分别在菌丝生长前期和子实体成熟期出现了酶活性高峰,其它时期酶活性较低。2号、3号、4号培养料中HC酶活性在菌丝生长前期达到高峰,分别为13.1 U、9.0 U和8.7 U;1号与5号培养料一直保持较低的酶活性。原基形成后各培养料中HC酶活性出现第2个高峰,2号培养料的酶活性最高,达8.7 U。
2.5 不同培养料栽培大球盖菇期间漆酶活性变化
不同培养料栽培大球盖菇期间漆酶活性变化情况见图5。
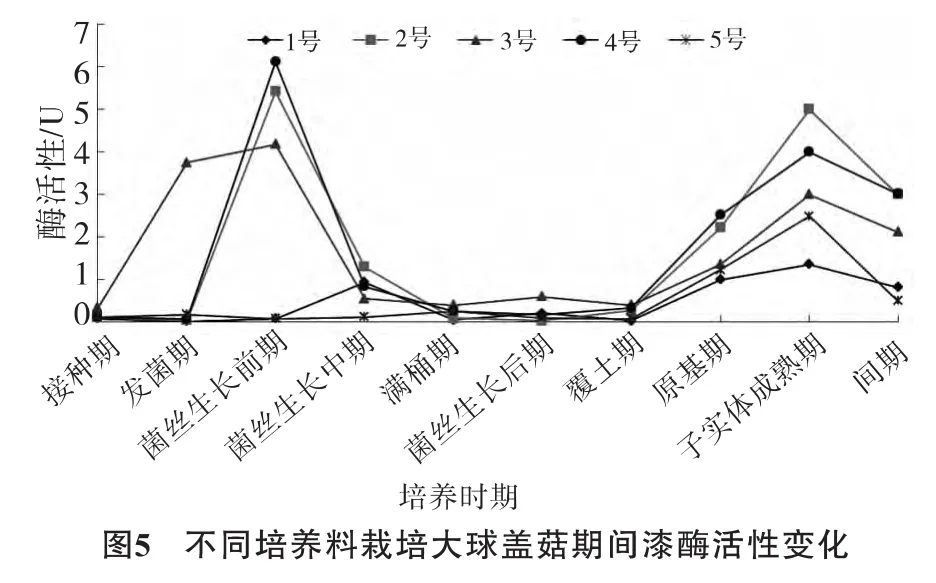
由图5可见,3号培养料在发菌期漆酶活性迅速上升,而2号、4号培养料中菌丝分泌的胞外漆酶在菌丝生长前期迅速上升,并且与3号培养料在此时期均达到峰值,分别为6.1 U、5.4 U和4.2 U,随后酶活性迅速下降并一直保持较低水平,直至覆土后出现上升趋势,在子实体成熟期达到第2个活性高峰,此时稻草培养料中酶活性最高,为5.0 U。1号与5号培养料中酶活性一直较低。
3 讨论
大球盖菇属于草腐食用菌,人工栽培营养来源主要是从稻草、麦秆、玉米秸秆等培养基质中分解获得。培养基中的大分子物质主要包括纤维素、半纤维素、木质素等成分。从本试验结果看出,在大球盖菇生长的全过程中均能测出胞外CMC酶、FP酶、β-葡萄糖苷酶、HC酶和漆酶活性。这些胞外酶是分解培养基中大分子物质的生理生化基础,尤其是在以木质纤维素为主要营养来源的环境中赖以生存的保证。大球盖菇生料栽培期间,不同的栽培基质中各个酶的活性变化规律基本一致,除了β-葡萄糖苷酶活性无明显变化外,其他酶均在菌丝生长期和子实体发育期活性较高,这与菌丝生长和子实体发育需要大量营养有关。CMC酶与FP酶在菌丝生长中期和子实体成熟期酶活性最高,HC酶与漆酶在菌丝生长前期和子实体成熟期酶活性最高。HC酶是水解半纤维素的酶,漆酶是水解木质素的主要酶类,在高等植物中,木质素和半纤维素一起包围着纤维素,对纤维素有物理性的屏障作用[9],在木质纤维素降解过程中会首先分解半纤维素和木质素,因此HC酶和漆酶先达到酶活性高峰,之后出现纤维素酶活性高峰,这与一些学者对平菇、金顶侧耳、姬松茸、滑菇、灰树花、香菇等的研究结果相似但也存在差异[10-14]。平菇等食用菌的胞外酶活性在子实体成熟期远高于菌丝生长期,而大球盖菇菌丝生长期间胞外酶活性略高于子实体成熟期,可能是由于大球盖菇采用的是生料栽培,而其他食用菌采用的是发酵料栽培或者熟料栽培的原因。
综合几种酶的变化趋势可以看出,在菌丝生长期和子实体发育期酶活性较高,其它时期酶活性较低,说明菌丝生长期和子实体发育期是大球盖菇分解培养基质、吸收营养的2个主要时期;从酶活性角度看,稻草、玉米秸秆和豆秸秆培养基质中酶活性较高,利用不同培养料栽培大球盖菇的产量以及与胞外酶之间的关系有待进一步研究。
[1]罗信昌,陈士瑜.中国菇业大典[M].北京:清华大学出版社,2010:986-1003.
[2]黄年来.大球盖菇的分类地位和特征特性[J].食用菌,1995(6):11.
[3]邹盛勤,陈武.食用菌的营养成分·药理作用及开发利用 [J].安徽农业科学,2005(3):502-503.
[4]王晓炜,詹巍,陶明煊,等.大球盖菇营养成分、抗氧化活性物质分析 [J].食用菌,2007(6):62-63.
[5]吕宸,吕建强,王国平,等.我国农作物秸秆收集存在的问题及对策[J].现代农业科技,2012(22):203-204.
[6]Mandels M,Hontz L,Nystrom J,et al.Enzymatic hydrolysis of waste cellulase [J].Biotechnology and Bioengineering,1974(16):1471-1493.
[7]Saswati S,Sengupta S.β -Glucosidase production by the mycelial culture of the mushroom Termitomyces clypeatus [J].Enzyme and Microbial Technology,1990(12):309-314.
[8]Shamala TR,Screekantian KR.Production of cellulases and D -xylanase by some selected fungal isolates[J].Enzyme and Microbial Technology,1986,8(3):178-182.
[9]邬义明.植物纤维化学 [M].北京:中国轻工业出版社,1995:76-80.
[10]庄庆利,李冠军,申进文.平菇栽培种培养过程中胞外酶活性变化的研究[J].河南农业大学学报,2010(2):163-166.
[11]李娟.金顶侧耳不同生长期几种胞外酶活性变化 [D].济南:山东师范大学,2007.
[12]倪新江,丁立孝,潘迎捷,等.姬松茸在两种培养基上生长期间九种胞外酶活性变化[J].菌物系统,2001(2):222-227.
[13]王玉万,王云.滑菇营养生理研究 [J].微生物学报,1990,17(6):321-323.
[14]倪新江,丁立孝,冯志勇,等.灰树花生长发育过程中的几种胞外酶活性变化 [J].微生物学杂志,2001(3):24-25.
[15]倪新江,潘迎捷,冯志勇,等.香菇生长过程中几种胞外酶活性的变化规律[J].食用菌学报,1995(4):22-27.
