食管鳞癌组织中抑癌基因Crnn的表达及其临床意义
2014-11-18别亚男乔俊静秦艳茹
别亚男,乔俊静,王 瑾,张 昭,秦艳茹
(郑州大学第一附属医院肿瘤科 河南郑州 450052)
食管鳞癌(esophageal squamous cell carcinoma,ESCC)是最常见的消化道恶性肿瘤之一,而且位列恶性肿瘤致死率的第6位[1]。食管癌主要有两种类型,这两种有不同的病原学及病理学特征,ESCC是食管癌的主要组织学亚型,在不同国家及国家内不同地区有着明显的地域分布。虽然经过多科治疗,但是它的预后仍然比较差,而且5年生存率低于15%[2]。它的发生、发展是与遗传因素、环境因素等多因素、多步骤相关的过程,在这个过程中可能涉及到多个癌基因的激活和抑癌基因的失活。迄今为止,导致ESCC的分子和细胞机制仍未完全明确。
Crnn蛋白是S100蛋白中的一员,在N端有一钙结合位点[3]。另一项研究表明,Crnn基因是融合基因中的一员,可能在表皮分化中起到重要的作用[4]。虽然Crnn基因在ESCC中表达下调,很可能在正常组织向肿瘤组织转变中丢失[5],但Crnn蛋白表达情况及其与临床病理特征和5年生存率之间的关系却没有相关研究。为此我们采用免疫组化方法检测了Crnn蛋白在食管癌患者组织中的表达水平,进一步了解ESCC的发生、发展及影响预后的机制。
1 材料与方法
1.1 研究材料 100例食管癌组织及相应的癌旁正常黏膜组织(距离肿块组织5 cm以上)均来自河南省林州市人民医院(2002年1月至2005年1月),其中男46例,女33例;年龄<59岁43例,≥59岁36例;高分化12例,中分化50例,低分化17例;TNM分期(2002年AJCC分期)Ⅰ期11例,Ⅱ期52例,Ⅲ期10例,Ⅳ期6例;淋巴结转移21例。患者术前均未接受任何放疗或化疗,所有标本经组织病理学检查证实为原发性食管鳞状细胞癌。
1.2 组织芯片制作 收集常规病理切片和HE染色,然后在病理切片上根据形态学特点确定好具有代表性的肿瘤部位,用组织阵列仪支架上的X、Y轴刻度尺定位后,用穿刺取样针在供体蜡块相应的位置进行穿刺取样。预先制备1个45×20×20 mm3大小的受体蜡块,用组织阵列仪(广州浩翰仪器有限公司生产)穿刺取样针打出间距为1.8 mm,直径为1 mm,深度为3~4 mm的孔。然后,将用组织阵列仪穿刺所得的微小圆柱形组织挤压到受体蜡块上已制备好的阵列孔中。
1.3 免疫组织化学法 将使用标准的生物素-亲和素-过氧化物酶复合物方法对免疫组化染色进行操作。简单来说,石蜡切片脱蜡,加入10%的山羊血清10 min,非特异性结合被阻断。然后加入抗Crnn多克隆抗体孵育(1∶100稀释,4℃过夜;英国剑桥Abcam公司)。之后在辣根过氧化物酶结合的山羊抗兔免疫球蛋白中孵育(1∶100稀释,37℃ 30 min)。细胞质中Crnn的表达分为3个独立的等级,因为没有发现有明显的细胞着色百分比的差别,因此免疫反应性只用染色强度表示(0=未被染色;1=弱染色;2=强染色)。共有79例正常组织及食管鳞癌组织均有效表达。
1.4 统计学方法 采用SPSS 17.0统计软件,数据分析应用χ2检验、Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1 两组Crnn蛋白表达情况 ESCC组织中Crnn蛋白表达阳性率为45.6%(36/79),食管正常黏膜组织中Crnn蛋白表达阳性率为93.7%(74/79),两组间表达比较差异具有统计学意义(P<0.05)。见表1和图1。
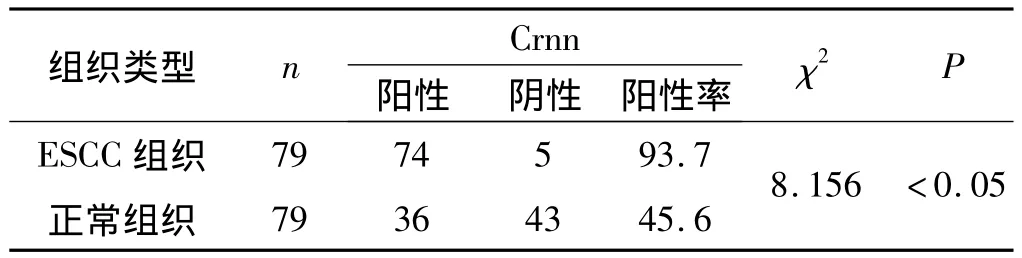
表1 两组Crnn蛋白表达情况(n,%)
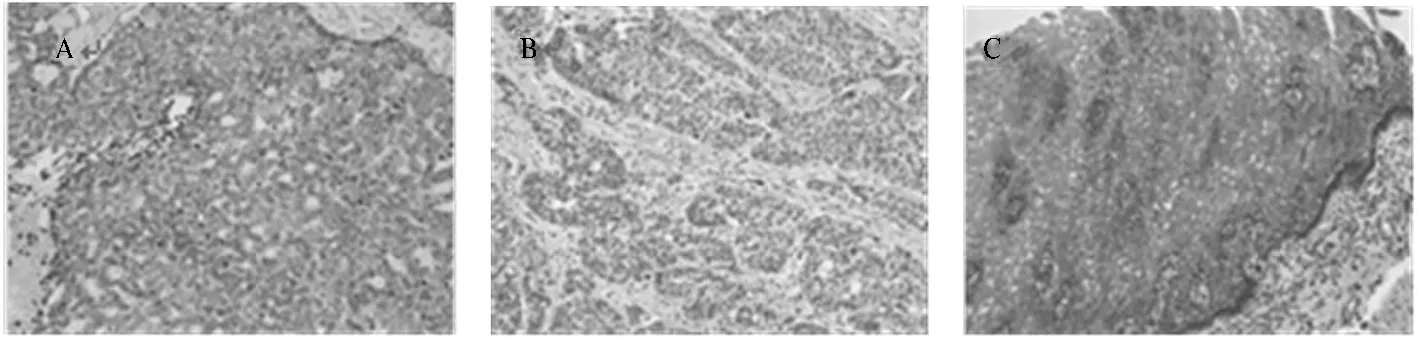
图1 Crnn蛋白表达情况评分标准(SP染色×400)
2.2 Crnn表达与ESCC临床病理特征的关系 Crnn基因在ESCC中的表达下调与不同的年龄组、性别组、肿瘤细胞分化程度和大体分型可能无关(P>0.05)。Crnn与TMN分期相关(P=0.035),随着分期增加,Crnn表达下调率逐渐增加,0期~ⅡA期(45.8%),ⅡB期~ⅣB期(75%);Crnn基因的表达下调与淋巴结转移相关,有淋巴结转移表达下调率76.2%,无淋巴结转移表达下调率44.8%,两组间差异具有统计学意义(P=0.021),见表2。
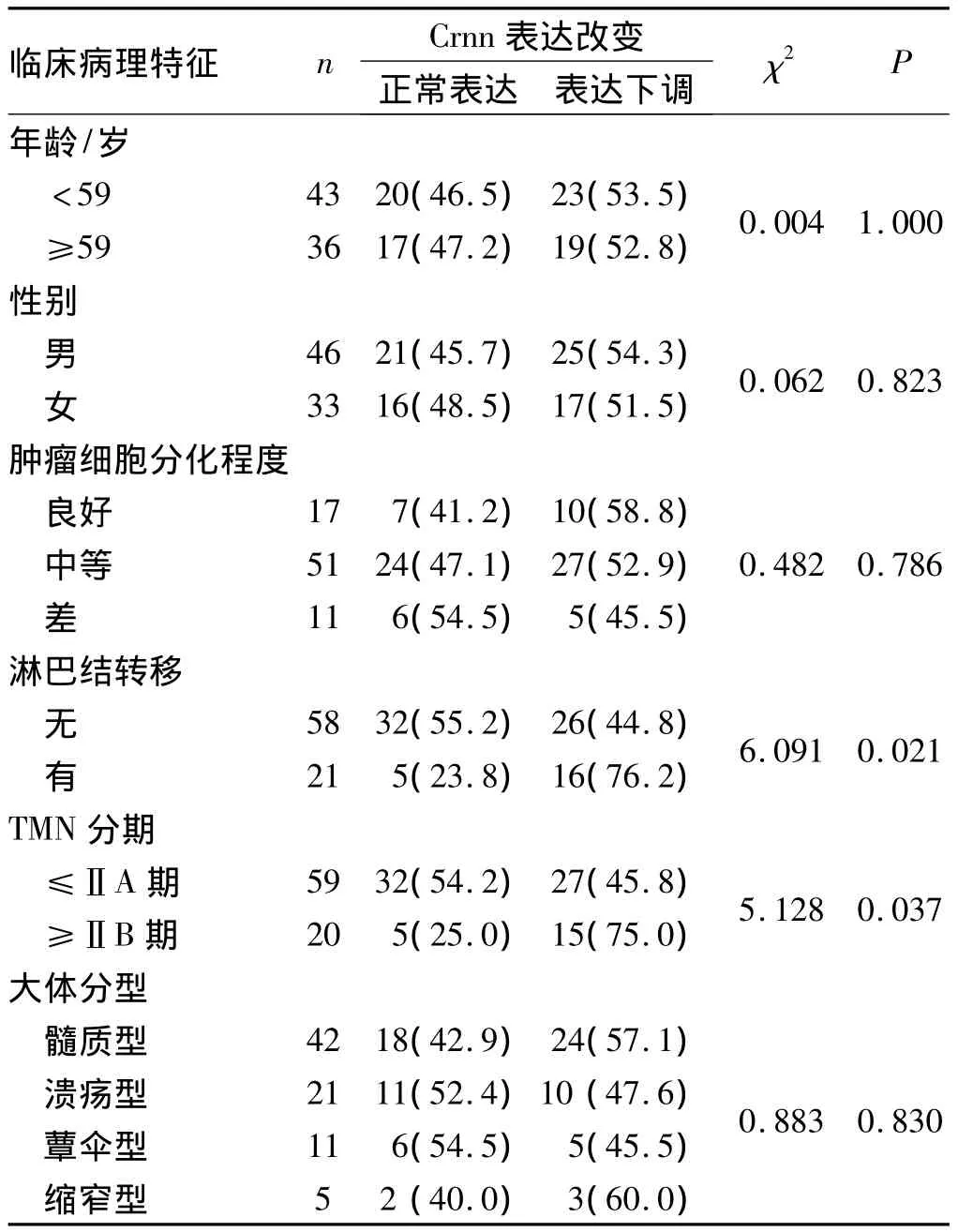
表2 Crnn表达缺失与ESCC患者临床病理特征的关系[n,(%)]
2.3 Crnn表达与ESCC患者的5年生存率的关系 Crnn基因表达下调ESCC患者的5年生存率明显低于Crnn基因正常表达的ESCC患者(P=0.021),见图2。
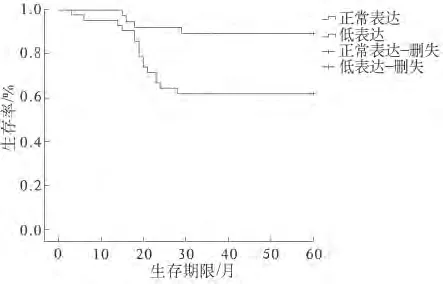
图2 Crnn表达与ESCC患者的5年生存率的关系
3 讨论
Crnn基因位于染色体1q21,该基因包含3个外显子,编码一个含有495个氨基酸的蛋白质,N端包含一个钙结合位点,属于S100家族蛋白[6]。S100家族蛋白的功能相当复杂,而且它们在肿瘤的发生发展中扮演重要的角色[7]。一项研究表明,Crnn蛋白能够通过上调两种蛋白质的表达来抑制细胞周期中G1/S转变[8-9],从而抑制细胞生长、促进细胞凋亡和衰老,该蛋白的表达下调或缺失可能导致肿瘤的发生。
通过此次研究发现,食管正常黏膜组织中Crnn蛋白表达阳性率为93.7%,而食管鳞癌组织中存在高频率的表达下调(表达下调率为53.2%);食管鳞癌中Crnn基因表达率与淋巴结转移和TNM临床分期有关(P均<0.05),与正常组织相比,Crnn基因表达改变可能与淋巴结转移与否有关,这一结果说明Crnn基因表达下调导致出现淋巴结转移的现象进而影响预后;ⅡB期及更晚分期的ESCC患者肿瘤细胞的表达下调率高于早期,说明ESCC晚期病例Crnn基因表达下调更为显著,该基因可能参与了食管鳞癌的发展过程,并且随着肿瘤的进展,Crnn的表达下调增加。目前关于Crnn基因表达下调可导致ESCC的发生、发展的机制还不是十分清楚,有研究表明可能通过以下机制发挥作用:Crnn基因通过上调P21WAF1/CIP1和Rb这两种蛋白质的表达来抑制细胞周期中G1期向S期转变。G1/S期转变是细胞周期循环进展的一个重要关卡,而P21WAF1/CIP1是这一转变期间具有决定性的负性调控因子之一。Rb是另一肿瘤形成过程中重要的抑制基因,当rb基因突变或丢失时,E2f转录因子会被释放然后导致促进细胞生长的基因的过度表达[10-11]。因此当Crnn基因表达下调或缺失时,会使抑制细胞增殖的两种蛋白质表达下降,从而导致细胞过度分裂。通过上面的机制表明,Crnn基因对细胞增殖起负性调节作用。
本研究发现Crnn基因表达下调的ESCC患者的5年生存率明显低于Crnn基因正常表达的食管鳞癌患者,说明Crnn表达下调的肿瘤比Crnn正常表达的肿瘤更具有侵袭性和转移性,Crnn蛋白表达下调对恶性肿瘤细胞侵袭作用的抑制性减弱,使肿瘤侵蚀及转移进而影响患者的生存时间,Crnn可能作为影响患者生存时间的一个独立因素;Crnn基因在ESCC中的表达下调与不同的年龄阶段、性别、肿瘤细胞分化高低和大体分型可能无关(P均>0.05)。
近段时间研究表明,在很多实体肿瘤中都能检测到在lq21染色体位点上杂合性的丢失(LOH),包括食管鳞状细胞癌[12]、肺癌[13]、胰岛素瘤[14]和食管上皮腺癌[15]。更有意思的是,lq21位点杂合性的丢失和肿瘤的恶性度[14]及生存时间缩短有关[15]。由此我们可以推测,Crnn基因位点处杂合性的丢失导致了ESCC的发生、发展。
综上所述,Crnn基因的表达下调参与了食管鳞状细胞癌的发生、发展与预后,Crnn基因表达的下调可能与食管鳞癌的淋巴结转移、临床分期及生存时间有关,Crnn基因表达下调与否的检测对食管鳞癌的临床诊断可能具有一定的价值,同时可以为判断患者预后提供参考。
[1]Parkin D M,Pisani P,Ferlay J.Estimates of worldwide incidence of eighteen major cancer in 1985[J].Int J Cancer,1993,59(54):594.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].Cancer,2008,58(2):71-96.
[3]Wang Y,Fang C,Gao H,et al.Platelet-derived S100 family member myeloid-related protein-14 regulates thrombosis[J].J Clin Invest,2014,124(5):2160-2171.
[4]Contzler R,Favre B,Huber M.Cornulin,a new member of the“fused gene”family,is expressed during epidermal differentiation[J].J Invest Dermatol,2011,124(5):990-997.
[5]Pawar H,Maharudraiah J,Kashyap M K,et al.Downregulation of cornulin in esophageal squamous cell carcinoma[J].Acta Histochemica,2013,115(2):89-99.
[6]Schafer B W,Wicki R,Engelkamp D.Isolation of a YAC clone covering a cluster of nine S-100 genes on human chromosome 1q21:rationale for a new nomenclature of the S-100 calcium-binding protein family[J].Genomics,1995,(25):638-643.
[7]Botelho H M,Fritz G,Gomes C M,et al.Analysis of S100 oligomers and amyloids[J].Methods Mol Biol,2012,84(9):373-386.
[8]Parry D,Mahony D,Wills K,et al.Cyclin D-CDK subunit arrangement is dependent on the availability of competing INK4 and p21 class inhibitors[J].Mol Cell Biol,1999,19(3):1775-1783.
[9]Malumbres M,Barbacid M.To cycle or not to cycle:a critical decision in cancer[J].Nat Rev Cancer,2010,9(3):222-231.
[10]Lu Z,Ghosh S,Wang Z,et al.Downregulation of caveolin-1 function by EGF leads to the loss of E-cadherin,increased transcriptional activity of beta-catenin,and enhanced tumor cell invasion[J].Cancer Cell,2003,4(6):499-515.
[11]Rajarajacholan U K,Thalappilly S,Riabowol K.The ING1a tumor suppressor regulates endocytosis to induce cellular senescence via the Rb-E2F pathway[J].PLoS Biol,2013,11(3):e1001-1012.
[12]Li J,Liu Z,Wang Y,et al.Allelic imbalance of chromosome 1q in esophageal squamous cell carcinomas from China:a novel region of allelic loss and significant association with differentiation[J].Cancer Lett,2005,220(2):221-230.
[13]Mesquita B,Lopes P.Frequent copy number gains at 1q21 and 1q32 are associated with overexpression of the ETS transcription factors ETV3 and ELF3 in breast cancer irrespective of molecular subtypes[J].Breast Cancer Res Treat,2013,138(1):37-45.
[14]Yang Y M,Liu T H,Chen Y J.Chromosome 1q loss of heterozygosity frequently occurs in sporadic insulinomas and is associated with tumor malignancy[J].Int J Cancer,2012,117(2):234-240.
[15]Maru D M,Luthra R,Correa A M,et al.Frequent loss of heterozygosity of chromosome 1q in esophageal adenocarcinoma:loss of chromosome 1q21.3 is associated with shorter overall survival[J].Cancer,2009,115(7):1576-1585.
