miR-145靶向调控DAB2对前列腺癌PC3细胞迁移和侵袭能力的影响
2014-11-17谢树高谢银银张元亮黄秋花
谢树高,谢银银,张元亮,黄秋花
1.上海交通大学医学院附属瑞金医院,医学基因组学国家重点实验室,上海血液学研究所,上海 200025;2.诺思格(北京)医药科技开发有限公司,北京 100048
MicroRNA是一类长约19~24 nt的非编码单链小RNA 分子,可以通过与靶基因 3′非翻译区域(3′UTR)互补结合抑制靶基因翻译成蛋白质,或直接使靶向结合的mRNA发生降解,进而在细胞、组织或个体水平上影响细胞生长、凋亡和分化及生物体的生长发育,并参与多种疾病的发生发展过程。研究发现microRNA的表达具有明显的组织特异性,在一些疾病中 microRNA表达谱的改变具有明显的特征性,尤其是在肿瘤疾病中,其表达与正常组织具有显著差异。
据文献报道miR-145在多种肿瘤中呈低表达[1,2],包括食管癌、胃癌、结直肠癌、前列腺癌、乳腺癌、膀胱癌、肺癌、宫颈癌、胰腺癌和白血病等,通过与多个靶基因KRAS、C-Myc和FSCN1等作用抑制细胞增殖、侵袭和转移,促进细胞凋亡[3~7]。Chiyomaru等[8]运用荧光素酶报告基因检测系统成功鉴定到miR-145靶基因SWAP70(SWAP switching B-cell complex 70 kDa subunit),并证明miR-145可通过下调SWAP70抑制前列腺癌细胞增殖、侵袭和转移。
为了更加深入地研究miR-145在肿瘤发生发展过程中的作用,本研究通过 Targetscan软件对它的靶基因进行预测,结果显示在DAB2(Disabled homolog 2)基因的 3′UTR区域存在多个 miR-145的结合位点。DAB2基因被认为是一个重要的肿瘤抑癌基因,在多种肿瘤标本中常常发生缺失或者发生高度甲基化而表达沉默[9~12]。也有文献报道 TGF-β能通过上调DAB2基因的表达从而促进细胞上皮-间质转化(Epithelial-mesenchymal transition,EMT)过程[13],EMT是肿瘤细胞从原位向远处迁移和侵袭的重要细胞生物学机制[14,15],提示DAB2可能也具备促进肿瘤发展的作用。
PC3是一种具高侵袭能力的前列腺癌细胞株,常常用来研究一些抑癌基因对肿瘤基本生物学功能的影响,如细胞生长、迁移和侵袭等。miR-145在包括前列腺癌在内的多种细胞中表达水平较低,本研究发现PC3细胞内DAB2呈现较高表达状态,miR-145是否能通过靶向调控DAB2进而影响PC3细胞的迁移和侵袭尚未可知。本文以 PC3细胞为模型,对 miR-145和DAB2的相互关系进行研究,以揭示其在肿瘤发生发展过程中的重要作用。
1 材料和方法
1.1 材料
1640培养基、FBS及Opti MEM购自GIBCO;PGEM-T easy试剂盒、pGL3-control和Prl-SV40质粒、双荧光素酶报告基因检测系统购自Promega; 感受态大肠杆菌 TOP10购自天根; 限制性内切酶EcoRⅠ、NotⅠ、T4 DNA连接酶及SYBR premix ExTaq(TLi RNaseH Plus) 荧光定量试剂盒购自宝生物工程(大连)有限公司; ABI高容量逆转试剂盒和SYBR Green PCR Master Mix荧光定量PCR试剂盒购自ABI; KOD plus购自TOYOBO; 质粒提取试剂盒购自 MN(MACHEREY-NAGEL); 核酸纯化试剂盒购自AXYGEN; microRNA转染试剂INTERFERin购自 Polyplus transfection; FuGENE转染试剂购自Roche; TRIzol试剂购自 Invitrogen; 人工合成的miRNA:hsa-miR-145-mimics购自上海吉玛制药,序列如下:
正向 5′-GUCCAGUUUUCCCAGGAAUCCCU-3′;
反向 5′-GGAUUCCUGGGAAAACUGGACUU-3′。
1.2 方法
1.2.1 PC3细胞内miR-145表达水平的检测
细胞收集、裂解和逆转录过程均按照ABI高容量cDNA逆转试剂盒要求进行。取4 µg RNA逆转录成cDNA(逆转录引物为miR-145反向引物,序列见表1)。按照SYBR Green PCR Master Mix荧光定量PCR试剂盒的要求,将逆转录产物作为模板进行PCR反应预处理。PCR预反应产物按照 1:400稀释后取2 µL用于实时定量PCR(ABI)反应( PCR反应预处理及实时定量PCR引物均为miR-145正反向引物,序列见表1),以此检测PC3细胞内 miR-145表达水平。
1.2.2 突变型荧光素酶报告基因载体的构建
经TargetScan预测人DAB2基因3′UTR区域含有3个miR-145结合位点。PCR扩增含有这3个位点的区域(扩增引物为DAB2-3′UTR正反向引物,序列见表1),将扩增得到的片段连接入PGEM-T easy载体,测序获得阳性克隆后,EcoRⅠ单酶切构建入PGL3载体,插入的DAB2基因 3′UTR区域片段长825 bp。以构建的pGL3-DAB2-3′UTR质粒为模板分别进行定点缺失突变(突变引物分别为DAB2-3′UTR-del1084-1090、DAB2-3′UTR-del1604-1610 及DAB2-3′UTR-del1737-1743正反向引物,序列见表1),突变完成后取5 µL产物于1%琼脂糖电泳检测,取10µL产物转化并进行质粒抽提及测序鉴定。
1.2.3 荧光素酶报告基因检测miR-145对DAB23′-UTR的转录调控
293T细胞铺48孔板,培养24 h之后在FuGENE转染试剂介导下,将pGL3-DAB2-3′UTR及各缺失突变型质粒与 hsa-miR-145-mimics和 SV40质粒共转染,设3个复孔。转染后24 h弃培养液,1×PBS洗3次,每孔加入100 µL的PLB裂解液,充分裂解细胞,取20 µL细胞裂解液加入100 µL LARII,测荧光强度 1(A),加入 100 µL Stop & Glo试剂,测荧光强度2(B)。实验得到的数据按照A:B计算比值。
1.2.4 细胞培养和miR-145转染
用含10%FBS的RPMI MEDIUM 1640培养基培养PC3细胞。细胞在3.5 cm培养皿中生长至60%汇合时,同步进行 hsa-miR-145-mimics和 miRNA 阴性对照(Negative control,NC)的转染。转染按照INTERFERin转染试剂说明书进行,使microRNA的终浓度为100 nmol/L和200 nmol/L; 转染完12 h更换新鲜培养基,然后间隔24 h换培养基直至转染完72 h收取细胞。
1.2.5DAB2基因 mRNA和蛋白表达水平检测(Western blot)
收取转染 hsa-miR-145-mimics和 NC 72 h的PC3细胞,用 TRIzol试剂裂解并抽提总 RNA,经NanoDrop紫外定量仪定量,分别取1 µg 总RNA用TaKaRa PrimeScript RT Reagent kit with gDNA Eraser 试剂盒逆转录成cDNA。将逆转录产物20倍稀释之后取2 µL用于20 µL体系实时定量PCR(ABI 7500定量PCR仪),采用TaKaRa公司的SYBR premix ExTaq(TLi RNaseH Plus)试剂盒,以HPRT为内参(实时定量PCR引物为DAB2和HPRT正反向引物,序列见表1)。
将上一步实验获得细胞用 RIPA裂解液加罗氏蛋白酶抑制剂 cocktail裂解,离心后取上清并用Bradford试剂定量。hsa-miR-145-mimics组及NC 200 nmol/L组样本上样量均为30 µg。10%SDS PAGE胶在110 V恒压电泳2.5 h,转移蛋白至PVDF膜上。转膜后经丽春红染色检查转膜效果,用封闭液(TBST含5%脱脂奶粉)封闭1 h。一抗孵育时DAB2使用比例为 1:500,内参:β-actin使用比例为 1:10 000,4℃过夜。然后TBST洗膜3次,每次10 min。
1.2.6 细胞迁移和侵袭能力检测
按前述转染方法将 hsa-miR-145-mimics及 NC分别瞬时转入PC3细胞(终浓度为200 nmol/L),转染24 h后将细胞按每孔5×105接种到6孔板上。细胞贴壁24 h后细胞基本汇合,迅速在细胞上划出宽度均一的划痕,洗去悬浮的细胞之后将培液换成低血清浓度(1%)培养基。然后选取0 h、6 h、12 h、24 h及36 h等时间点拍照记录同一位置细胞迁移情况。
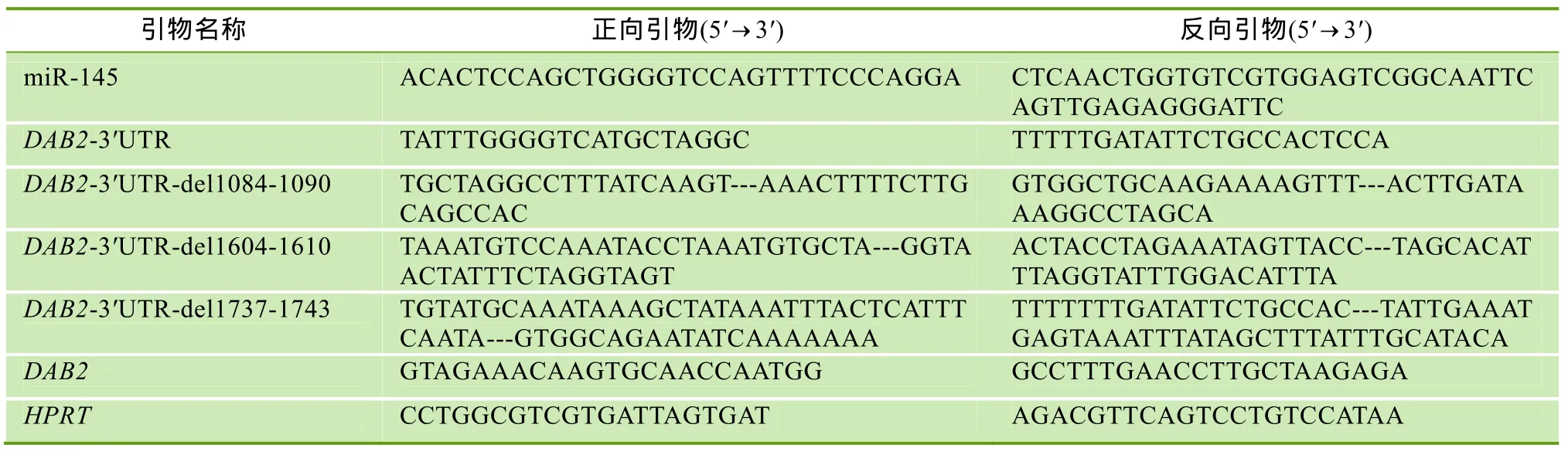
表1 本文所用引物信息
细胞侵袭实验过程如下:将前述 hsa-miR145-mimics及NC瞬时转入的PC3细胞于转染48 h后用BD公司BD BioCoat™ -Matrigel Invasion Chambers试剂盒进行细胞侵袭实验,每孔初始细胞量为5×104,侵袭后用0.1%结晶紫染色,全片计数。具体流程参考BD说明书。
1.2.7Dab2过表达及修复实验
将小鼠Dab2基因全长cDNA克隆入真核表达载体 MigR1的NotⅠ单酶切位点。将 7×105PC3细胞接种到6 cm 细胞培养皿中,细胞密度达到50%~70%左右用Lipo2000转染体系转入MigR1-Dab2及MigR1空载质粒,转染前2 h换液。转染体系如下:Opti-MEM 300 µL,质粒 8 µg,Lipo2000 20 µL; 混匀静置 20 min; 将混合物逐滴加入到细胞中,轻轻晃匀,置于 37℃培养; 24 h后将细胞按合适比例传代,传代24 h后转染hsa-miR145-mimics及NC。24 h后分 PC3、PC3+Dab2、PC3+hsa-miR145-mimics、PC3+Dab2+hsa-miR145-mimics 等 4组分别进行迁移和侵袭能力检测。
1.2.8 统计学分析
对荧光素酶报告基因系统检测、实时定量PCR检测及侵袭能力检测得到的数据应用 Graphpad Prism 5软件进行统计学分析,对所有待比较数据进行t检验分析,P<0.05为显著差异,具有统计学意义。
2 结果与分析
2.1 miR-145抑制前列腺癌细胞PC3的迁移和侵袭
鉴于已有文献报道miR-145具有抑制肿瘤细胞功能的作用,本研究选择了具高侵袭能力但 miR-145低表达的前列腺癌细胞 PC3,观察 miR-145对PC3细胞株主要生物学功能的影响。在PC3细胞株中瞬时过表达hsa-miR145-mimics化学小分子,进行体外划痕实验。NC组在划痕6 h已能观察到一些细胞的迁移,36 h基本铺满整个划痕区域; 然而 hsamiR145-mimics处理的细胞直到24 h才能观察到少量细胞的迁移,两组间存在显著差异(图1A),提示miR-145可以有效抑制PC3细胞的迁移能力。
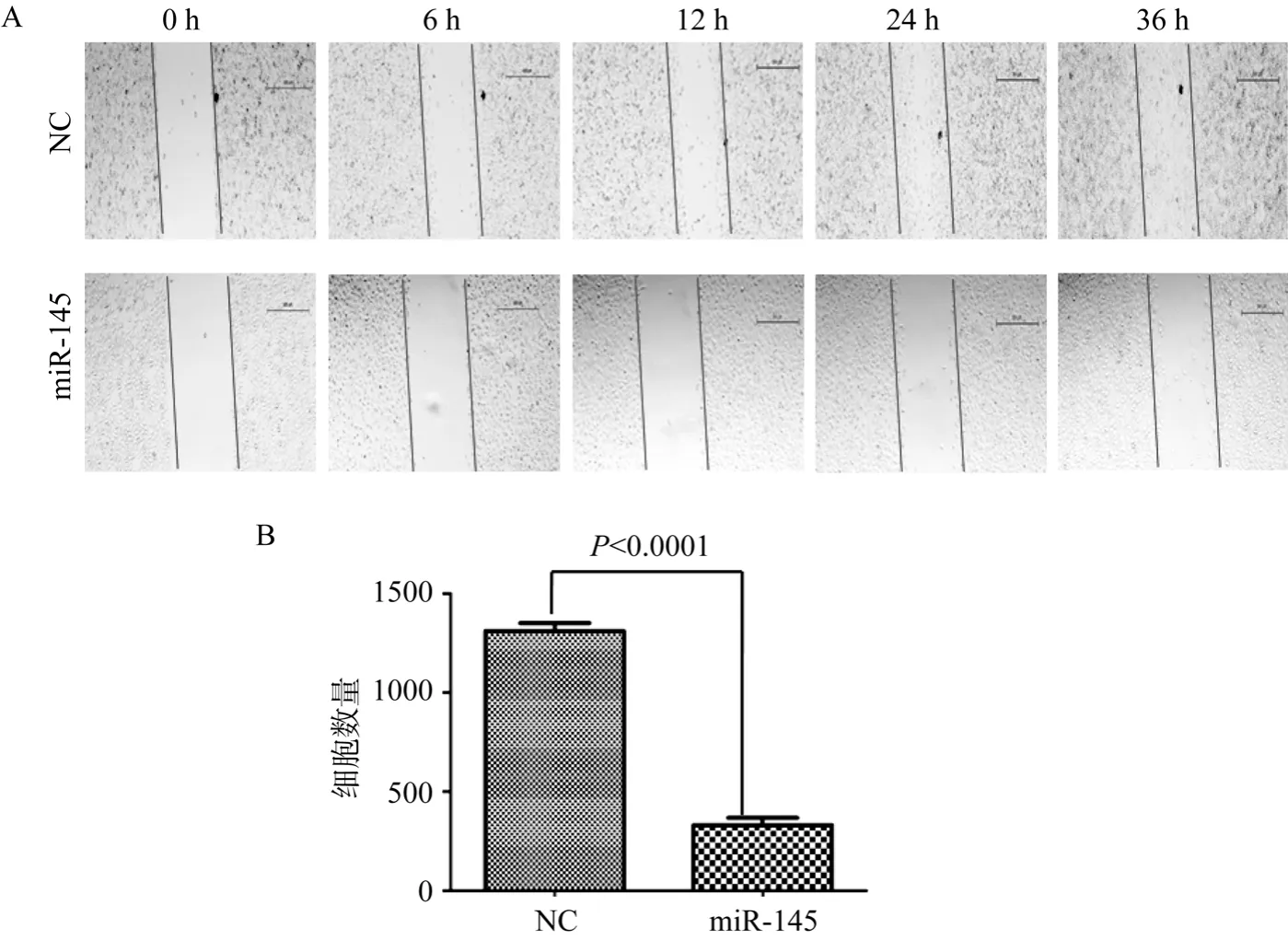
图1 miR-145过表达后PC3细胞迁移和侵袭能力检测结果
同时采用 Transwell chamber试剂盒检测 miR-145对PC3细胞侵袭能力的影响。结果显示,NC转染组穿膜细胞计数为1312±40,miR-145转染组穿膜细胞计数为332±37,PC3细胞过表达miR-145之后其穿过半透膜的能力显著低于NC组(P<0.0001)(图1B),提示 miR-145可以有效抑制 PC3细胞的侵袭能力。
2.2 miR-145在体外可以靶向调节DAB2基因
为了进一步探寻miR-145抑制PC3细胞迁移和侵袭的机制,本研究应用 Targetscan软件来预测其潜在靶基因,发现DAB2基因的 3′UTR区域存在 3个 miR-145的结合位点,分别位于DAB23′UTR 1084-1090、1604-1610及 1737-1743(图2A)。为了证实DAB2确为miR-145的靶基因,825 bp的DAB2基因3′UTR区域被构建到pGL3荧光素酶报告基因的载体中,miR-145的3个结合位点分别作单独及联合缺失突变,分析miR-145对这些突变体的调控作用。体外荧光素酶报告基因检测结果显示,miR-145可以显著抑制野生型DAB2组的荧光素酶活性,突变任何一个结合位点都可以恢复荧光素酶的活性(图2B),提示miR-145在体外可以靶向调节DAB2基因。
2.3 DAB2在高侵袭前列腺癌细胞PC3中相对高表达
DAB2基因被赋予“抑癌基因”的称号,为了明确其在前列腺癌细胞中的表达水平,本研究选取了代表前列腺癌不同进展阶段的 LnCAP、Du145及PC3细胞株,并通过实时定量 PCR的方法检测DAB2基因在这3个细胞株中的表达水平。结果显示,DAB2在高侵袭PC3细胞株中表达水平最高(图3A)。
2.4 miR-145可以抑制PC3细胞内DAB2的表达水平
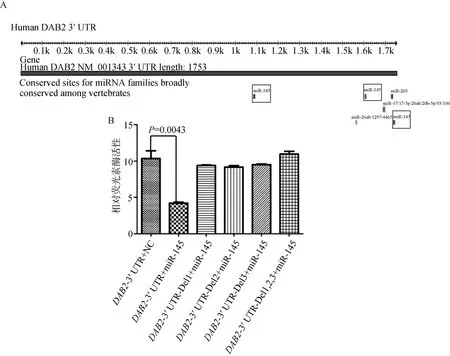
图2 荧光素报告基因检测miR-145对DAB2-3′UTR的调节作用

图3 外源表达miR-145前后PC3细胞内DAB2表达水平的检测
体外实验已经证实miR-145可以靶向抑制DAB2,那么PC3细胞内高表达的DAB2能否被miR-145靶向抑制?鉴于 miRNA主要通过降解靶基因 mRNA或者抑制靶基因蛋白翻译,从而达到影响靶基因的表达水平。因此,本研究在 PC3细胞内外源表达miR-145后,分别采用实时定量RT-PCR以及Western blot的方法,检测DAB2的mRNA和蛋白质表达水平。结果显示,miR-145转染组的DAB2的mRNA表达水平呈降低趋势,但下调幅度未达 2倍(图 3B),而DAB2蛋白条带明显弱于对照组(图3C)。上述结果提示在PC3细胞内miR-145可能主要在蛋白翻译层面抑制DAB2的表达。
2.5 外源表达Dab2可以部分解除miR-145对PC3细胞迁移和侵袭能力的抑制
miR-145对PC3细胞迁移和侵袭能力的抑制是否通过靶向调控DAB2基因发挥作用?为了回答这个问题,本研究在miR-145处理的PC3细胞株中过表达不包含3′UTR的小鼠Dab2全长质粒,并检测其迁移和侵袭能力。结果显示,与单转 miR-145组相比,miR-145和Dab2共表达组细胞迁移能力有显著恢复(图 4A); 侵袭能力检测实验中穿膜细胞计数PC3空白对照组为1320±17,PC3过表达Dab2组为1377±7,PC3过表达 miR-145组为 429±11,PC3过表达 miR-145+Dab2组为 946±11,与单转 miR-145组相比,miR-145和Dab2共表达组细胞迁移能力有显著回复(P<0.0001)(图 4B)。上述实验数据表明,miR-145对PC3细胞迁移和侵袭能力的抑制至少部分是通过靶向抑制DAB2这条途径发挥作用。
3 讨 论
miR-145已被证实在多种肿瘤中呈低表达,并可通过与多个靶基因的作用抑制肿瘤细胞的生物学功能,本文通过靶点预测和体外荧光素酶报告基因实验发现miR-145能靶向抑制DAB2。同时实验结果显示3个miR-145预测结合位点对于DAB2的抑制效果相近,任一位点缺失突变之后这种抑制作用均被不同程度解除,3个位点联合缺失突变则能完全解除抑制。
PC3细胞中外源表达miR-145后PC3细胞的迁移和侵袭能力有显著降低,但是将DAB2与miR-145共同转进PC3细胞之后,DAB2在一定程度上能够纠正 miR-145对肿瘤细胞迁移和侵袭能力的抑制作用。这些数据证实DAB2是miR-145的下游靶基因之一,并可能在前列腺癌细胞的转移和侵袭过程中扮演了一个重要角色。与此类似的是,当我们在PC3细胞中通过shRNA特异性降低DAB2基因的表达水平,可以明显抑制 PC3细胞迁移和侵袭能力,同样 在DAB2低表达的前列腺癌细胞株LnCAP中过表达小鼠Dab2基因,可以明显增强LnCAP细胞的侵袭能力(另文发表)。进一步提示 DAB2在前列腺癌细胞的转移和侵袭过程中扮演着重要作用。

图4 外源表达Dab2后检测miR-145对PC3细胞迁移和侵袭能力的影响
DAB2一直以来被认为是一个重要的肿瘤抑癌基因,在多数肿瘤细胞中表达低下,然而本研究结果显示在高侵袭能力的前列腺癌细胞株 PC3中DAB2表达较高,且受到另一肿瘤抑制因子miR-145的抑制,这个现象引起我们高度关注。另外,近年来在其他肿瘤细胞中也有DAB2的报道,如Yang等[16]在恶性外周神经鞘瘤中也发现DAB2基因表达异常增高。Chao等[17]发现在卵巢癌患者中DAB2能影响癌细胞增殖和肿瘤进展。这就提示我们,DAB2可能在肿瘤的发生发展不同阶段通过不同的作用机制从而发挥了重要的生物学作用。
已有研究证实DAB2是上皮细胞发生EMT的关键因子,现有的大量研究证据表明,EMT 在肿瘤的恶性演进过程中也发挥了举足轻重的作用,多数肿瘤在原位时已经发生了EMT过程,上皮细胞的多形性改变和去分化是肿瘤侵润和演进过程中的重要标志。在乳腺癌和结肠癌中的研究结果表明,肿瘤细胞外形的改变及其粘附性的下降或消失在肿瘤的原位侵润和异位转移以及新的转移灶的形成过程中起到重要的作用[18]。在前列腺癌的研究中,Untergasser等[19]发现,用 TGF-β1、β2及 β3干预人前列腺细胞24 h后,上皮细胞表达间充质细胞标志物:波形纤维蛋白,提示EMT过程的发生。DAB2是否参与了前列腺癌的EMT发生过程? miR-145是否通过调控DAB2参与了前列腺癌的EMT发生过程?这些问题都有待更深入地研究。
[1]Porkka KP,Pfeiffer MJ,Waltering KK,Vessella RL,Tammela TL,Visakorpi T.MicroRNA expression profiling in prostate cancer.Cancer Res,2007,67(13):6130–6135.
[2]Ozen M,Creighton CJ,Ozdemir M,Ittmann M.Widespread deregulation of microRNA expression in human prostate cancer.Oncogene,2008,27(12):1788–1793.
[3]Michael MZ,SM OC,Van Holst Pellekaan NG,Young GP,James RJ.Reduced accumulation of specific microRNAs in colorectal neoplasia.Mol Cancer Res,2003,1(12):882–891.
[4]Takagi T,Iio A,Nakagawa Y,Naoe T,Tanigawa N,Akao Y.Decreased expression of microRNA-143 and -145 in human gastric cancers.Oncology,2009,77(1):12–21.
[5]Akao Y,Nakagawa Y,Naoe T.MicroRNAs 143 and 145 are possible common onco-microRNAs in human cancers.Oncol Rep,2006,16(4):845–850.
[6]Kano M,Seki N,Kikkawa N,Fujimura L,Hoshino I,Akutsu Y,Chiyomaru T,Enokida H,Nakagawa M,Matsubara H.miR-145,miR-133aandmiR-133b:Tumor-suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma.Int J Cancer,2010,127(12):2804–2814.
[7]Bandrés E,Cubedo E,Agirre X,Malumbres R,Zárate R,Ramirez N,Abajo A,Navarro A,Morenó I,Monzo M,García-Foncillas J.Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues.Mol Cancer,2006,5:29.
[8]Chiyomaru T,Tatarano S,Kawakami K,Enokida H,Yoshino H,Nohata N,Fuse M,Seki N,Nakagawa M.SWAP70,actin-binding protein,function as an oncogene targeting tumor-suppressive miR-145 in prostate cancer.Prostate,2011,71(14),doi:10.1002/pros.21372.
[9]Chen H,Toyooka S,Gazdar AF,Hsieh JT.Epigenetic regulation of a novel tumor suppressor gene(hDAB2IP) in prostate cancer cell lines.J Biol Chem,2003,278(5):3121–3130.
[10]Dote H,Toyooka S,Tsukuda K,Yano M,Ouchida M,Doihara H,Suzuki M,Chen H,Hsieh JT,Gazdar AF,Shimizu N.Aberrant promoter methylation in human DAB2 interactive protein(hDAB2IP) gene in breast cancer.Clin Cancer Res,2004,10(6):2082–2089.
[11]Dote H,Toyooka S,Tsukuda K,Yano M,Ota T,Murakami M,Naito M,Toyota M,Gazdar AF,Shimizu N.Aberrant promoter methylation in human DAB2 interactive protein(hDAB2IP) gene in gastrointestinal tumour.Br J Cancer,2005,92(6):1117–1125.
[12]Yano M,Toyooka S,Tsukuda K,Dote H,Ouchida M,Hanabata T,Aoe M,Date H,Gazdar AF,Shimizu N.Aberrant promoter methylation of human DAB2 interactive protein(hDAB2IP) gene in lung cancers.Int J Cancer,2005,113(1):59–66.
[13]Prunier C,Howe PH.Disabled-2(Dab2) is required for transforming growth factor β-induced epithelial to mesenchymal transition(EMT).J Biol Chem,2005,280(17):17540–17548.
[14]Jechlinger M,Grunert S,Tamir IH,Janda E,Lüdemann S,Waerner T,Seither P,Weith A,Beug H,Kraut N.Expression profiling of epithelial plasticity in tumor progression.Oncogene,2003,22(46):7155–7169.
[15]Strizzi L,Bianco C,Normanno N,Seno M,Wechselberger C,Wallace-Jones B,Khan NI,Hirota M,Sun YP,Sanicola M,Salomon DS.Epithelial mesenchymal transition is a characteristic of hyperplasias and tumors in mammary gland from MMTV-Cripto-1 transgenic mice.J Cell Physiol,2004,201(2):266–276.
[16]Yang JL,Du XL.Genomic and molecular aberrations in malignant peripheral nerve sheath tumor and their roles in personalized target therapy.Surg Oncol,2013,22(3):e53–e57.
[17]Chao A,Lin CY,Lee YS,Tsai CL,Wei PC,Hsueh S,Wu TI,Tsai CN,Wang CJ,Chao AS,Wang TH,Lai CH.Regulation of ovarian cancer progression by microRNA-187 through targeting Disabled homolog-2.Oncogene,2012,31(6):764–775.
[18]Thiery JP.Epithelial-mesenchymal transitions in development and pathologies.Curr Opin Cell Biol,2003,15(6):740–746.
[19]Untergasser G,Gander R,Rumpold H,Heinrich E,Plas E,Berger P.TGF-β cytokines increase senescence-associated beta-galactosidase activity in human prostate basal cells by supporting differentiation processes,but not cellular senescence.Exp Gerontol,2003,38(10):1179–1188.
