UPLC法测定乳制品中的纳他霉素
2014-11-16
(国家农副产品监督检验中心(新疆),新疆乌鲁木齐 830011)
纳他霉素又称游链霉素,是一种重要的多烯类大环内酯抗菌素。纳他霉素在大多数食品的pH范围内非常稳定,是一种天然、广谱、高效安全的酵母菌及霉菌等丝状真菌抑制剂,它不仅能够抑制真菌,还能防止丝状真菌中黄曲霉毒素的产生[1-3]。实验发现0.5 mg/kg~10 mg/kg的纳他霉素含量即可抑制绝大多数霉菌,其对霉菌的抑菌能力是普通化学防腐剂的30倍~50倍[4]。由于纳他霉素具有无致突变、致癌、致畸和致敏作用,不诱导微生物产生抗性等优点,目前该产品已经在50多个国家得到广泛使用[5]。1997年我国卫生部正式批准纳他霉素作为食品防腐剂,但是在乳粉、酸奶、纯牛奶等乳制品中不允许使用[6]。但经过调查,发现一些乳制品企业仍在其生产中使用纳他霉素。
目前文献报道中,纳他霉素的分析方法主要有高效液相色谱法[7-11]、薄层层析法[12]、紫外风光光度法[13-15]、微生物法[16]等,高效液相色谱法已经列入国标方法[17]。但由于液相分析中基质干扰严重,产品中的纳他霉素“假阳性”验证工作也非常重要。本试验在现有国家标准的基础上建立了乳制品中纳他霉素残留量的检测方法,该方法前处理简单,回收率及灵敏度高,准确度和稳定性好,适用于监控乳制品厂家纳他霉素的添加残留量,从而保障食品安全;并在实验基础上,探讨了几种“假阳性”验证方法,对检测工作的准确性和质检部门的权威性有一定的指导意义。
1 材料与方法
1.1 材料与试剂
甲醇(HPLC级):美国Fisher公司;冰乙酸(优级纯):中国上海国药公司;纳他霉素标准品(纯度>95%):德国Dr.Ehrenstorfer公司;水为超纯水。
1.2 仪器与设备
Waters ACQULITY UPLC H-class高效液相色谱仪(配有紫外检测器、高速冷冻离心机):德国SIGMA公司;超纯水仪:开普勒公司;UV-2450紫外-可见分光光度计:日本岛津公司;TSQ access Quantum高效液相色谱-质谱/质谱仪:Thermo Fisher Scientific公司;电子分析天平:梅特勒托利多公司。
1.3 标准溶液的配制、线性范围及最低检出限、回收率
精确称取10 mg纳他霉素,转移到10 mL棕色容量瓶中,用甲醇定容到刻度,配制成质量浓度为1mg/mL的标准贮备液,避光,放入-20℃冰箱中备用。准确量取储备液,用高纯水稀释定容,配制纳他霉素的浓度梯度为 0.2,0.8,2.0,4.0,8.0 μg/mL 的标准溶液。 并测定出最低检出限。选用在空白样品中添加纳他霉素,测定乳制品中的回收率。
1.4 色谱条件
色谱柱:Waters ACQUITY BEH C18,流动相:水∶甲醇=55 ∶45,流速:200 μL/min,柱温:30 ℃,进样体积:1 μL,检测波长:303 nm。
1.5 前处理方法
称取样品5.00 g(精确到0.01 g)于50 mL塑料离心管中,加入15 mL甲醇,超声提取30 min,加水定容至25 mL,摇匀,冰箱冷冻1 h。取样液过孔径0.22 μm滤膜,进行液相色谱分析。
1.6 测定及定性定量方法
在本文选定的色谱条件下,分别吸取1 μL样品溶液及标准工作液上机分析。根据保留时间定性,外标法定量。标准溶液及阳性样品色谱图如图1所示。

图1 纳他霉素标准溶液及阳性样品色谱图Fig.1 Spectra of natamycin standard solution and positive sample
2 结果与分析
2.1 检测波长的确定
采用紫外-可见分光光度计在190 nm~900 nm波长范围内进行扫描,最大吸收波长在303 nm处(如图2所示),因此选择303 nm作为检测波长。
2.2 流动相的确定
本实验考察了反相色谱常用的流动相:甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.01%甲酸水。结果表明流动相中是否加酸对灵敏度及保留能力影响不大,同时由于乙腈毒性较大且价格昂贵,最终选择了甲醇-水为流动相。对流动相的比例进行了优化,当水∶甲醇=55∶45时,纳他霉素基本可以和基质完全分离,且灵敏度较高。
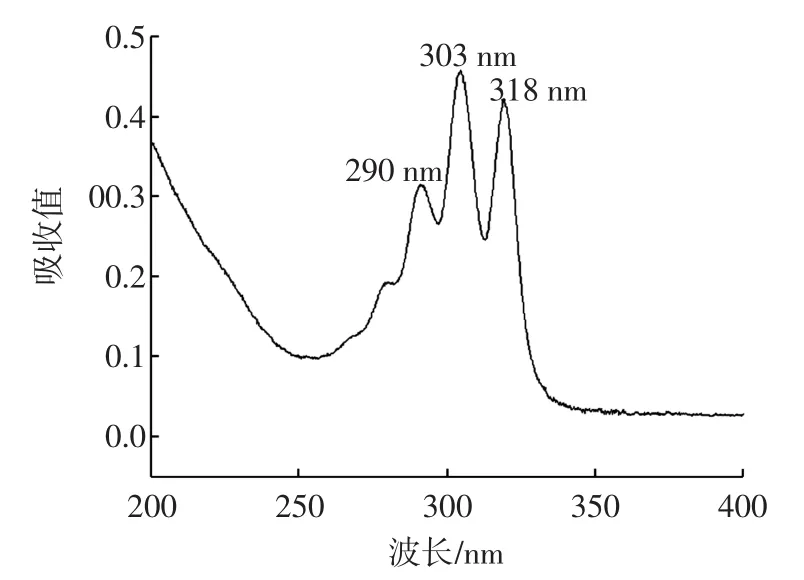
图2 纳他霉素200-400nm UV光谱图Fig.2 200-400 nm UV spectra of natamycin
2.3 线性方程、相关系数、检出限
将纳他霉素系列标准工作溶液(0.2,0.8,2.0,4.0,8.0μg/mL)按照1.4节中的条件进样分析。以纳他霉素的质量(X,μg)为横坐标,峰面积(Y)为纵坐标作图,得线性方程为Y=2.48×107X+3.31×103,线性相关系数R2=0.999 7。以3倍噪声值与最小浓度的色谱峰峰高比较,计算出检出限为0.02μg/mL,根据前处理方法计算,该方法的最低检出限为0.1mg/kg,表明乳制品中纳他霉素含量在0.1 mg/kg~40 mg/kg时具有良好的线性关系。
2.4 回收率的测定
在酸奶、奶酪空白样品中添加3个浓度水平的纳他霉素标准溶液,做回收率试验,结果列于表1。
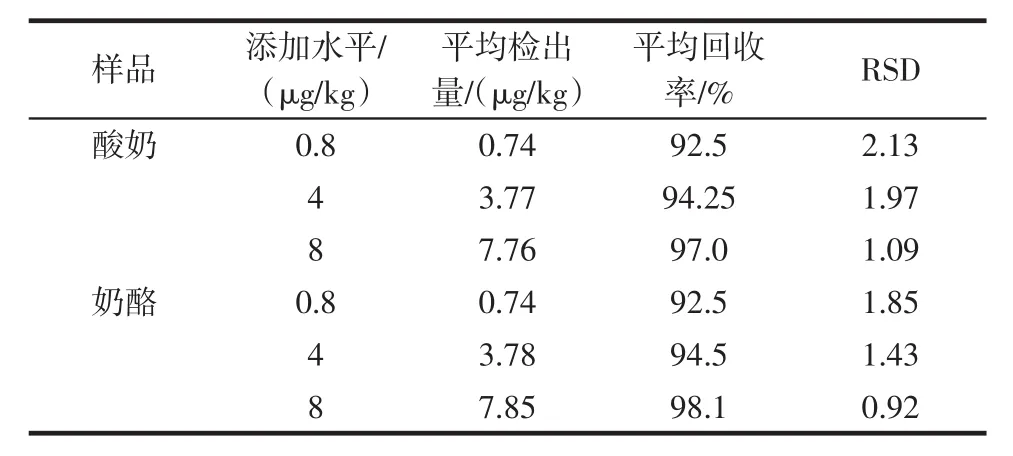
表1 纳他霉素在乳制品中的回收率Table 1 Recovries of natamycin in dairy
在纳他霉素浓度的3个水平上,回收率在92.5%~98.1%(n=6)之间,相对标准偏差(RSD)0.92%~2.13%。因此,该方法准确度、重复性良好。
2.5 “假阳性”样品的验证方法
由于基质的复杂性,本方法的前处理方法难以消除部分基质干扰,在定性方面有一定的弊端,容易引起假阳性。实验过程中,可以通过以下方法进行“假阳性”验证。
2.5.1 加标法
对疑似阳性的样品进行加标实验,若加标样品流出的色谱峰并未出现新的组分或肩峰,呈现出完好的对称性,且保留时间基本不变,则初步判断为阳性(如图3所示),但仍有分离效果差导致两者不能分离的可能。
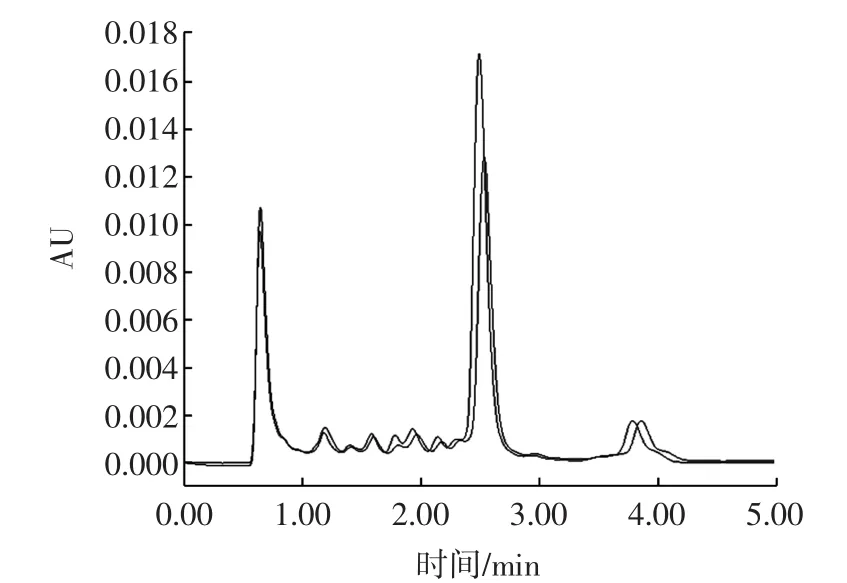
图3 样品与加标后样品纳他霉素的色谱图Fig.3 Natamycin chromatogram of sample and addingstandarded sample
2.5.2 双柱法
双柱法是常用的假阳性验证方法之一。通过改变色谱柱,即改变纳他霉素的保留性,可改变纳他霉素的保留时间,再将样品的保留时间与标准物质进行对照,即可确定是否存在“假阳性”。如图4所示。
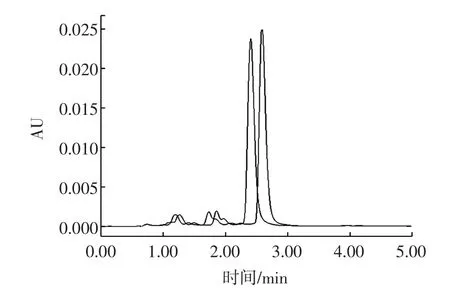
图4 不同色谱柱的纳他霉素色谱图Fig.4 Natamycin chromatogram on different columns
更换后的色谱柱保留较强,纳他霉素延后出峰,若两种色谱柱上样品与标准溶液出峰均一致,则可判断为阳性样品。
2.5.3 改变流动相极性法
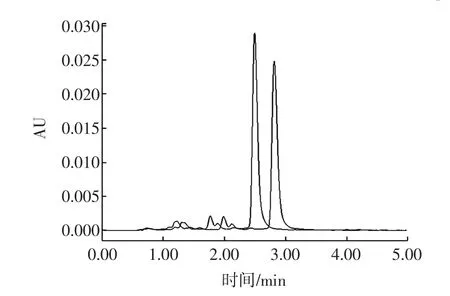
图5 不同流动相比例下纳他霉素的色谱图Fig.5 Natamycin chromatogram at different ratio of mobile phase
改变流动相组成或者配比,即可改变流动相的洗脱强度,同样也可以改变纳他霉素的保留时间,确定样品是阴性样品还是阳性样品。如图5所示,将pH=3.0乙酸水溶液与甲醇比例由55∶45改变为60∶40,流动相洗脱能力减弱,纳他霉素出峰时间延后,若在不同的流动相比例下样品与标准溶液保留时间均能保持一致,则判断为阳性样品。
2.5.4 分光光度法
当纳他霉素残留量较高时,分光光度法也可进行验证。对4 μg/mL和样品进行测试,光谱图如图6所示,吸收波长303 nm和320 nm光区干扰较少,基本可以判定样品是否含有纳他霉素。
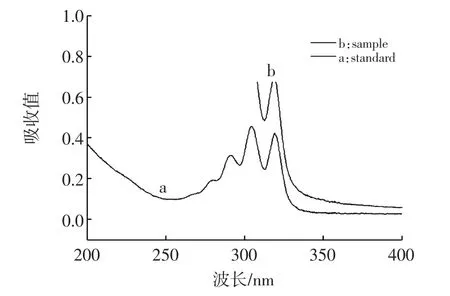
图6 标液和阳性样品的光谱图比较Fig.6 Comparison of spectra of standard solution and sample
2.5.5 二极管阵列检测器法
对于联有二极管阵列检测器的高效液相色谱仪,二极管阵列检测器可以对分离后的色谱图进行光谱分析,验证色谱峰的光谱图及其纯度,可以进行阳性验证。若光谱图与标准物质峰型差别很大,则判为“假阳性”;若光谱图与标准物质峰型基本类似,则有可能混有其它物质,需要进一步分离后才能定性定量;若光谱图与标准物质峰型基本一致,只有吸光度大小的差异,则判为阳性样品。
2.5.6 高效液相色谱-质谱/质谱法[18]
样品经过液相色谱分离后,进入质谱检测器。质谱法采用选择反应监测(Selective Reaction Monitoring,SRM)扫描模式,子离子风度比进行定性,消除了基质干扰,是目前最准确的定性方式。阳性样品不但总离子流图与标准溶液基本一致(如图7a和7c所示),子离子及选定的子离子风度比均与标准物质一致(如图7b和7d所示)。而“假阳性”样品在离子流图上或者不出峰,或者离子风度比与标准物质差别不在允许误差范围内。
3 结论
本文建立了纳他霉素的常规液相色谱检测方法,该方法前处理简单,回收率及灵敏度高,准确度和稳定性好,适用于日常的食品监督工作。同时,也讨论了常用的“假阳性”验证方法,对消除“假阳性”、维护质检部门的权威性有着一定的的现实意义。
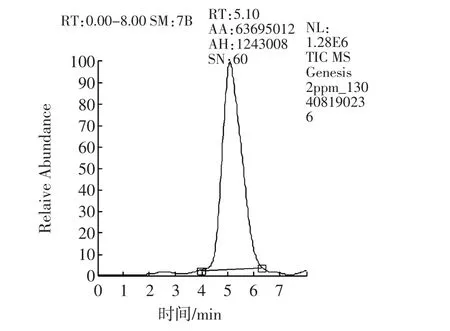
图7a 纳他霉素标准溶液总离子流图Fig.7a Total ion current of natamycin
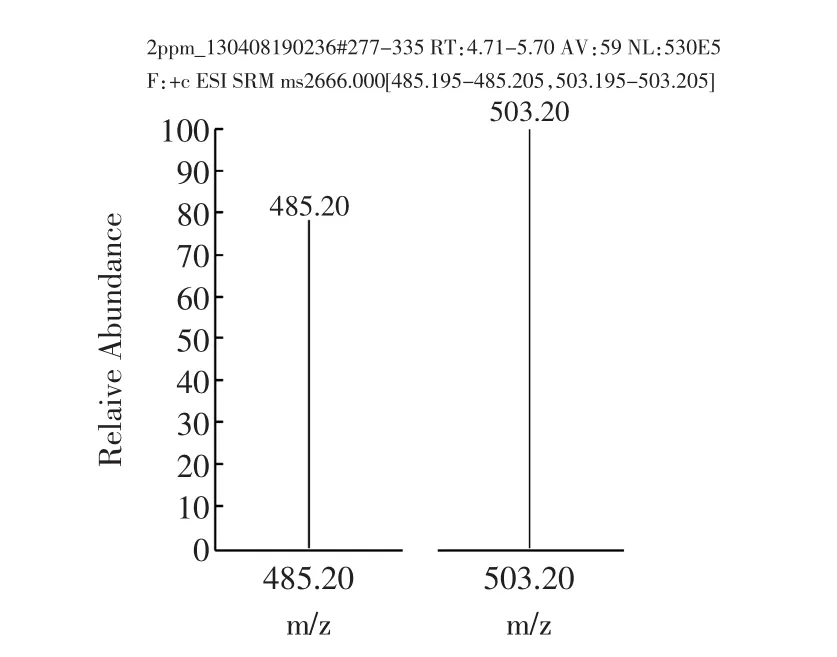
图7b 纳他霉素标准溶液定性离子与定量离子Fig.7b Qualitative ion and quantitative ion of natamycin standard
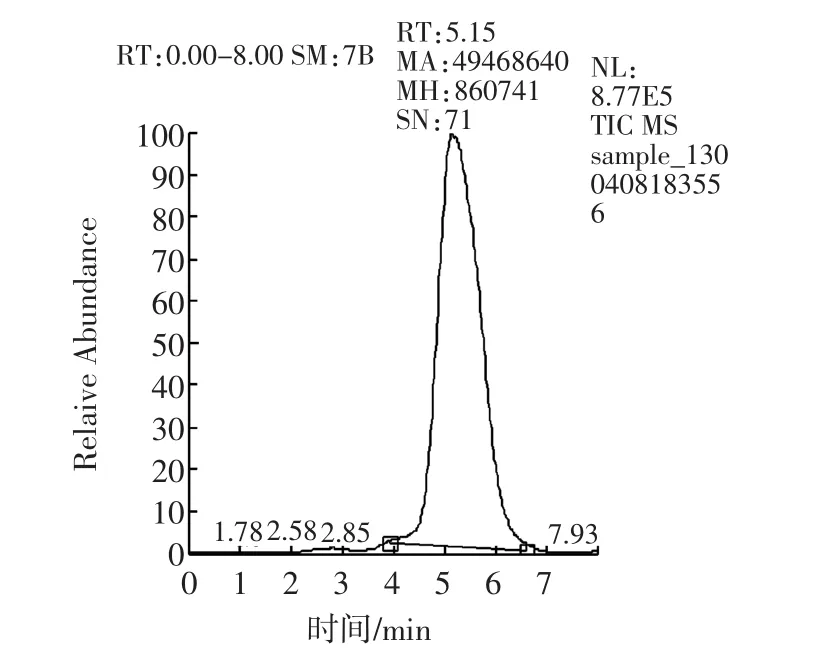
图7c 阳性样品总离子流图Fig.7c Total ion current of positive sample
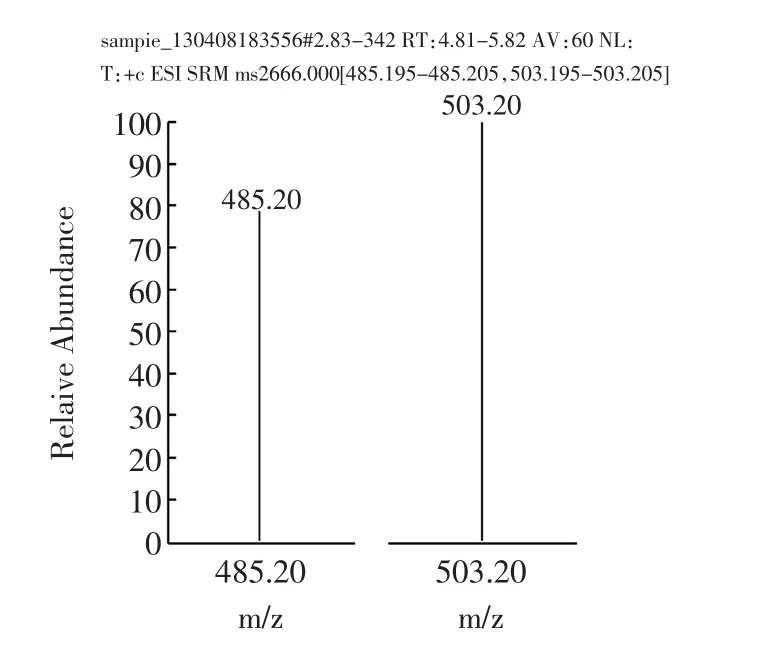
图7d 阳性样品定性离子与定量离子Fig.7d Qualitative and quantitative ion of negative sample
