苯妥英钠对慢性高眼压兔视神经的保护作用
2014-11-13王心淼崇晓霞陈晔
王心淼 崇晓霞 陈晔
青光眼是一组严重威胁视神经功能的眼病,2000年全球约有670万患者因青光眼致盲[1]。目前青光眼的发病机制并未完全明确,高眼压一直被认为是引起青光眼视神经损害的重要机制,因而目前治疗青光眼的主要手段就是降低眼压,然而部分患者眼压降至正常后视功能还发生进一步损害[2-3],说明高眼压并不是导致青光眼视神经损害的唯一病因。近年来有研究发现青光眼患者视网膜神经节细胞(ratinal ganglion cell,RGC)发生选择性损伤,且这种选择性损伤是以细胞凋亡为主要特征的[4]。而导致神经细胞变性坏死(凋亡)的一个重要因素就是细胞内异常的Na+内流,因而Na+通道阻滞剂能够减少神经轴突的二次损伤并增加损伤的修复[5]。
抗惊厥药物苯妥英钠(Na+通道阻滞剂)为二苯乙内酰脲的钠盐,对各种组织的可兴奋膜,包括神经元和心肌细胞膜有稳定作用,而对正常的低频度放电并无明显影响。国外已有文献报道苯妥英钠对动物中枢神经损伤有保护作用[6]。我们通过研究苯妥英钠对青光眼视神经细胞的影响来观察此药物是否能够阻止或延缓其凋亡过程,为证明苯妥英钠具有保护视神经的作用提供实验依据。
1 材料与方法
1.1 材料 成年新西兰大白兔30只,雌雄不限(由内蒙古医科大学动物中心提供),体质量2.5~3.0 kg。苯妥英钠片(山西汾河制药有限公司,每片50 mg)。
1.2 方法
1.2.1 模型的制作 速眠新注射液(长春军事医学科学院生产)0.1 mL·kg-1兔耳缘静脉注射,待麻醉固定后每眼通过1 mL注射器切口抽取房水0.1 mL,随后注射等量的 3 g·L-1复方卡波姆溶液[7],术毕红霉素眼膏涂眼。
1.2.2 动物分组 将30只大白兔随机分为高眼压组、高眼压治疗组与正常眼压组(每组各10只)。高眼压治疗组于高眼压造模前3 d[8]开始苯妥英钠悬液灌胃,剂量为 30 mg·kg-1[9],每天 1 次,持续 4周,高眼压组仅制作高眼压模型,正常眼压组不作任何处理。
1.2.3 眼压测量 固定动物,5 g·L-1地卡因滴眼3次,用眼压计(苏州医疗器械厂生产)测量眼压,术后每天1次,每次取3个有效测量值的平均值为结果,1周后每周测 3次,如眼压低于 28 mmHg(1 kPa=7.5 mmHg),则用上述方法调整。
1.2.4 RGC及视网膜标本制作及观察 高眼压术后4周时,以气体栓塞法处死兔,摘取眼球,并在6点钟位角膜缘缝线标记,中性甲醛固定,常规酒精梯度脱水,平行于视神经纵行剖开眼球,二甲苯透明、浸蜡、包埋。平行于眼球剖面做5 μm常规石蜡连续切片4张,HE染色前将组织切片在室温下晾干2 h。常规 HE染色,酒精脱水,二甲苯透明,树胶封片。剩余2张采用TUNEL标记凋亡细胞[10],按南京凯基试剂盒说明步骤行TUNEL染色。阳性结果的判定以细胞核中可见到棕黄色颗粒为标准。
1.2.5 图像分析 眼球标本选择在视盘旁3 mm部位,随机选择每个切片的5个视野,行HE染色,并于高倍镜下观察视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度(内界膜至节细胞层内侧)。TUNEL染色后高倍镜下观察,RGC细胞计数采用在高倍镜下(400倍)使用0.5网形目镜尺计数视网膜(62.5 μm2)凋亡阳性细胞数,每个标本计数5个视野,取其平均数,计算每100 μm2中 RGC凋亡细胞数和内核层凋亡细胞数,作为后视网膜产生细胞凋亡的定量指标。
1.3 统计学处理 采用SPSS 15.0软件进行方差分析,采用 SNK-t检验进行均数间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 正常眼压组、高眼压组与高眼压治疗组实验前后眼压变化 实验前各组眼压差异无统计学意义(P>0.05,见表1),各时间点正常眼压组眼压差异无统计学意义(P=0.42)。高眼压组和高眼压治疗组术后1 d眼压即升高,1周眼压持续升高,术后2周及3周兔眼压略有下降,但始终>25 mmHg,完全符合持续性高眼压标准[11],高眼压一直持续至实验中止,实验后各时间点高眼压组、高眼压治疗组与正常眼压组眼压差异均有统计学意义(均为 P<0.05),高眼压组与高眼压治疗组之间眼压差异无统计学意义(P=0.88)。

表1 高眼压组、高眼压治疗组与正常眼压组实验前后眼压值比较Table 1 Comparison of intraocular pressure among normal group,OH group and OH+phenytoin group before and after experiments (P/mmHg)
2.2 高眼压组和高眼压治疗组造模后眼表大体形态观察 高眼压组和高眼压治疗组裂隙灯下观察兔右眼注射复方卡波姆液后3 h出现睫状充血、角膜水肿、瞳孔散大等高眼压体征。
2.3 术后4周高眼压组、高眼压治疗组与正常眼压组视网膜形态比较
2.3.1 HE染色结果 正常眼压组视网膜各层组织结构清晰,可观察到10层结构,外核层细胞数量最多,内核层细胞数量较少,节细胞为单层、密集排列,细胞体积较大,细胞核边缘清楚,呈圆形或椭圆形,RNFL均匀,厚度基本无明显变化;RGC和内核层细胞密度相当。与正常眼压组相比较,高眼压组、高眼压治疗组视网膜各层结构可见,RGC多数崩解消失,细胞核固缩;RGC密度较正常眼压组显著减少,节细胞层及内核细胞层厚度明显下降,特别是高眼压组,RGC细胞数量明显减少,细胞出现变性,内、外核层细胞排列稀疏,数量减少。但高眼压治疗组与高眼压组比较,RGC数量残留较多,胞核大部分存在,部分出现空泡样变,内核层和外核层结构与正常眼压组相似(图1)。
2.3.2 TUNEL染色结果 正常眼压组节细胞层及内核层无明显棕色颗粒,高眼压组和高眼压治疗组节细胞层与内核层可见大量棕色颗粒,凋亡细胞数量高眼压组明显多于高眼压治疗组(P<0.05,见表2)。高眼压组和高眼压治疗组节细胞层、内核层凋亡细胞数分别与正常眼压组比较,差异均有统计学意义(P <0.05,见图2)。
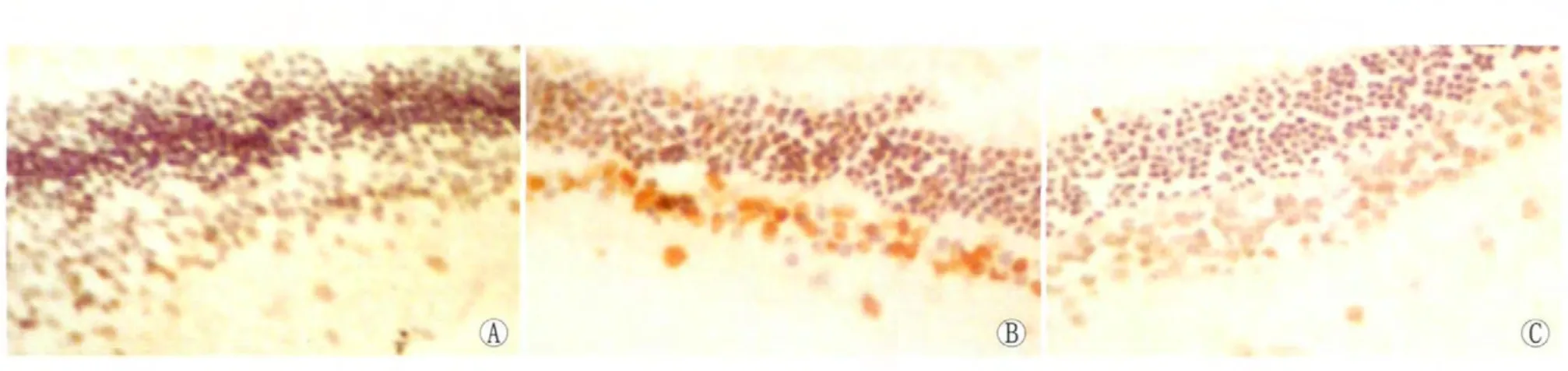
Figure 2 Comparison of retinal structure among normal group,OH group and OH+phenytoin group at 4 weeks after operation(TUNEL staining,×10).A:N group;B:OH group;C:OH+P group 术后4周高眼压组、高眼压治疗组与正常眼压组视网膜形态比较(TUNEL染色,×10)。A:N组;B:OH组;C:OH+P组
2.3.3 透射电子显微镜观察结果 正常眼压组无凋亡细胞(图3);高眼压组与高眼压治疗组均可见凋亡细胞(图4),表现为细胞质浓缩,细胞核染色体聚集、断裂,形成粗细不均的颗粒散布于细胞浆中,有细胞浆空泡及核固缩现象,有典型的质膜包裹碎裂的染色体形成的凋亡小体。
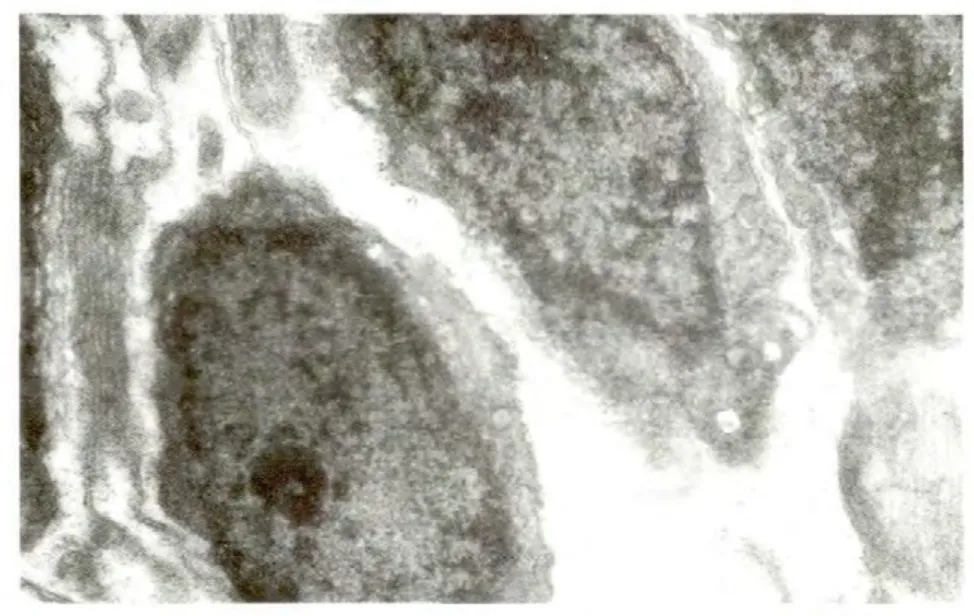
Figure 3 Normal RGC had complete cell membrane with no pyknosis and karyolysis 正常视网膜神经节细胞,各细胞器包膜完整,没有固缩碎裂、溶解现象

Figure 4 RGC in OH group had concentrated cytoplasm,aggregated and ruptured chromosome with vacuole in cytoplasm 高眼压组RGC形态,细胞质浓缩,细胞核染色体聚集、断裂,形成粗细不均的颗粒散布于细胞浆中,有细胞浆空泡
表2 术后4周正常眼压组、高眼压组与高眼压治疗组节细胞层和内核层细胞凋亡数量Table 2 Comparison of apoptotic cells in RGC and INL layer among normal group,OH group and OH+phenytoin group at 4 weeks after operation(,cell·μm -2)

表2 术后4周正常眼压组、高眼压组与高眼压治疗组节细胞层和内核层细胞凋亡数量Table 2 Comparison of apoptotic cells in RGC and INL layer among normal group,OH group and OH+phenytoin group at 4 weeks after operation(,cell·μm -2)
Group RGC INL N (0.40±0.15)×10 -2 (0.95±0.24)×10-2 OH (3.40±0.62)×10 -2 (18.70±2.41)×10 -2 OH+P (1.75±0.28)×10 -2 (8.75±1.03)×10-2
3 讨论
3.1 慢性高眼压动物模型的建立 卡波姆是丙烯酸与烯丙基蔗糖或季戊四醇交链而成的高分子聚合物,是一种优良的药剂新辅料。此药的最大特点:(1)当pH值较低时呈溶液状,随着pH值的升高,药液的黏稠度逐渐增加而形成水凝胶状,且当pH值在6~12时最为黏稠;(2)有良好的乳化性、增稠性、助悬性和成膜性。房水的pH值主要由CO2/HCO3-的相对比例决定,正常范围为7.5~7.6,略偏碱性。根据卡波姆特点及房水的特性,制成青光眼动物模型非常成功,眼压的波动很小。本研究中眼压造模成功后1、2周较高,3、4 周眼压有所下降,与徐岩等[7]报道基本相符合,因此适合进行青光眼视网膜神经损害的研究。
3.2 TUNEL检测 TUNEL免疫标记法是检测组织切片及其他标本细胞凋亡的有效方法[11],TUNEL法已被应用于视神经[12-13]和晶状体上皮细胞凋亡的检测[14]。青光眼中RGC的选择性损伤是以细胞凋亡为特征的,因而我们推测TUNEL免疫标记法也同样可用于检测高眼压模型中视网膜细胞的凋亡。
3.3 RGC凋亡及苯妥英钠保护机制 目前,关于青光眼神经损害的确切机制尚不十分清楚,但对青光眼发病机制的研究表明可能有多种机制参与青光眼视神经损伤。已知青光眼RGC凋亡的相关因素主要有神经营养因子的剥夺、谷氨酸对RGC的毒性作用、自身免疫因素等[15],以及各种损伤引起钙离子的堆积,异常的钙离子内流从而导致神经轴突的损伤和凋亡[16]。无论何种机制其最终的结局均是RGC的凋亡[17],所以阻断或延缓 RGC原发性和(或)继发性损伤的青光眼视神经保护治疗越来越受到重视。抗惊厥药物苯妥英钠作为一种Na+通道阻滞剂,对各种组织的可兴奋膜有稳定作用,同时它还可以抑制神经元的快灭活型(T)通道,抑制Ca2+内流[18]。因而对Ca2+的动态平衡和神经递质的正常传递具有显著作用[19]。
我们研究单位面积内节细胞层、内核层细胞凋亡数量,发现在正常眼压下,苯妥英钠对视网膜细胞无明显作用。高眼压治疗组与高眼压组均有大量节细胞以及内核层细胞凋亡,通过HE染色可见节细胞层、内核层、外核层均有各种组织学改变,并且TUNEL染色显示高眼压组细胞与高眼压治疗组有明显差异(P <0.05),这与骆荣江等[20]的研究结果基本一致,说明苯妥英钠可减少高眼压模型中视网膜各层细胞的凋亡数量,提示苯妥英钠对视网膜各层细胞均有保护作用。高眼压组与正常眼压组光镜下节细胞层、内核层凋亡细胞数量均有明显差异(均为P<0.05)。电镜下高眼压组、高眼压治疗组均有凋亡小体,而正常眼压组均看不到凋亡小体,凋亡细胞数量高眼压组明显高于高眼压治疗组,凋亡同时视网膜各层厚度变薄,节细胞层与内核层最为明显,细胞间隙变大,高眼压仍然是青光眼视神经损伤的最重要因素。
综上所述,苯妥英钠作为临床上一种广泛应用的抗惊厥药物,其安全使用范围及副作用已被大家所掌握,未来作为治疗青光眼视神经细胞凋亡的药物有很好的前景。
1 Quigley HA.Number of people with glaucoma worldwide[J].Br J Ophthalmol,1996,80(5):389-393.
2 Schumer RA,Podos SM.The nerve of glaucoma[J].Arch Ophthalmol,1994,112(1):37-44.
3 Brubaker RF.Delayed functional loss in glaucoma.LII edward jackson memorial lecture[J].Am J Ophthalmol,1996,121(5):473-483.
4 Caprioli J.Neuroprotection of the optic nerve in glaucoma[J].Acta Ophthalmol Scand,1997,75(4):364-367.
5 Kaptanoglu E,Solaroglu I,Surucu HS,Akbiyik F,Beskonakli E.Blockade of sodium channels by phenytoin protects ultrastructure and attenuates lipid peroxidation in experimental spinal cord injury[J].Acta Neurochir,2005,147(4):405-412.
6 Lo AC,Saab CY,Black JA,Waxman SG.Phenytoin protects spinal cord axons and preserves[J].J Neurophysiol,2003,90(5):3566-3571.
7 徐 岩,陈祖基.复方卡波姆诱发的兔高眼压模型与其它兔高眼压模型的比较研究[J].中华眼科杂志,2002,38(3):172-175.
8 Lo AC,Black JA,Waxman SG.Neuroprotection of axons with phenytoin in experimental allergic encephalomyelitis[J].Neuroreport,2002,13(15):1909-1912.
9 Tamamori Y,Tamura Y,Yamazaki T,Ohya K.Establishment of rat model of drug-induced gingival overgrowth induced by continuous administration of phenytoin[J].J Pharmacol Sci,2005,98(3):290-297.
10 Gavrieli Y,Sherman Y,Ben-Sasson SA.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].J Cell Bio,1992,119(3):493-501.
11 李德姣,蒋伯龄,朱元莉.当归补血汤对高眼压兔视网膜神经节细胞凋亡的抑制作用[J].中国中医眼科杂志,2005,15(1):30-32.
12 Quigley HA,Nickells RW,Kerrigan LA,Pease ME,Thibault DJ.Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis[J].Invest Ophthalmol Vis Sci,1995,36(5):774-786.
13 Okisaka S,Murakami A,Mizukawa A,Ito J.Apoptosis in retinal ganglion cell decrease in human glaucomatous eyes[J].Jpn J Ophthalmol,1997,41(2):84-88.
14 陈凤华,宋旭东.老年性白内障晶状体上皮细胞凋亡的DNA片段分析及 TUNEL 检测[J].眼科研究,1999,17(6):454-456.
15 彭玉豪,李和平.青光眼性视网膜神经节细胞凋亡的病理机制[J].中华眼科杂志,2004,40(7):495-499.
16 LoPachin RM,Lehning EJ.Mechanism of calcium entry during axon injury and degeneration[J].Toxicol Appl Pharmacol,1997,143(2):233-244.
17 Nicklells RW.Retinal ganglion cell death in glaucoma the how and the why and the maybe[J].J Glaucoma,1996,5(5):345-356.
18 Sitges M,Guarneros A,Nekrassov V.Effects of carbamazepine,phenytoin,valproic acid,oxcarbazepine,lamotrigine,topiramate and vinpocetine on the presynaptic Ca2+channel-mediated release of[3H]glutamate:comparison with the Na+channel-mediatedrelease[J].Neuropharmacology,2007,53(7):854-862.
19 Hains BC,Saab CY,Lo AC,Waxman SG.Sodium channel blockade with phenytoin protects spinal cord axons,enhances axonal conduction,and improves functional motor recovery after contusion[J].Exp Neurol,2004,188(2):365-377.
20 骆荣江,葛坚,林健贤.兔眼视网膜各组织对高眼压不同易损性的研究[J].中华眼科杂志,2001,37(4):302-304.
