近五年北京市药物临床试验开展情况
2014-11-12北京市药品审评中心100061于磊仲斌田晓娟冯欣徐春娥赵杨佟利家
北京市药品审评中心(100061)于磊 仲斌 田晓娟 冯欣 徐春娥 赵杨 佟利家
(接1月下)
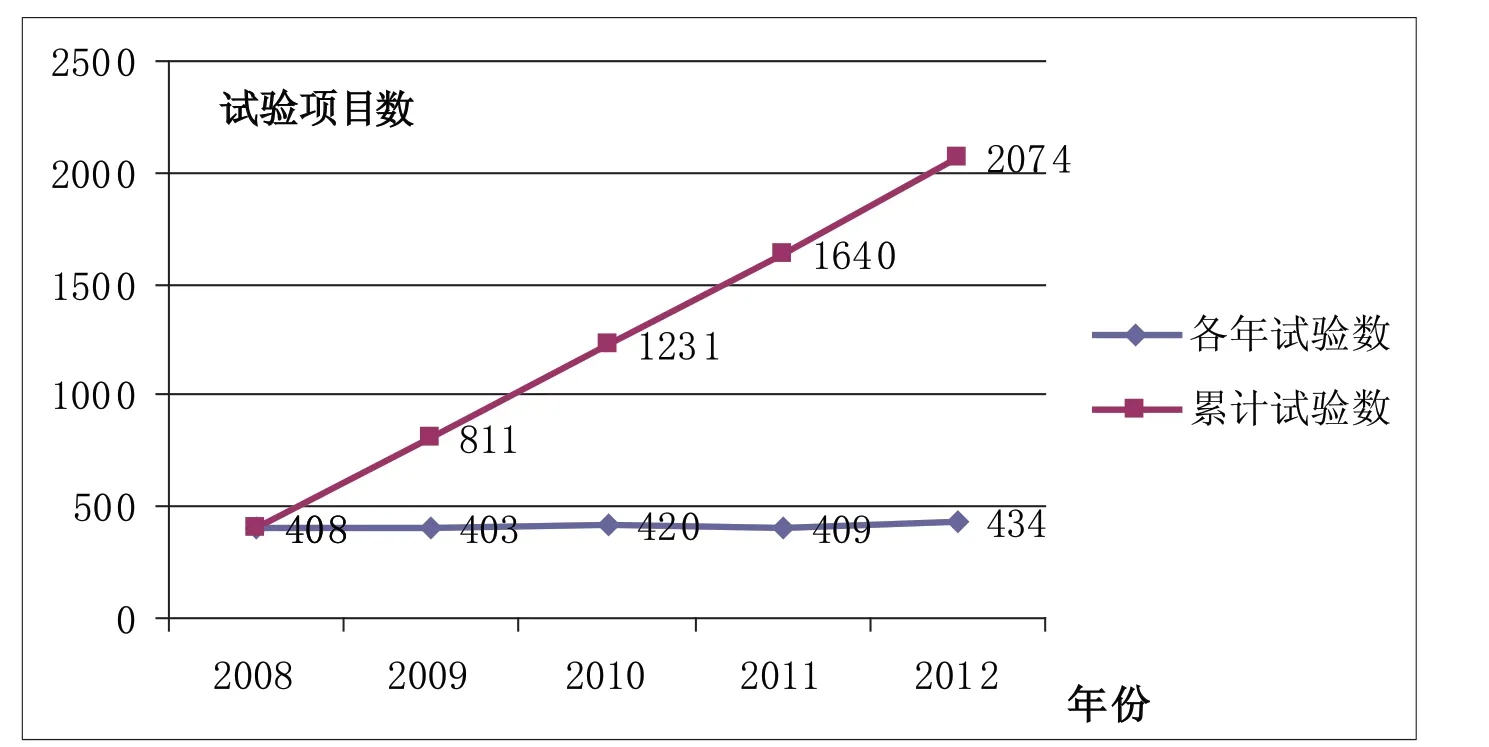
3.1.2 已完成项目情况 利用SPSS软件对历年已完成项目数(机构已在试验总结报告上盖章的为完成的试验项目)进行统计分析(见附图2),历年完成的试验项目数较为稳定(Friedman检验P值为0.764),无明显变化。平均每年完成临床试验项目数414.6个。其中2009年完成试验数最少,为403个;2012年完成试验数最多,为434个。见附表2。
附表2显示,样本机构中有1家机构近五年完成的试验项目达250个,占完成项目总数的12%;多数机构的完成试验项目的数量在100个以下;5家机构没有完成的临床试验。
3.2 试验项目分类开展情况
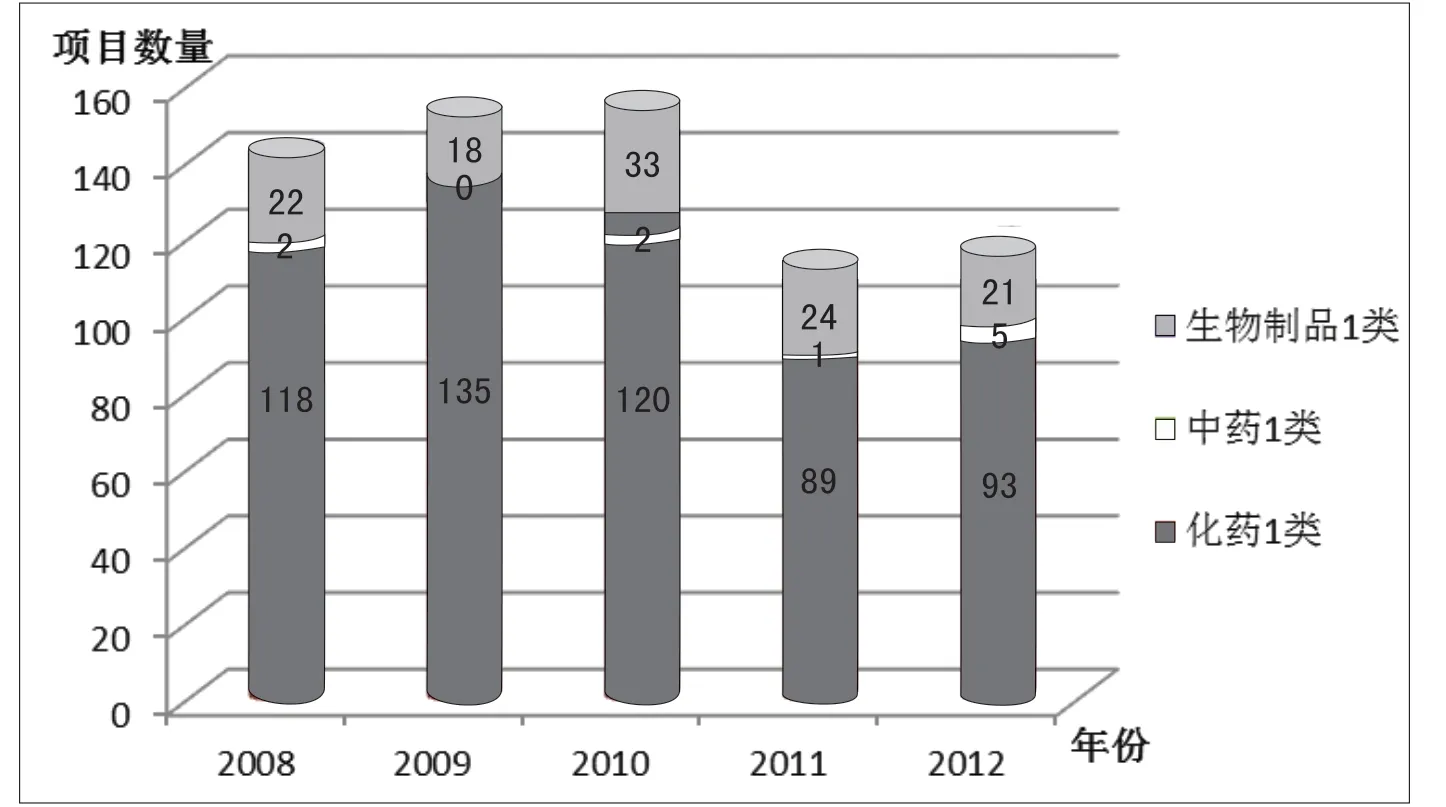
3.2.1 1类新药试验 根据《药品注册管理办法》,1类新药是指未在国内外上市销售的药品,样本机构开展1类新药临床试验共计683个,占开展试验项目总数的20%,具体情况见附图3。
从附图3显示,历年开展的1类新药试验数量较为稳定(Friedman检验P值为0.764),无明显变化,平均每年开展1类新药试验136.6个。其中2010年1类新药试验数量最多,达到了155个。结果显示,在1类新药试验中,化学药品1类新药试验最多,共计555个;生物制品次之,共计118个;中药1类试验开展数目最少,共计10个。
附表3表明,2家机构开展1类新药的试验项目达80个以上,共计188个,占1类新药开展项目总数的1/4以上;多数机构开展1类新药试验项目的数量在20个以下;有10家机构从未参与过1类新药的临床研究。
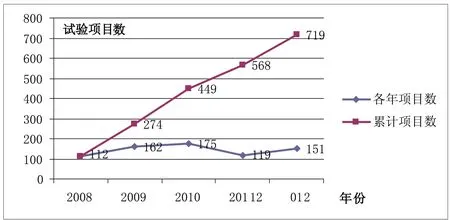
3.2.2 国际多中心试验 国际多中心临床试验是由多国多中心共同参与、全球统一、同步进行的大型临床药物临床研究。由于国际多中心临床研究要求统一方案,统一质量管理,统一数据分析,其试验方案的制定、质量监控及其运作程序,一般较非国际多中心临床试验规范。因而,国际多中心试验已成为高水平临床研究的代表[1]。样本机构开展国际多中心临床试验项目共计719个,占开展试验总数的21%,具体情况见附图4。
利用SPSS软件对国际多中心试验数进行统计分析,附图4显示,各年度进行的试验数总体较为平稳(Friedman检验P值为0.239),平均每年开展国际多中心试验143.8个。2009年开展了210个国际多中心试验,试验数量较2008年较为显著的增加(Wilcoxon符号秩检验,P值为0.065);2010年与2011年数量稳定增长,2011年数量有明显的下降(Wilcoxon符号秩检验,P值为0.035);2012年试验数量又有所回升,达到151个。
附图2 北京市各机构完成试验项目数量情况
附图3 1类新药临床试验项目数量
附图4 国际多中心临床试验开展数量
附图5 作为组长单位承担临床试验数量
附表4表明,国际多中心临床试验主要集中在4家机构,其中开展最多的4家机构占到50%,其中2家机构为肿瘤专科医院;多数机构承担项目在20个以下,其中11家机构从未参与过国际多中心临床试验。
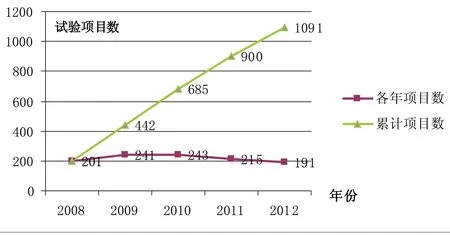
3.2.3 组长单位试验 样本机构作为组长单位承担的临床试验共计1091个,占开展试验总数的32%,具体情况见附图5。
利用SPSS软件对作为组长单位试验数进行统计分析(附图5),各年度进行的试验数总体无明显差异,数量较为平稳(Friedman检验P值为0.136)。平均每年进行组长单位试验218.2个。其中2009年与2010年试验数量较多,均在240个以上,其余年份数量较少,约为200个;从2010年开始,历年试验数量有所减少,呈下降趋势,见附表5。
附表5显示,有1家机构作为组长单位开展临床试验数量的达到251个,而该机构共计开展临床试验416个,作为组长单位参与临床试验的比例达到近50%;多数机构作为组长单位开展的临床试验在20个以下,其中有8家机构没有作为组长单位开展过临床试验。
3.3 各专业开展试验情况 北京市药物临床试验机构所涉及的专业(不区分中医与儿科专业)共有43个,其中心血管、呼吸科是机构最多的两个专业,有20家以上的机构通过认定;消化、神经等11个专业有11~20家机构通过认定;麻醉、医学影像等6个专业有5~10家机构通过认定;其余22个专业较为稀少,仅有少于5家机构通过认定。
剔除问卷中专业科室不明确的试验375个,样本机构认定的43个专业共开展临床试验2825个,各个专业临床试验数量详见附表6。
附表6显示,开展临床试验最多的专业是肿瘤,根据国家药品审评中心《2012年度中国药品审评报告》[2],2012年的注册申请中,无论国际多中心临床试验申请还是国内新药临床试验(IND)申请,比例最大的均为肿瘤治疗领域药物;其次是心血管专业,心血管专业认定的机构也是最多的,因心血管疾病是严重危害人类生命健康的常见病,发病率高,是造成人类死亡的主要原因之一,故心血管药物的研究得到重视,发展较快,临床应用药物众多。北京市排名前5名的专业共开展了超过50%的临床试验;其他专业如影像医学、器官移植、肛肠等临床试验则数量较少,占比很低;而口腔、运动医学、整形医学等6个专业近五年未进行任何临床试验。
值得一提的是,目前我国很多药品说明书中缺乏完善的儿童用药信息,将儿童纳入临床试验人群,得出科学的用药信息,确保儿童用药安全有效是进一步规范儿童临床用药的重要手段,儿科药物临床试验也越来越受到重视。在目前公布的临床试验资格认定公告中仅有28家临床机构通过了资格认定,申请并被批准用于儿童临床研究的药物只有5个[3]。北京市具有儿科专业的机构共有5家,2008年~2012年共计开展儿科药物临床试验34个,儿科药物临床试验主要集中于呼吸和神经2个专业,2个专业共开展药物临床试验22例,占儿科药物临床试验总数65%;而其余6个专业共进行试验10例,仅占比35%。
4 小结
药物临床试验(Clinical trial)指任何在人体(患者或健康志愿者)进行的药物系统性研究,以证实或揭示实验药物的作用、不良反应和(或)试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效及安全性[4]。药物临床试验质量管理规范(GCP)对开展药物临床试验的医疗机构做了明确规定,医疗机构的设施与条件应满足安全有效地进行临床试验的需要,实验室检查结果应准确可靠。药物临床实验(Ⅳ期除外)只能在通过国家食品药品监督管理总局资格认定的医疗机构开展。开展药物临床试验不仅在促进国家医药事业发展,保障人民健康方面发挥着重要作用,而且对医疗机构自身建设也具有重要意义。
北京市拥有丰富的病患资源,临床试验质量逐年提高,国家对创新药物的研发资助力度越来越大,各机构更多的参与到创新药物临床研究及国际多中心临床试验。这不仅有助于提高我国临床研究水平,发展我国的新药研发事业,而且对医疗机构自身建设也具有重要意义[5][6],还可以增加学术交流的机会,从而提升我国医疗机构的科研学术水平[7]。

附表2 各机构完成试验项目数量分布
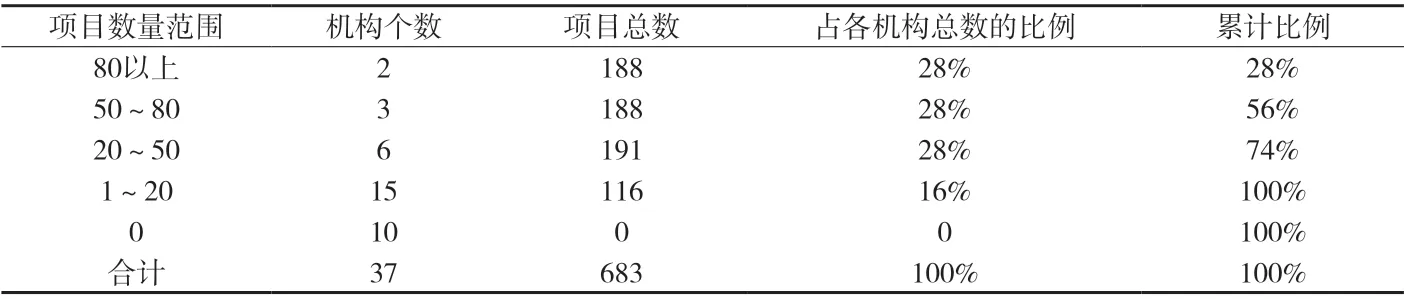
附表3 各机构1类新药试验项目数量分布
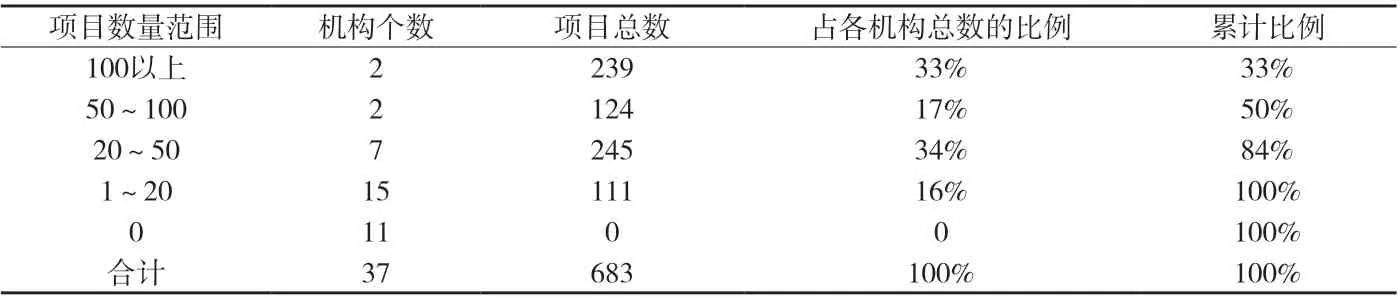
附表4 各机构国际多中心临床试验数量分布

附表5 各机构作为组长单位开展临床试验数量分布
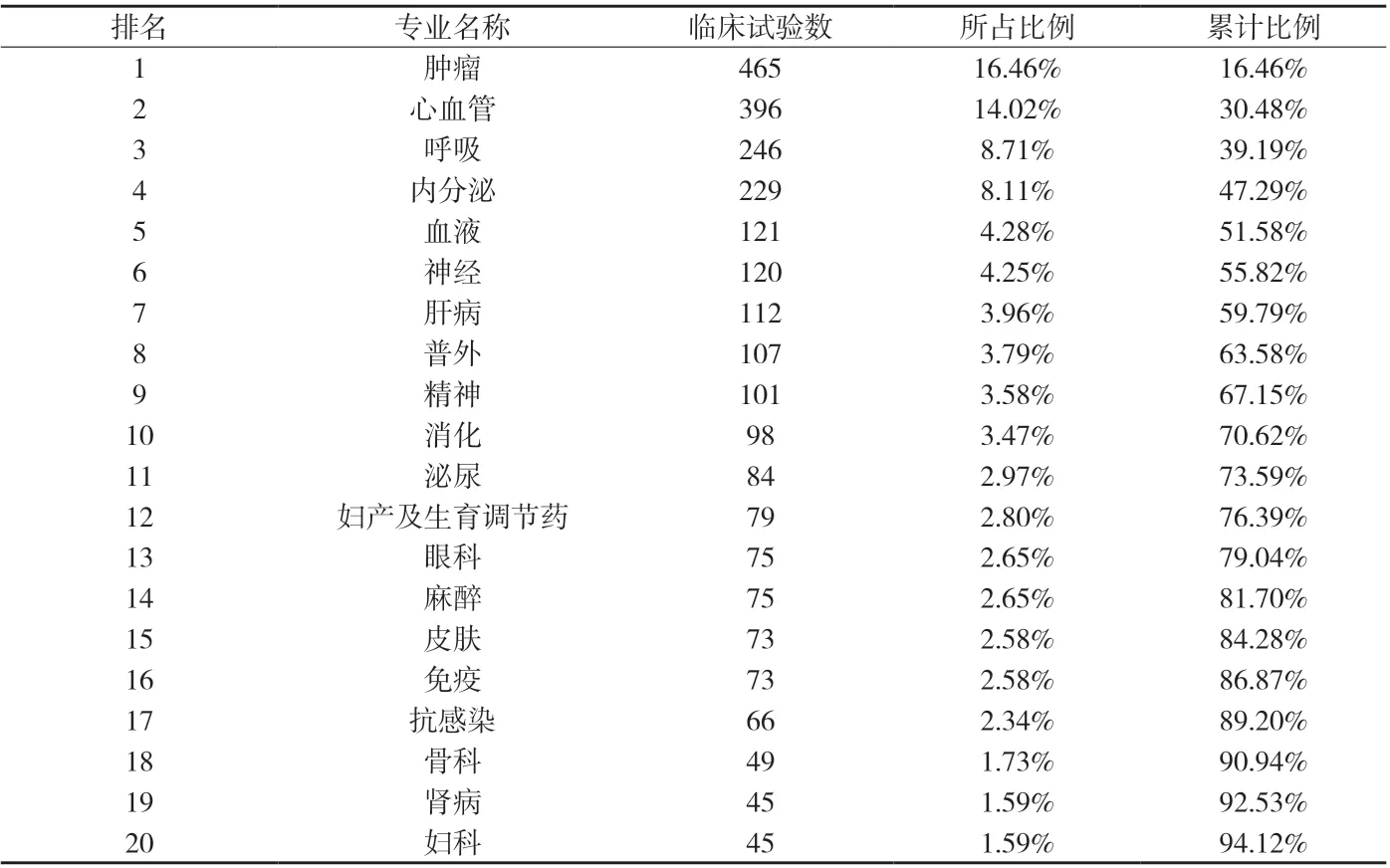
附表6 各专业开展临床试验数量(前20)
综上所述,在国家政策的大力支持下,北京市的临床药物临床试验机构拥有更多的发展空间和巨大的发挥舞台,从而为我国药物临床试验事业的发展做出更大的贡献。
