警惕以咯血为首发症状的显微镜下多血管炎
2014-11-08任薇,王胜
任 薇,王 胜
(安徽中医药大学第一附属医院干部呼吸内科,安徽合肥 230031)
显微镜下多血管炎 (microscopic polyangiitis,MPA)是一种主要累及小血管的系统性坏死性血管炎[1]。其临床起病隐匿,表现为多系统病变,以肾、肺、皮肤多见。同时由于该病发病率不高,在对其认识度不够的情况下,容易出现漏诊、误诊。本文就我科1例MPA患者临床资料进行回顾性分析,提高对MPA肺部受累患者早期发现率,早期诊断率。
1 临床资料
1.1 既往资料 女性患者,71岁,2007年曾有大咯血病史(病因不清),此后病程中间断出现痰中带血,量少,多次行肺部CT检查发现肺部多发磨玻璃影,以两上肺为主。病程中动态观察,发现存在肺部磨玻璃影减少、消失现象。长期门诊随访,未予特殊诊治。胸部CT见图1和图2。
1.2 首次诊疗 2012年9月10日患者因“咳嗽咳痰伴痰血、低热10 d”收入我院。自测体温最高37.8℃。入院查体:双肺呼吸音偏粗,未闻及干湿性啰音。辅助检查:血常规:白细胞计数4.91×109·L-1,血小板计数170×109·L-1,红细胞计数 3.24 ×1012·L-1,血红蛋白 93 g·L-1,中性粒细胞百分比58.2%。尿常规:红细胞535.90 UL,尿蛋白:2+,潜血:3+。生化:球蛋白 40.2 g·L-1,尿素氮11.41 mmol·L-1,肌酐 142.8 μmol·L-1。血沉 107 mm·h-1。胸部CT提示右肺野多发及左肺上叶少许片状模糊影,见图3。入院暂予诊断性抗感染治疗,并积极完善相关检查。
患者自诉既往类风湿关节炎病史(具体诊断治疗过程不清),结合长期以咯血为表现,肺肾损害同时存在,全身系统性疾病需要考虑。进一步相关检查自身抗体系列回示:抗SSA抗体阳性,抗核糖体P蛋白抗体阳性,抗Ro-52抗体阳性,抗核抗体阳性(+)。尿五蛋白:尿免疫球蛋白 G 145.00 mg·L-1,尿液转铁蛋白 41.40 mg·L-1,尿微量白蛋白 822.00 mg·L-1,尿液 α1微球蛋白 33.80 mg·L-1,尿β2微球蛋白13.80 mg·L-1。尿红细胞形态:均一性红细胞。抗中性粒细胞胞浆抗体谱(ANCA):p-ANCA阳性 ,c-ANCA阴性,抗蛋白酶3抗体阴性,抗髓过氧化物酶抗体阴性,抗肾小球基底膜抗体阴性。外院再次复查ANCA:p-ANCA阳性,抗髓过氧化物酶抗体阳性,c-ANCA阴性,抗蛋白酶3抗体阴性。诊断考虑显微镜下多血管炎,肺、肾损害为主。由于患者拒绝规范治疗,故予以门诊随访。
1.3 二次诊疗 患者症状渐进加重,后期出现干呕,呕吐,睡眠时不能平卧,时感胸闷,呼吸憋闷,吸气不畅,时有肉眼血尿。于2013年1月4日再次入院。入院查体:血压160/90 mmHg,神清,精神软,面色晄白,面目浮肿,双肺呼吸音减低,右肺呼吸音减低明显,两肺未闻及干湿啰音,心率为每分钟94次,律齐,未闻及病理性杂音,腹软,全腹无压痛及反跳痛,双下肢凹陷性浮肿,右下肢明显。辅检:血常规:红细胞计数2.31×1012·L-1,血红蛋白 66 g·L-1,白细胞计数4.16×109·L-1,中性粒细胞百分比56.3%。B型钠尿肽690 ng·L-1。肿瘤标志物蛋白芯片检测(C12)示铁蛋白265.56 μg·L-1,癌抗原 125 46.04 KU·L-1。尿常规:红细胞318.60 UL。生化:尿素氮 18.12 mmol·L-1,肌酐 403.1 μmol·L-1,尿酸 385 μmol·L-1,白蛋白 29.0 g·L-1。凝血全套:二聚体1.20 mg·L-1。血沉 123 mm·h-1。ANCA:p-ANCA阳性,抗髓过氧化物酶抗体(MPO)阳性。胸部CT显示(见图4):(1)两肺内可见斑片状高密度影;(2)甲状腺肿;(3)双侧胸腔积液(右侧为著),心包积液;(4)右侧乳腺缺如:考虑术后改变。心超+心功能显示:(1)老年性二尖瓣退变并轻度二闭;(2)左室舒张功能下降;(3)少量心包积液。泌尿系统B超显示:(1)双肾弥漫性病变;(2)右肾皮质区实性结节:错构瘤;(3)左肾囊肿;(4)双肾动脉血流阻力增高。该患者诊断明确,病情恶化,予激素、免疫抑制剂、血透联合治疗后度过危险期,现外院风湿免疫科治疗中。
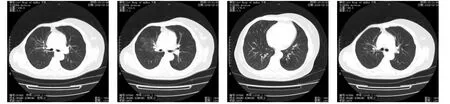
图1 2009年4月20日胸部CT

图2 2010年3月8日胸部CT
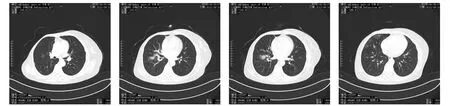
图3 2012年9月10日胸部CT
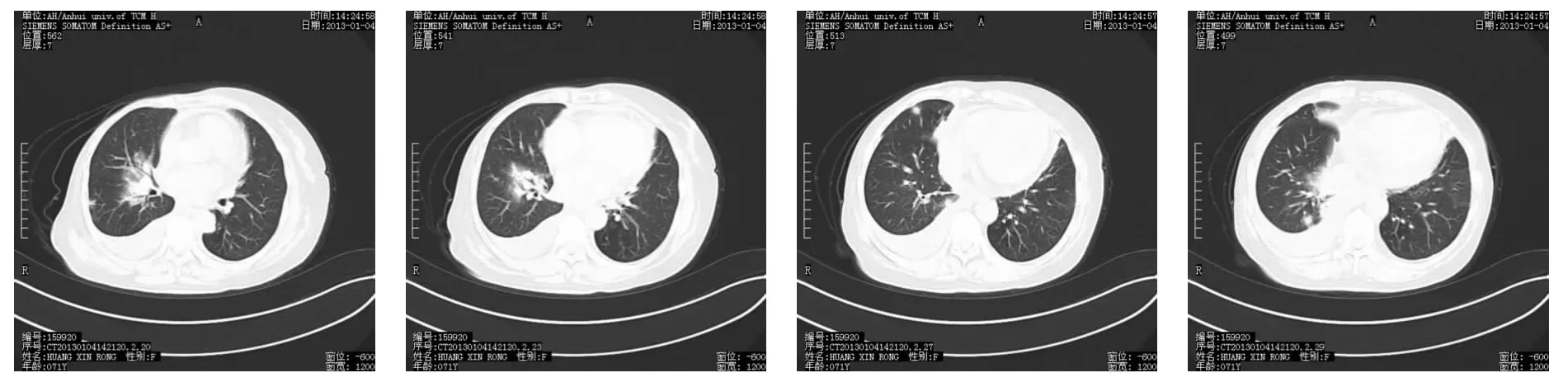
图4 2013年1月4日胸部CT
2 讨论
MPA可侵犯肾脏、皮肤和肺等脏器的小动脉、微动脉、毛细血管和微小静脉。常表现为坏死性肾小球肾炎和肺毛细血管炎[1]。本病属罕见的疾病,发病率约为1∶100 000每年[2],常导致多系统病变,因而在对该病认识不够的情况下,对于临床表现不典型的患者极易漏诊误诊。呼吸科医师首诊少量咯血患者时,可能会对老年患者合并肾脏轻度损害,少量蛋白尿血尿重视度不够,诊断范围易局限在呼吸系统疾病。
回顾该患者诊断过程,早期即可能存在多系统受累表现,关节痛,间断咯血。病程中发现肾功能损害,血尿,蛋白尿,伴有间断发热。后期出现肾、肺、心多脏器功能衰竭表现。病情变化的过程中,影像学随之有所改变。由最初多部位磨玻璃影,发展至磨玻璃影合并沿支气管血管束网格条索影,后期出现肺门为中心向外分布斑片状高密度影,胸腔积液。
MPA肺部受累患者临床表现无特异性,由于弥漫性的肺间质改变和炎症细胞浸润,约1/3的患者出现咳嗽、咯血、贫血,大量的肺出血可导致呼吸困难[1]。肺部受累患者CT上主要表现为磨玻璃影、支气管血管束增厚、蜂窝肺改变[2]。有研究对不同进展期MPA的胸部CT影像表现进行对照分析,发现活动期主要以磨玻璃样改变、肺实变、散在斑片影、纵隔淋巴结肿大及胸腔积液多见,且病变往往较为广泛[3]。同时陈露露等[4]曾报道1组27例MPA患者,有肺部症状者常同时合并肾脏损害如蛋白尿、血尿(包括镜下血尿)、肾功能不全。因此临床上对于早期咯血伴肾损害,合并胸部CT多发磨玻璃改变,需加以重视,以早期诊断。该例患者病程中期胸部CT出现沿支气管血管束网格条索影与MPA导致的肺纤维化相关。肺间质纤维化作为MPA患者的伴随表现,还没有得到广泛认识。有研究指出肺间质纤维化可以发生在伴有肺部症状的MPA患者,并且很可能在MPA诊断之前即已存在数年[5]。因而肺间质纤维化患者初诊时,尤其伴有咯血患者,不能遗漏MPA的可能性。MPA导致的肺纤维化易合并肺泡出血,表现为沿支气管分布的小斑片影,有时临床并不出现咯血表现,称之为隐性出血,此时的支气管镜肺泡灌洗液可见到出血[4]。这同时可以解释该患者病程后期与临床咯血量及肾损不相匹配的中重度贫血现象的出现。故而对于咯血量与贫血严重度不相符患者,建议完善支气管镜肺泡灌洗以协助诊断。该患者后期肺实变阴影出现伴有发热,需要和患者原发病基础上继发感染相鉴别。
2011年显微镜下多血管炎诊断及治疗指南中指出,本病诊断尚无统一标准,如出现系统性损害并有肺部受累、肾脏受累及出现可触及的紫癜应考虑 MPA的诊断,尤其是还有MPO-ANCA阳性者。肾活检及皮肤或其他内脏活检有利于MPA的诊断[1]。由于MPA患者ANCA靶抗原主要为髓过氧化物酶(MPO),我们通常称其为 MPO-ANCA。MPOANCA阳性可以作为MPA诊断依据。从该指南中可以看出,诊断不完全依赖于组织活检。多脏器尤其肾、肺、皮肤受损的病史是诊断关键,早期MPO-ANCA检测具有重要意义。有报道指出约95%MPA患者ANCA阳性,其中70%针对MPO,余下针对蛋白酶3(PR3)[6]。pANCA主要靶抗原为髓过氧化物酶(MPO),cANCA主要靶抗原为蛋白酶3(PR3)[7],二者均是以中性粒细胞胞质成分为靶抗原的自身抗体。同时间接免疫荧光法检测pANCA,酶联免疫吸附实验检测抗ANCA检测MPO抗体,可以提高MPA诊断价值[8]。并且抗MPO抗体较pANCA对MPA更具诊断价值[9]。ANCA被公认为诊断本病敏感而又特异的血清学诊断工具,常在病变尚未严重影响肝、肾功能之前出现,其滴度通常与血管炎的活动度有关,治疗后随病情好转滴度明显下降[6,10]。因而在早期疑诊时,ANCA检测阳性有利于早期诊断。
临床上对于咯血患者,胸部CT提示多部位磨玻璃影,尤其合并存在肾脏损害时,需警惕MPA的可能性。注意动态监测ANCA,观察胸部CT影像学改变,有利于早期发现该病,以期早期治疗。
[1] 中华医学会风湿病学分会.显微镜下多血管炎诊断及治疗指南[J].中华风湿病学杂志,2011,15(4):259-261.
[2] Okten F,Günay S,Günay E,et al.Microscopic polyangiitis with diffuse peribronchovascular nodular involvement:case report[J].Respiratory Medicine CME,2010,3(3):171-173.
[3] 瞿 华,余日盛,崔 凤,等.显微镜下多血管炎胸部CT表现对照分析[J].中华放射学杂志,2011,45(5):441-444.
[4] 陈露露,张德平,苗立云.合并肺部损害的显微镜下多血管炎的临床特征及与特发性肺纤维化的比较分析[J].中国呼吸与危重监护杂志,2011,10(5):437-441.
[5] Eschun GM,Mink SN,Sharma S.Pulmonary interstitial fibrosis as a presenting manifestation in perinuclear antineutrophilic cytoplasmic antibody microscopic polyangiitis[J].Chest,2003,123(1):297-301.
[6] Kallenberg CG.The diagnosis and classification of microscopic polyangiitis[J].Journal of Autoimmunity,2014(48/49):90-93.
[7] Damoiseaux J,Steller U,Buschtez M,et al.EUROPLUS ANCA BIOCHIP mosaic:PR3 and MPO antigen microdots improve the laboratory diagnostics of ANCA-associated vasculitis[J].Journal of Immunological Methods,2009,348(1/2):67-73.
[8] Jennette JC,Wilkman AS,Falk RJ.Diagnostic predictive value of ANCA serology[J].Kidney Int,1998,53(3):796-798.
[9] 师肖红.以“肺部感染”收住的显微镜下多血管炎3例并文献复习[J].安徽医学,2006,27(5):384-386.
[10]张 嵩,田东惠,王新安.显微镜下多血管炎2例报告并文献复习[J].国际呼吸杂志,2013,33(6):424-428.
