人着色性干皮病基因D对HepG2细胞Mdm2和Mdm4表达的影响*
2014-11-08张吉翔
丁 浩, 张吉翔
(南昌大学第二附属医院消化内科,江西南昌330006)
人鼠双微体2(murine double minute 2,Mdm2)和鼠双微体4(murine double minute 4,Mdm4)是属于同一家族且进化保守的原癌蛋白,在序列上与小鼠有着较高的同源性。两者在一级结构上具有同源性,特别是在P53蛋白结合域更是如此,因此Mdm2和Mdm4均能与P53蛋白相结合;并且,Mdm2羧基末端的金属结合域在Mdm4分子中亦是高度保守的[1]。Mdm2能使得P53的抑癌活性丧失,抑制其抗肿瘤活性,进而促进肿瘤的形成[2]。人剪切修复基因着色性干皮病基因D(xeroderma pigmentosum D,XPD)是转录因子ⅡH(transcription factorⅡH,TFⅡH)的一个组分[3]。大量研究发现,XPD除了在TFⅡH介导的核苷酸切除修复和转录过程中发挥主要作用外,还参与了细胞的增殖和凋亡,并能起到抑癌基因的作用[4-5]。因此我们假设XPD能下调Mdm2和Mdm4的表达。为此,本研究用脂质体转染法将重组质粒pEGFP-N2/XPD转染进入人肝癌细胞株以使得XPD高表达,然后检测Mdm2、Mdm4和P53表达量的变化,并观察肝癌细胞的增殖和凋亡。
材料和方法
1 材料
人肝癌细胞株HepG2购自美国模式菌种收集中心(American Type Culture Collection,ATCC);培养基DMEM购自HyClone;胎牛血清购自Gibco;重组质粒pEGFP-N2/XPD和空载质粒pEGFP-N2由本实验室构建并保存,pEGFP-N2/XPD已通过PCR反应、酶切及基因测序三重鉴定[6]。LipofectamineTM2000和Trizol购自Invitrogen;MTT购自Solarbio;DMSO购自Amresco;逆转录试剂盒购自 Fermentas;引物由Generay Biotech合成;2×Taq PCR MasterMix购自天根生物技术有限公司;总蛋白提取试剂盒购自北京普利莱基因技术有限公司;Ⅰ抗XPD、Mdm2、Mdm4、P53和β-actin购自Santa Cruz;Ⅱ抗辣根过氧化物酶IgG购自北京中杉金桥公司。
2 方法
2.1 细胞培养和质粒的转染 将HepG2细胞置于含10%胎牛血清和双抗(1×105U/L的青霉素和100 mg/L的链霉素)的DMEM培养基的培养瓶中,37℃、饱和空气湿度和5%的CO2培养箱内培养。以1×105cells/well的密度将细胞铺于6孔板内,24 h后细胞融合率约为90%。用脂质体转染法将重组质粒pEGFP-N2/XPD和空载质粒pEGFP-N2转染细胞,质粒每孔4.0 μg,脂质体每孔10 μL介导转染。实验分为空白对照组、pEGFP-N2组和pEGFP-N2/XPD组。转染48 h后收获细胞。
2.2 MTT检测细胞增殖活力 将细胞种植在96孔板中,空白调零孔只加不含细胞的培养基。实验处理后,每孔加入5 g/L MTT溶液20 μL,继续培养4 h,弃上清,加入 150 μL DMSO,振荡 15 min,酶标仪(Labsystems)测定492 nm处各孔吸光度(A)。
2.3 流式细胞术检测细胞周期和凋亡率 用胰酶消化收集上述各组细胞,采用碘化丙啶(propidium iodide,PI)单染法,应用 FACSCalibar流式细胞仪(Beckton Dickinson)分析细胞周期,得出细胞各周期的百分率。流式细胞术检测细胞凋亡率按试剂说明书进行,主要步骤为:用胰酶消化收集细胞,PBS洗涤细胞2次,再用500 μL的 binding buffer悬浮细胞,分别加入Annexin V-FITC和 PI各5 μL,最后用流式细胞仪检测。
2.4 RT-PCR检测mRNA表达水平 细胞总RNA抽提和逆转录参照试剂说明书进行操作。XPD上游引物为 5′-TCTGCCTCTGCCCTATGAT-3′,下游引物为5′-CGATTCCCTCGGACACTTT-3′,产 物 大 小 为 363 bp;Mdm2上游引物为 5′-ACCGAGTCTTGCTCTGTTAC-3′,下 游 引 物 为 5′-GGTGTGGTGGCAGATGAC-3′,产物大小为 139 bp;Mdm4 上游引物为 5′-GATGATACCGATGTAGAGG-3′,下游引物 5′-TCAGAACTGTGAGCCAAA-3′,产物大小为332 bp;P53上游引物为 5′-CTACAAGCAGTCACAGCACATGAC-3′,下游引物为 5’-TCATTCAGCTCTCGGAACATCTCG-3′,产物大小为 551 bp;β-actin上游引物为 5′-CGGGAAATCGTGCGTGAC-3′,下游 引物 为 5′-TGGAAGGTGGACAGCGAGG-3′,产物大小为 434 bp。PCR 反应体系如下:cDNA 500 ng,上、下游引物各 1 μL,2 ×Taq PCR MasterMix 12.5 μL,补去离子水至终体积25 μL。按下列条件进行扩增:预变性,1个循环,94℃ 5 min;PCR反应,94℃ 40 s,58℃ 40 s,72℃ 55 s,35个循环,72 ℃ 7 min。取 5 μL PCR 产物进行1.5%琼脂糖凝胶电泳,用暗箱式紫外透射仪观察电泳结果并拍照。结果用Band Leader 3.0软件,以目的条带/β-actin的吸光度比值进行分析。
2.5 Western blotting法检测蛋白表达水平 用RIPA法取总蛋白,BCA法测定蛋白质浓度,取100 μg进行SDS-PAGE分离蛋白。蛋白转印到硝酸纤维素膜上,脱脂奶粉溶液4℃封闭过夜。膜分别用按相应比例稀释的 XPD、Mdm2、Mdm4和 β-actin的Ⅰ抗孵育,4℃过夜,Ⅱ抗孵育2 h,DAB显色照相。结果用Quantity One 4.62软件,以目的条带/β-actin的灰度比值进行分析。
3 统计学处理
实验均重复6次。应用统计学软件SPSS 13.0分析,数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两两比较采用LSD检验。以P<0.05为差异有统计学意义。
结 果
1 pEGFP-N2/XPD转染对HepG2细胞增殖活力的影响
MTT结果显示,转染重组质粒pEGFP-N2/XPD组的A值明显低于空白对照组和空载质粒pEGFPN2组(P<0.01);而空白对照组与转染空载质粒pEGFP-N2组之间相比,差异无统计学意义(P>0.05),见表 1。
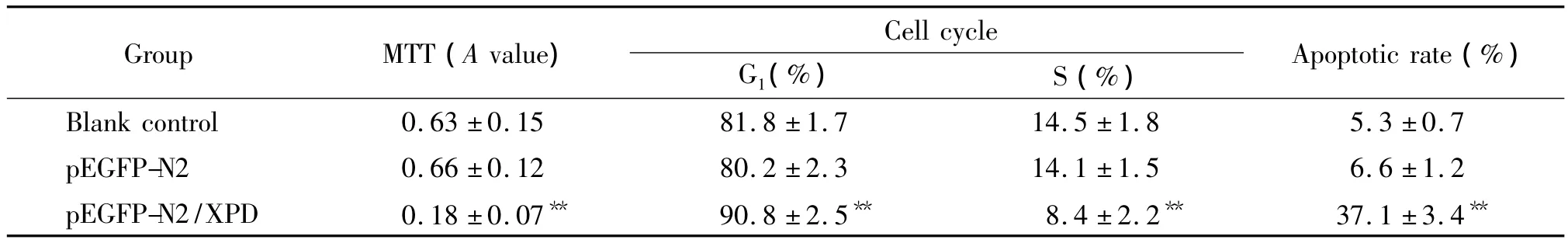
表1 pEGFP-N2/XPD转染后HepG2细胞增殖活力、细胞周期及凋亡率的变化Table 1.The changes of viability,cell cycle and apoptotic rate of HepG2 cells treated with pEGFP-N2/XPD(Mean±SD.n=6)
2 pEGFP-N2/XPD转染对HepG2细胞周期的影响
流式细胞术结果显示,与空白对照组和空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组的G1期细胞明显增多(P<0.01),S期细胞明显减少(P<0.01);而空白对照组与转染空载质粒pEGFP-N2组之间相比,G1期细胞和S期细胞差异均无统计学意义(P>0.05),见图1、表1。
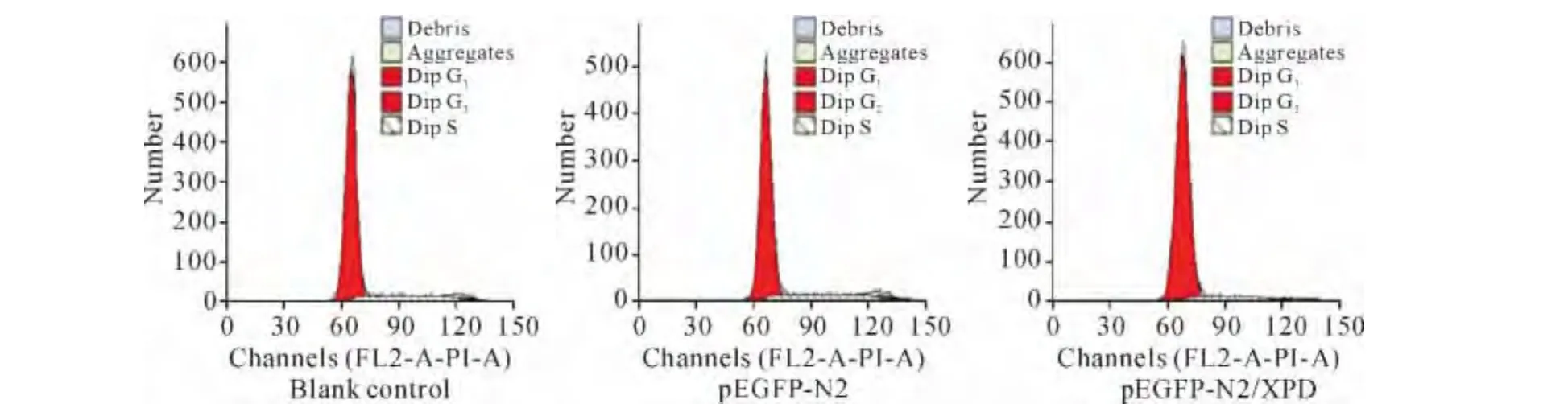
Figure 1.The change of cell cycle of HepG2 cells treated with pEGFP-N2/XPD.图1 pEGFP-N2/XPD转染后HepG2细胞周期的变化
3 pEGFP-N2/XPD转染对HepG2细胞凋亡率的影响
流式细胞术结果显示,重组质粒 pEGFP-N2/XPD组的细胞凋亡率明显高于空白对照组和空载质粒pEGFP-N2组(P<0.01);而空白对照组与空载质粒pEGFP-N2组之间相比,差异无统计学意义(P>0.05),见图2、表1。

Figure 2.The change of apoptotic rate of HepG2 cells treated with pEGFP-N2/XPD.图2 pEGFP-N2/XPD转染后HepG2细胞凋亡率的变化
4 pEGFP-N2/XPD转染对HepG2细胞的 XPD、Mdm2、Mdm4和P53 mRNA表达水平的影响
RT-PCR结果显示,与空白对照组和转染空载质粒pEGFP-N2组相比,pEGFP-N2/XPD的转染明显增加了XPD mRNA的表达(P<0.01);与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组的Mdm2和Mdm4 mRNA的表达明显减少,P53 mRNA的表达明显增多(均 P<0.01);而空白对照组与转染空载质粒pEGFP-N2组之间相比,差异无统计学意义(P>0.05),见图3。

Figure 3.The changes of XPD,Mdm2,Mdm4 and P53 mRNA expression in HepG2 cells treated with pEGFP-N2/XPD.M:100 bp marker;A:blank control group;B:pEGFP-N2 group;C:pEGFP-N2/XPD group.Mean±SD.n=6.**P <0.01 vs pEGFP-N2 group or blank control group.图3pEGFP-N2/XPD转染后HepG2细胞的XPD、Mdm2、Mdm4和P53 mRNA表达水平的变化
5 pEGFP-N2/XPD转染对HepG2细胞的 XPD、Mdm2、Mdm4和P53蛋白表达水平的影响
Western blotting结果显示,与空白对照组和转染空载质粒pEGFP-N2组相比,pEGFP-N2/XPD的转染明显增加了XPD蛋白的表达(P<0.01);与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组的Mdm2和Mdm4蛋白的表达明显减少(均P<0.01),P53蛋白的表达明显增多(P<0.05);而空白对照组与转染空载质粒pEGFPN2组之间相比,差异无统计学意义(P>0.05),见图4。
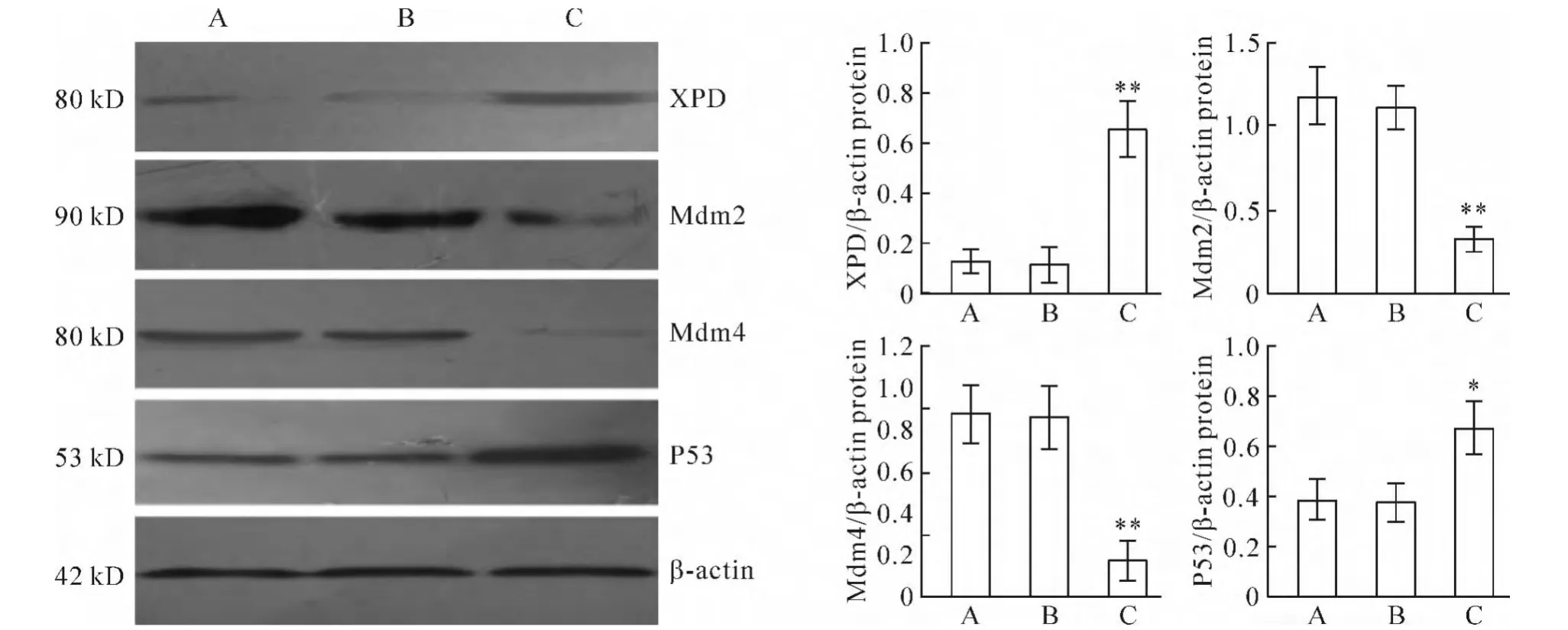
Figure 4.The changes of XPD,Mdm2,Mdm4 and P53 protein expression in HepG2 cells treated with pEGFP-N2/XPD.A:blank control group;B:pEGFP-N2 group;C:pEGFP-N2/XPD group.Mean±SD.n=6.*P<0.05,**P<0.01 vs pEGFP-N2 group or blank control group.图4pEGFP-N2/XPD转染后HepG2细胞的XPD、Mdm2、Mdm4和P53蛋白表达水平的变化
讨 论
Mdm2和Mdm4参与细胞调控的多条通路,在肿瘤的发生和发展过程中发挥重要作用。目前已发现,很多人类肿瘤中都存在着Mdm2和Mdm4过度表达的现象[7]。在肿瘤细胞中,Mdm2和Mdm4的过表达,使得野生型P53(wt-P53)的抑癌活性丧失,抑制其抗肿瘤活性,促进肿瘤的形成。因此,Mdm2和Mdm4 是 wt-P53 的负调节因子[8]。Riedinger等[9]发现,通过抑制Mdm2和Mdm4以恢复P53的活性,可起到抑制肿瘤的作用[9]。在体外的动物实验中,通过基因敲除使得Mdm2和Mdm4缺失,这能诱导P53依赖的凋亡。而Mdm2和Mdm4异二聚体的形成对抑制P53活性起到了至关重要的作用[10]。本研究组既往的研究亦发现,通过RNA干扰技术使Mdm2表达下调,这抑制了肝癌细胞的增殖,并诱导其凋亡;同时,沉默Mdm2的表达能上调p21的表达,而后者是P53通路最重要的下游基因之一[11]。当然,Mdm2和Mdm4亦可通过非P53依赖的方式诱导肿瘤形成[12]。在抑制 P53方面,Mdm2和 Mdm4承担着不同却又互补的作用:Mdm2主要调节P53的稳定性,而 Mdm4 调节 P53 的活性[13]。
TFⅡH 是由 9 个亚基(XPB、XPD、P62、P52、P44、P34、cdk7、cyclinHT 和 MATl)组成的多酶复合物,XPD作为其支架,介导着复合物内部的连接[14]。XPD基因的突变与3种人类遗传性疾病有关,即着色性干皮病、Cockayne综合症和毛发硫性营养不良[15]。XPD具有单链DNA解旋酶活性,参与了核酸剪切修复,它的功能缺陷可导致突变的基因得不到有效的修复,同时也会影响一些癌基因和抑癌基因的功能,从而诱导肿瘤的发生[16]。
如上所述,XPD能起到抑癌基因的作用,而Mdm2和Mdm4可诱导肿瘤的发生。因此,我们可以假设:XPD能下调Mdm2和Mdm4的表达。为此,本研究用脂质体转染法将重组质粒pEGFP-N2/XPD转染进入人肝癌细胞株以使得XPD高表达,然后检测Mdm2、Mdm4和P53表达量的变化,并观察肝癌细胞的增殖和凋亡。
本研究结果显示,XPD高表达可增加P53的表达,并能抑制肝癌细胞增殖及诱导其凋亡,这与本研究组既往的研究结果相一致[17-18];另外,XPD高表达可降低 Mdm2和 Mdm4的表达。上述结果表明,XPD、P53与Mdm2、Mdm4之间存在着相互联系,共同影响着肝癌的发生与发展,也将为肝癌的治疗提供可能的分子作用靶点。
[1] Toledo F,Wahl GM.MDM2 and MDM4:p53 regulators as targets in anticancer therapy[J].Int J Biochem Cell Biol,2007,39(7-8):1476-1482.
[2] 潘运龙,覃 莉,蒋光愉,等.MDM2和P53蛋白表达与原发性肝细胞肝癌发生的关系[J].中国病理生理杂志,2004,20(1):72-75.
[3] Coin F,Proietti De Santis L,Nardo T,et al.p8/TTD-A as a repair-specific TFIIH subunit[J].Mol Cell,2006,21(2):215-226.
[4] 丁 浩,李菊香,洪 葵,等.人着色性干皮病基因D组基因对白细胞介素-6促进人血管平滑肌细胞增殖作用的影响[J].中国病理生理杂志,2011,27(4):625-631.
[5] Lainé JP,Mocquet V,Bonfanti M,et al.Common XPD(ERCC2)polymorphisms have no measurable effect on nucleotide excision repair and basal transcription[J].DNA Repair(Amst),2007,6(9):1264-1270.
[6] 汤 蕾,张吉翔,熊 瑛.人着色性干皮病D组基因的克隆及其真核表达[J].生物医学工程学杂志,2008,25(3):668-672.
[7] Wade M,Li YC,Wahl GM.MDM2,MDMX and p53 in oncogenesis and cancer therapy[J].Nat Rev Cancer,2013,13(2):83-96.
[8] Melo AN,Eischen CM.Protecting the genome from Mdm2 and Mdmx[J].Genes Cancer,2012,3(3-4):283-290.
[9] Riedinger C,McDonnell JM.Inhibitors of MDM2 and MDMX:a structural perspective[J].Future Med Chem,2009,1(6):1075-1094.
[10] Xiong S.Mouse models of Mdm2 and Mdm4 and their clinical implications[J].Chin J Cancer,2013,32(7):371-375.
[11]刘 莉,丁 浩,马果果,等.siRNA干扰MDM2基因对人肝癌HepG2细胞增殖和凋亡的影响[J].山东医药,2011,51(16):12-15.
[12] Li Q,Lozano G.Molecular pathways:targeting Mdm2 and Mdm4 in cancer therapy[J].Clin Cancer Res,2013,19(1):34-41.
[13] Graves B,Thompson T,Xia M,et al.Activation of the p53 pathway by small-molecule-induced MDM2 and MDMX dimerization[J].Proc Natl Acad Sci U S A,2012,109(29):11788-11793.
[14]Rudolf J,Rouillon C,Schwarz-Linek U,et al.The helicase XPD unwinds bubble structures and is not stalled by DNA lesions removed by the nucleotide excision repair pathway[J].Nucleic Acids Res,2010,38(3):931-941.
[15] Yu HP,Wang XL,Sun X.Polymorphisms in the DNA repair gene XPD and susceptibility to esophageal squamous cell carcinoma[J].Cancer Genet Cytogenet,2004,154(1):10-15.
[16] Uhring M,Poterszman A.DNA helicases and human diseases[J].Med Sci(Paris),2006,22(12):1087-1094.
[17]Wang HY,Xiong GF,Zhang JX,et al.The role of XPD in cell apoptosis and viability and its relationship with p53 and cdk2 in hepatoma cells[J].Med Oncol,2012,29(1):161-167.
[18] Ding H,Xu JJ,Huang Y,et al.XPD could suppress growth of HepG2.2.15 and down-regulate the expression of hepatitis B virus x protein through P53 pathway[J].Biochem Biophys Res Commun,2012,419(4):761-767.
