Orai3参与了HUVECs外钙敏感受体介导的钙内流和NO生成*
2014-11-08王腊梅庞丽娟孙志萍
王腊梅, 钟 华, 赵 慧, 王 静, 庞丽娟, 孙志萍, 何 芳△
(1新疆地方病与民族高发病教育部重点实验室,石河子大学医学院2病理生理教研室,3病理教研室,4医学机能实验中心,新疆 石河子832002)
近年来广泛的研究证实钙池操纵性钙通道(store-operated Ca2+channels,SOC)和受体操纵性钙通道(receptor-operated Ca2+channels,ROC)是非兴奋细胞介导外Ca2+内流的重要通道,参与多种生理和病理生理过程,对维持细胞内游离Ca2+浓度稳定具有重要作用。SOC激活依赖内质网(endoplasmic reticulum,ER)钙库耗竭后ER腔内Ca2+浓度下降,对Ca2+有高度选择;ROC激活不依赖钙库耗竭,而依赖 G蛋白偶联受体(G-protein-coupled receptor,GPCR)-Gq/11-磷脂酶 C(phospholipid lipoidase,PLC)-磷脂酰肌醇二磷酸(phosphatidylinositol diphosphate,PIP2)-二脂酰甘油(diacylglycerol,DAG)-蛋白激酶C(protein kinase C,PKC)通路产生的DAG,对Ca2+缺乏选择性。研究发现Ca2+通道蛋白Orai由于其在介导钙库操纵的钙内流(store-operated calcium entry,SOCE)中的作用而受到广泛关注。Orai家族最早被认为是SOC或称钙释放激活钙离子通道(Ca2+release-activated Ca2+channel,CRAC)的构成蛋白,是4次跨膜蛋白,包括 Orai1、Orai2 和 Orai3[1]。关于Orai的研究起步较晚,在参与构成SOC介导的SOCE上存在争议。Mercer等[2]在异源表达基质相互作用分子1(stromal interaction molecule 1,STIM1)、Orai1、Orai2和Orai3的HEK293细胞中发现,所有Orai蛋白都能增加SOCE,且增强 SOC的作用功效依次是Orai1>Orai2>Orai3,其中 Orai3能部分代偿 Orai1敲除对细胞产生的影响。DeHaven等[3]的研究显示,Orai1、Orai2和Orai3通道都能被胞外Ca2+抑制,且Orai3通道对钙库排空过程有一定的抑制作用。
钙敏感受体(Ca2+-sensing receptor,CaR)为GPCR超家族中C亚族的成员。我们前期的研究发现:在人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中,CaR 激活介导了[Ca2+]i升高及一氧化氮(nitric oxide,NO)的生成过程[4-5],SOC和ROC以协同的方式参与了此过程,且瞬时受体电位阳离子通道C亚族成员1(transient receptor potential cation channel,subfamily C,member 1,TRPC1)、STIM1和Orai1为参与上述过程的关键组件之一,那么Orai3是否参与了CaR经SOC和ROC介导的Ca2+内流和NO生成呢?本研究拟在前期工作基础上以原代培养的HUVECs为研究对象,构建Orai3干扰质粒,通过分别检测mRNA和蛋白表达筛选出抑制效率高的干扰质粒,并观察Orai3基因沉默后对HUVECs中[Ca2+]i和 NO生成的影响,试图阐明Orai3在CaR介导[Ca2+]i和NO生成中的作用和机制,为心脑血管疾病防治提供新思路。
材料和方法
1 材料
健康孕妇剖宫产的新鲜脐带(来自华中科技大学同济医学院附属同济医院,经伦理道德委员会批准和个人知情同意)。
2 主要试剂
内皮细胞培养基(ScienCell);蛋白酶抑制剂(Calbiochem);兔抗人Orai3多克隆抗体和鼠抗βactin单克隆抗体(Santa Cruz);Ⅱ抗(ProteinTech);ECL发光试剂盒(Thermo);逆转录试剂盒与realtime RT-PCR试剂盒(TaKaRa);LipofectamineTM2000与OPTI-MEM(Invitrogen);Fura-2/AM(Invitrogen);DAF-FM DA(NO荧光探针;Beyotime);G418(Biosharp);去内毒素高纯度质粒抽提试剂盒(Omega);shRNA(上海吉凯基因化学技术有限公司);引物(友名生物技术有限公司);其余均为国产分析纯试剂。
3 主要仪器
Ca2+成像系统FV300、倒置荧光显微镜IX-70和激光共聚焦显微镜FV300(Olympus)。
4 方法
4.1 HUVECs的培养与鉴定 依据本研究室以前的方法培养HUVECs并传代[4],用细胞内Ⅷ因子相关抗原进行免疫细胞化学染色,鉴定HUVECs,取生长状态良好的第2~5代细胞用于实验。
4.2 Orai3基因的shRNA构建及转染 (1)遵循shRNA的设计原则,根据GenBank中人Orai3的cDNA序列(NM_152288),以其同源的编码DNA序列(coding DNA sequences,CDS)部分设计、合成 3条shRNA,分别命名为 shOrai3-75、shOrai3-76和 shO-rai3-77,上述序列经BLAST软件分析,与人类基因外显子无同源性,排除对其它基因的非特异性干扰,并与载体连接构建成重组质粒。(2)转染:细胞生长至70%~90%时进行转染,实验分为未转染组即空白对照组(control组)、空质粒组(vehicle组)和特异性质粒转染组即实验组(Orai3 shRNA)。以6孔板的1个孔为例,首先取一无菌EP管加250 μL OPTI-MEM培养基和 5 μL LipofectamineTM2000(Invitrogen),轻轻混匀。再取另一无菌EP管加250 μL OPTI-MEM培养基和2 μg质粒DNA,轻轻混匀。室温下孵育5 min后,混匀以上2种复合物,室温孵育20 min。最后将此复合物加入到含有1.5 mL OPTI-MEM的6孔板中,细胞培养4~6 h后,换无血清ECM培养基继续培养。
4.3 Real-time RT-PCR检测HUVECs中Orai3 mRNA的表达 引物由友名生物技术有限公司设计合成。Orai3上游引物5′-GAG AGC TTG TGG GAC CTT CAG TG-3′,下游引物 5′-TAA ACC AAC AAT TGG CTG CCT TC-3′。β-actin 上游引物 5′-ACG GTC AGG TCA TCA CTA TCG-3′,下游引物 5′-GGC ATA GAG GTC TTT ACG GAT G-3′。用 Trizol法抽提细胞RNA,紫外分光光度仪分别在260 nm和280 nm波长下检测计算提取的总RNA浓度及纯度。然后按逆转录试剂盒(TaKaRa)将RNA逆转为cDNA,以此为模板以β-actin为内参照,用real-time RT-PCR试剂盒对mRNA进行多聚酶联反应,反应体系为25 μL,其中 SYBR Premix Ex Taq 12.5 μL,PCR Forward Primer 0.5 μL,PCR Reverse Primer 0.5 μL,样品cDNA 2.0 μL,灭菌蒸馏水 9.5 μL。反应条件为预变性95℃ 30 s;PCR反应(95℃ 5 s、60℃ 20 s),40个循环。随之由电脑自动分析系统进行定量分析,每组实验重复4次。
4.4 免疫印迹法检测HUVECs中Orai3的蛋白表达及干扰效率 各转染组转染48 h后,用G418进行稳筛,7 d后弃去培养基,用预冷的PBS冲洗细胞3次,在冰上按1∶100的比例加入含有蛋白酶抑制剂的细胞裂解液100 μL,用细胞刮刮下贴壁细胞,将黏稠状细胞裂解产物收集于离心管中。冰中静置60 min,12 000 r/min、4℃ 离心15 min。取上清到另一离心管,弃去沉淀。取5 μL上清用于 BCA试剂测定蛋白质浓度并标化,以β-actin为内参照。将蛋白样品加入加样缓冲液,沸水煮10 min,10 000 r/min离心5 min后上样。SDS-PAGE电泳分离蛋白,选用硝酸纤维素(nitrocellulose,NC)膜进行湿转,用5%脱脂奶粉TBST溶液封闭1 h,分别加入抗 Orai3抗体(1∶1 000),抗 β-actin抗体(1∶800)置于 4 ℃孵育过夜。第2天用TBST洗膜4次,加入Ⅱ抗(1∶5 000),37℃摇床上孵育1 h。TBST洗3次。用ECL化学发光试剂进行显色,显影、定影,获得实验结果,重复3次。
4.5 HUVECs中Ca2+浓度测定 参照文献[6]将第2代或第3代HUVECs接种于放有圆形玻片的培养皿中,待细胞达80%融合时进行转染,转染48 h后将玻片取出放入自制的灌流槽中,将1 μL浓度为1 mmol/L的 Fura-2/AM 与499 μL含2 mmol/L含钙液混合后加入灌流槽中,37℃孵育细胞30 min。冲洗3~5遍后用含钙液去酯化20 min。将灌流槽放于倒置荧光显微镜上,利用340 nm与380 nm波长的激发光激发Ca2+荧光探针Fura-2/AM发射荧光,用CCD拍摄荧光的动态变化,通过340 nm和380 nm的荧光强度比值的变化(即Δratio)反映[Ca2+]i,每组实验重复3次。
4.6 HUVECs中NO含量的检测 参照文献[6],将第2代或第3代HUVECs接种于放有圆形玻片的培养皿中,待细胞达80%左右融合时进行转染,转染48 h后将玻片取出放入自制的灌流槽中,按1∶2 000比例加入DAF-FM DA荧光探针稀释液稀释DAF-FM DA,37℃孵育细胞20 min后,用2 mmol/L含钙液冲洗3次后将灌流槽放于荧光显微镜上,用495 nm激发波长,515 nm发射波长,实时检测2 mmol/L精胺刺激前后荧光的强弱变化,并通过IPA Software进行分析。NO相对荧光强度计算公式如下:NO含量=[测定孔曲线最高相对荧光强度(relative fluorescence unit,RFU)-最低RFU]-(空白孔曲线最高RFU-最低RFU),每组实验重复3次。
5 统计学处理
数据用均数±标准误(mean±SEM)表示,采用SPSS 17.0统计软件分析,多组间均数比较采用单因素方差分析(One-way ANOVA),有显著差异者两组间均数比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 激光共聚焦显微镜下观察shRNA成功转染HUVECs
细胞转染Cy3标记的shOrai3后,激光共聚焦显微镜下观察可见成功转染的细胞内发出红色荧光,可反映转染效率。转染48 h后加入G418稳筛后,可获取90%以上的阳性克隆细胞,见图1。
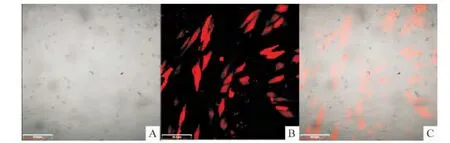
Figure 1.Cy3-labelled shOrai3-transfected HUVECs(×20).A:the HUVECs profile under nature light;B:Cy3-labelled red fluorescence in HUVECs;C:merged image.Scale bar=50 μm.图1 Cy3标记的shOrai3转染进入细胞
2 Real-time RT-PCR检测HUVECs中Orai3 mRNA的表达及shOrai 3的干扰效率
同一代HUVECs分为3组:即空白对照组(control组)、空质粒组(vehicle组)和实验组(shOrai3-75、shOrai3-76和shOrai3-77组)。各转染组分别转染48 h后用G418进行稳筛7 d后提取总mRNA,采用real-time RT-PCR检测Orai3 mRNA的表达。结果显示:转染各组与control组相比,可见vehicle组mRNA表达无明显变化(P>0.05),其余各转染组mRNA的表达均有降低,尤其是shOrai3-77组中Orai3 mRNA表达显著降低(抑制率为84.5%,P<0.05),见图2。
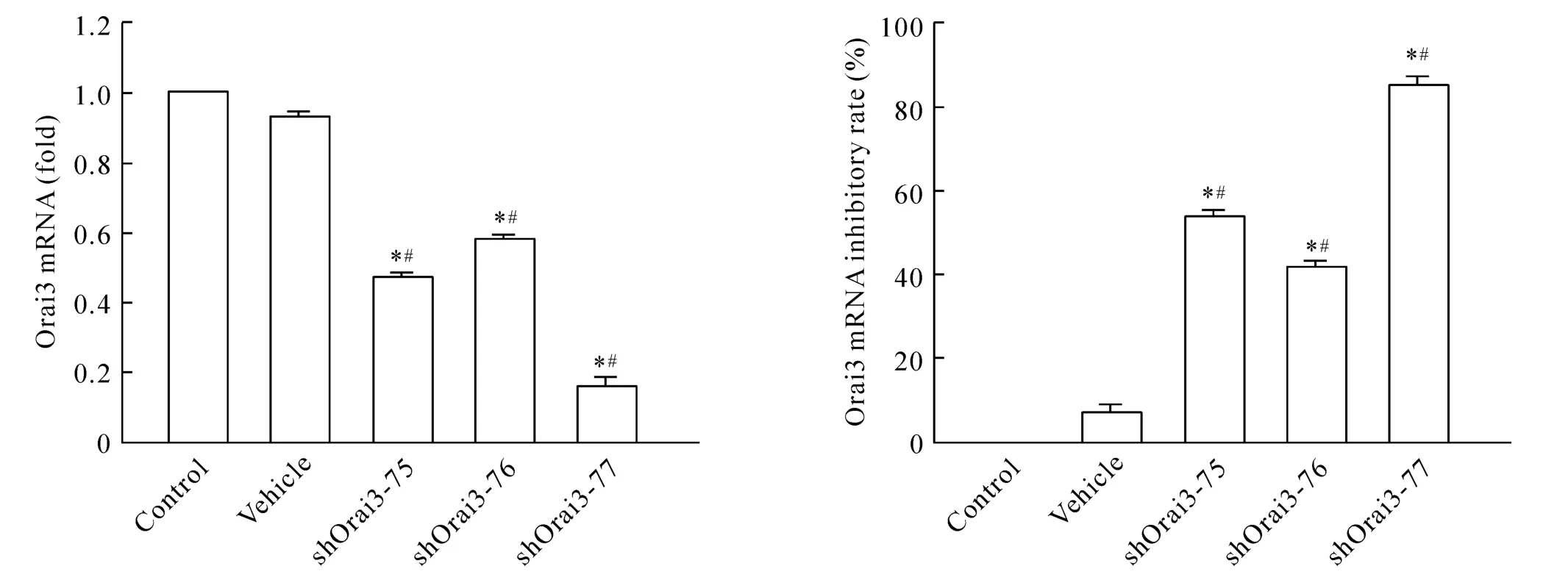
Figure 2.Expression of Orai3 mRNA in HUVECs and interference efficiency of shOrai3.Mean±SEM.n=4.*P<0.05 vs control group;#P<0.05 vs vehicle group.图2 各转染组HUVECs中Orai3 mRNA的表达及shOrai3的干扰效率
3 免疫印迹技术检测Orai3的蛋白表达及shOrai3的干扰效率
提取转染48 h、用 G418(200 mg/L)进行筛选7 d后HUVECs的总蛋白,转染各组与control组相比,可见 vehicle组的 Orai3蛋白表达无明显变化(P>0.05),其余各转染组蛋白的表达均有降低,尤其是shOrai3-77组中Orai3的蛋白表达显著降低(抑制率为70.68%,P<0.05),见图3。
4 不同处理因素对HUVECs中[Ca2+]i和NO生成的影响
4.1 Orai3基因沉默使CaR激动剂精胺诱导的HUVECs中[Ca2+]i和NO生成减少 选取干扰效率最高的shOrai3-77组为特异性质粒转染组即实验组(即精胺+Ca2++shOrai3-77组),另设未转染组即空白对照组(control组,即精胺+Ca2+组)和空质粒组(vehicle-Orai3组,即精胺 +Ca2++vehicle-Orai3组),将3组细胞接种于圆形玻片上,待HUVECs生长融合至80%左右时进行转染,继续培养48 h后将玻片取出,放入灌流槽中测定加精胺刺激后[Ca2+]iΔratio值和NO荧光强度值的变化。与空白对照组及空质粒组相比,实验组[Ca2+]iΔratio值和NO净荧光强度值明显降低(P<0.05),而空质粒组与空白对照组相比[Ca2+]iΔratio值和NO净荧光强度值无显著差异(P>0.05),说明shRNA沉默Orai3基因,能够使CaR经SOC和ROC介导的[Ca2+]i和NO生成减少,见图 4、5。
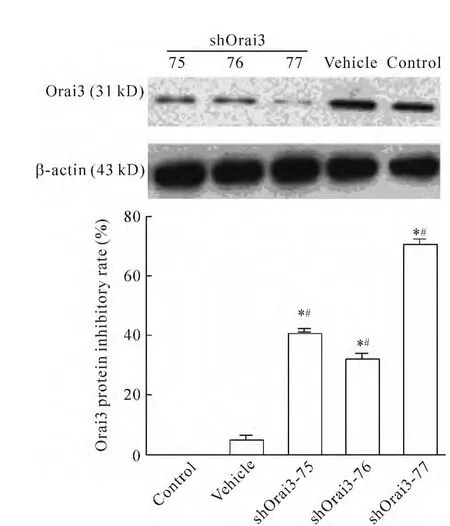
Figure 3.Expression of Orai3 protein in HUVECs and inhibitory efficiency of shOrai3.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle group.图3 各转染组HUVECs中Orai3蛋白的表达及shOrai3的抑制效率
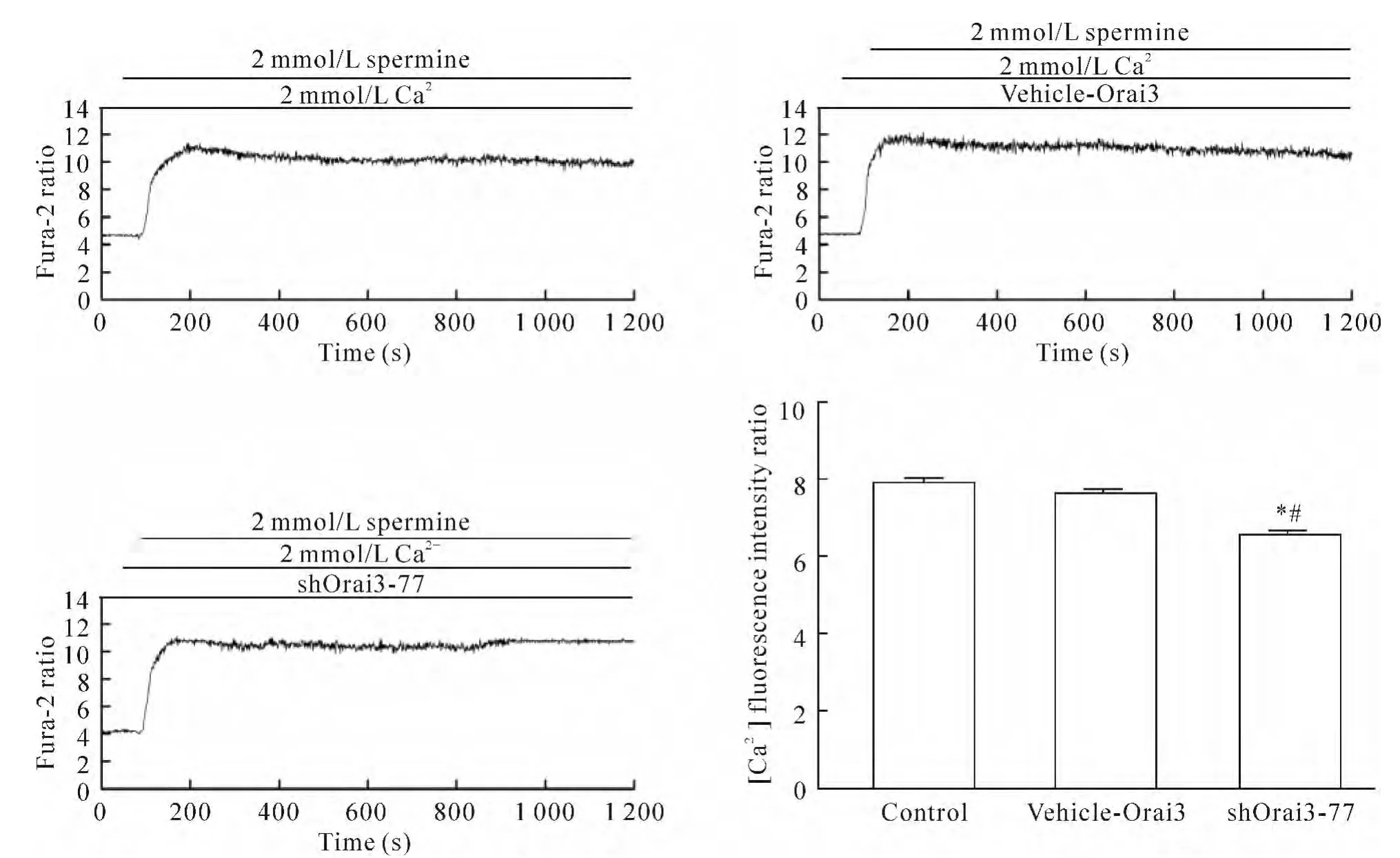
Figure 4.Dynamic changes of intracellular calcium fluorescence intensity after CaR agonist spermine treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图4 CaR激动剂精胺刺激HUVECs后各转染组中Ca2+荧光强度的动态变化
4.2 Orai3基因沉默使ROC模拟剂TPA+CaR负性变构调节剂Calhex 231诱导的HUVECs中[Ca2+]i和NO生成减少 将细胞分为实验组(即Calhex 231+TPA+精胺+Ca2++shOrai3-77组)、空白对照组(control组,即 Calhex 231+TPA+精胺 +Ca2+组)和空质粒组(vehicle-Orai3组,即 Calhex 231+TPA+精胺+Ca2++vehicle-Orai3组)。细胞转染48 h后,与空白对照组及空质粒组相比,实验组中[Ca2+]iΔratio值和NO净荧光强度值明显降低(P<0.05),而空质粒组与空白对照组相比[Ca2+]iΔratio值和NO净荧光强度值无显著差异(P>0.05),说明shRNA沉默Orai3基因,能够使CaR经ROC介导的[Ca2+]i和 NO 生成减少,见图6、7。
4.3 Orai3基因沉默使PKC抑制剂Ro31-8220介导的HUVECs中[Ca2+]i和NO生成减少 将细胞分为实验组(即Ro31-8220+精胺+Ca2++shOrai3-77组)、空白对照组(control组,即Ro31-8220+精胺+Ca2+组)和空质粒组(vehicle-Orai3组,即Ro31-8220+精胺+Ca2++vehicle-Orai3组)。细胞转染48 h后,与空白对照组及空质粒组相比,实验组中[Ca2+]iΔratio值和 NO净荧光强度值明显降低(P<0.05)。而空质粒组与空白对照组相比[Ca2+]iΔratio值和 NO净荧光强度值无显著差异(P>0.05),说明shRNA沉默Orai3基因,能够使CaR经SOC介导的[Ca2+]i和NO生成减少,见图8、9。
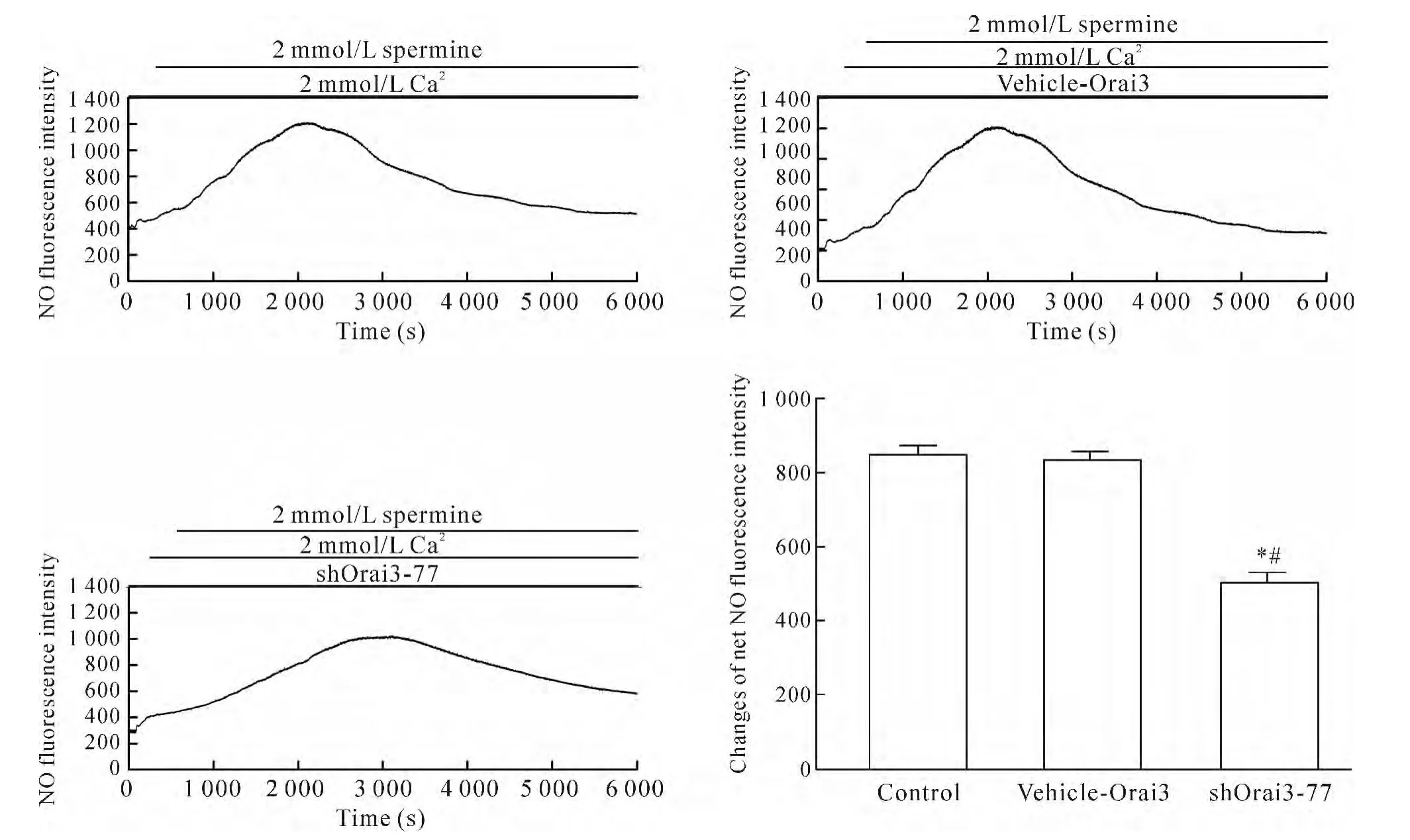
Figure 5.Dynamic changes of NO fluorescence intensity after CaR agonist spermine treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图5 CaR激动剂精胺刺激HUVECs后各转染组中NO荧光强度的动态变化
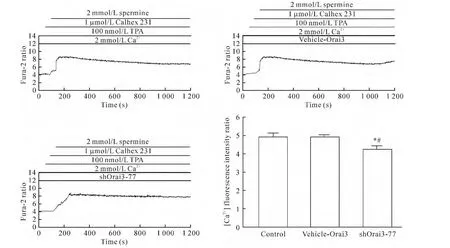
Figure 6.Dynamic changes of intracellular calcium fluorescence intensity after CaR negative allosteric modulator Calhex 231 plus ROC analogue TPA treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图6 ROC模拟剂TPA+CaR负性变构调节剂Calhex 231刺激HUVECs后各转染组中Ca2+荧光强度的动态变化
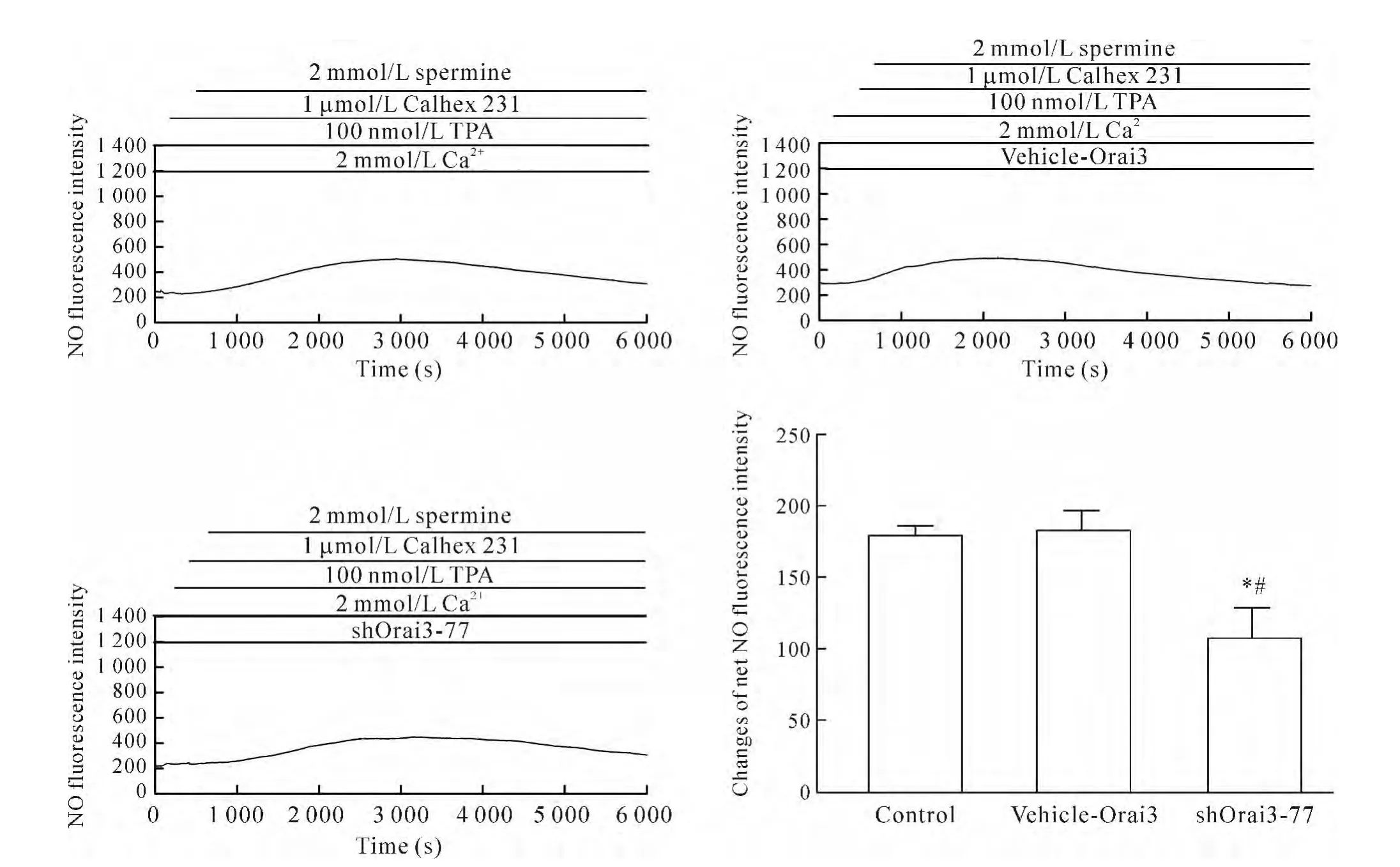
Figure 7.Dynamic changes of NO fluorescence intensity after CaR negative allosteric modulator Calhex 231 plus ROC analogue TPA treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图7 ROC模拟剂TPA+CaR负性变构调节剂Calhex 231刺激HUVECs后各转染组中NO荧光强度的动态变化
4.4 Orai3基因沉默使经典型PKCs和PKCμ抑制剂 Go6967介导的HUVECs中[Ca2+]i和NO生成减少 将细胞分为实验组(即Go6976+精胺+Ca2++shOrai3-77组)、空白对照组(control组,即Go6976+精胺 +Ca2+组)和空质粒组(vehicle-Orai3组,即Go6976+精胺+Ca2++vehicle-Orai3组)。细胞转染48 h后,与空白对照组及空质粒组相比,实验组中[Ca2+]iΔratio值和NO净荧光强度值明显降低(P<0.05),而空质粒组与空白对照组相比[Ca2+]iΔratio值和NO净荧光强度值无显著差异(P>0.05),说明shRNA沉默Orai3基因,能够使CaR经SOC介导的[Ca2+]i和 NO 生成减少,见图10、11。
讨 论
Ca2+是细胞内最普遍和最重要的信号转导成分,在细胞内转导信息,并且调控多种生命过程,如细胞的收缩、增殖、分化与凋亡等[7]。无论在细胞内或细胞外执行功能,Ca2+必须首先达到或维持一定浓度,并且在细胞内外维持一定的浓度差。各种信号分子、电压依赖性钙通道、ROC、SOC等在[Ca2+]i的调节方面发挥重要作用,包括由CaR介导的细胞内钙库释放和由各类通道介导的Ca2+内流两部分。CaR调节细胞内钙库释放使[Ca2+]i升高,其速度快但是维持时间短,而细胞外Ca2+内流则可使[Ca2+]i持续升高,可以调节长期细胞效应,如细胞生长、分化及细胞内NO的生成等,因此细胞外Ca2+内流在细胞内转导信息方面更为重要[8]。以往研究大多只关注细胞内钙释放对[Ca2+]i及 NO生成的影响[6],而细胞内钙池持续释放有赖于外Ca2+内流对细胞内钙池的重新填充,且本课题组前期研究发现在HUVECs中CaR激活引发持续Ca2+内流是NO生成重要条件[4-5],但参与Ca2+内流关键分子组件尚不清楚。
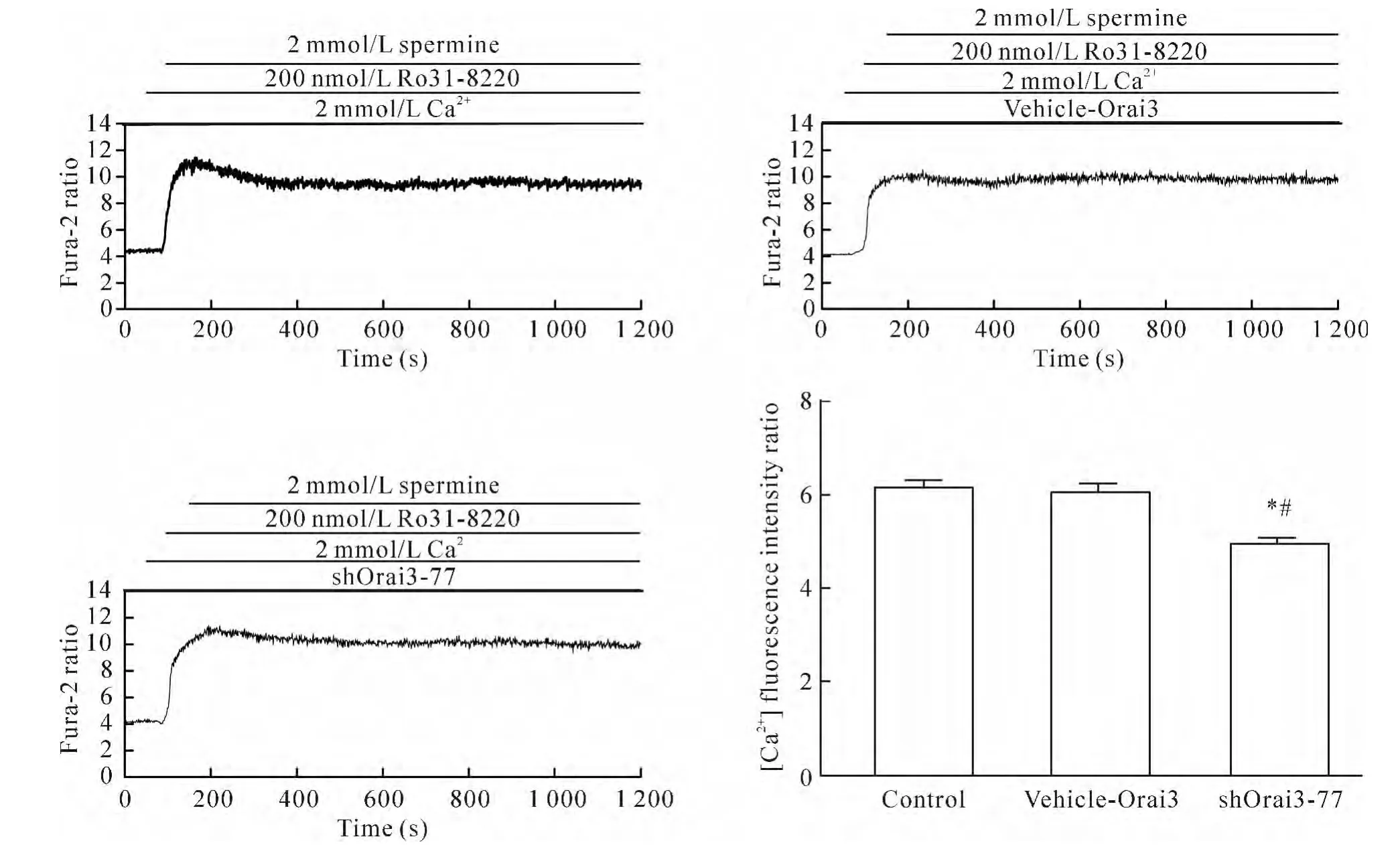
Figure 8.Dynamic changes of intracellular calcium fluorescence intensity after PKA inhibitor Ro31-8220 treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图8 PKC抑制剂Ro31-8220刺激HUVECs后各转染组中Ca2+荧光强度的动态变化
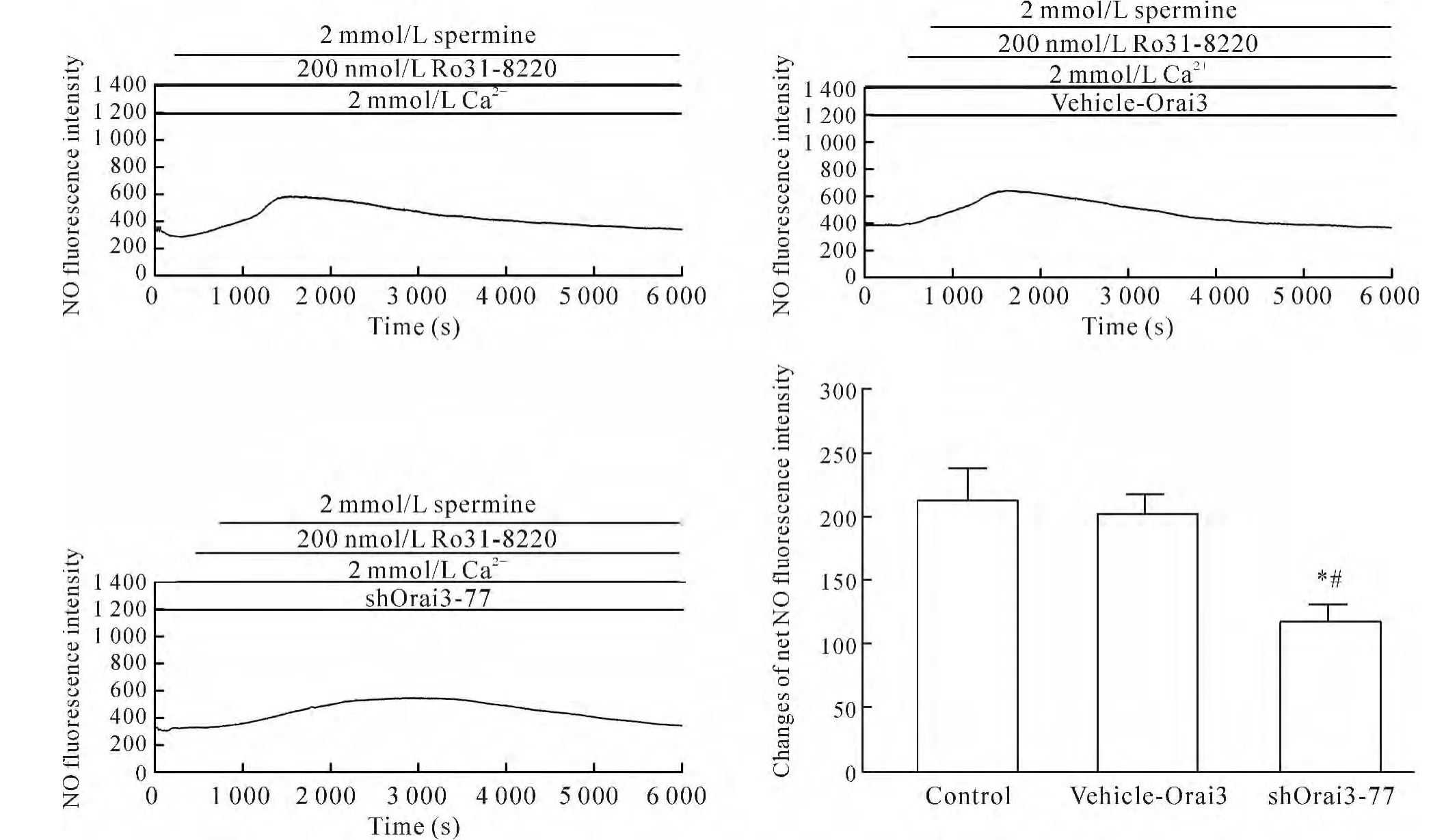
Figure 9.Dynamic changes of NO fluorescence intensity after PKA inhibitor Ro31-8220 treatment in different transfected HUVEC.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3group.图9 PKC抑制剂Ro31-8220刺激HUVECs后各转染组中NO荧光强度的动态变化
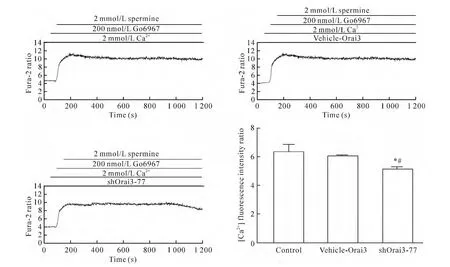
Figure 10.Dynamic changes of intracellular calcium fluorescence intensity after PKCs and PKCμ inhibitor treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图10 经典型PKCs和PKCμ抑制剂Go6967刺激HUVECs后各转染组中Ca2+荧光强度的动态变化
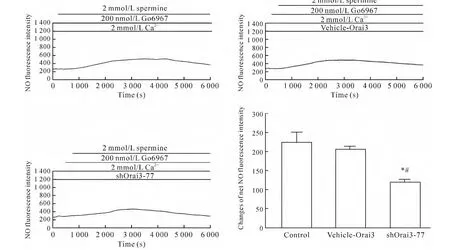
Figure 11.Dynamic changes of NO fluorescence intensity after PKCs and PKCμ inhibitor treatment in different transfected HUVECs.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs vehicle-Orai3 group.图11 经典型PKCs和PKCμ抑制剂Go6967刺激HUVECs后各转染组中NO荧光强度的动态变化
有研究表明在HEK293细胞株、T淋巴细胞和成纤维细胞中都有Orai1、Orai2和 Orai3 mRNA表达,其中,Orai1是介导SOC的主要分子组成部分,3种Orai以同源二聚体、同源多聚体和异源多聚体形式存在于细胞膜上[9]。此外,虽然Orai1、Orai2和Orai3在序列上高度同源,但它们所表现出的功能特点有着很明显的区别。Lis等[10]采用 Orai2和 Orai3与STIM1共表达的方法发现,Orai2和Orai3与STIM1共同异位表达时均能形成Ca2+通道并且显示出类似于Orai1与STIM1的共表达产生的Ca2+释放激活的钙电流的电生理特性。然而两者在其激活和失活的动力学、对一价离子的渗透和对SOC抑制剂2-氨乙氧基二苯基硼酸盐(2-aminoethoxydiphenyl borate,2-APB)的反应上都有所不同,50 μmol/L 2-APB能够抑制Orai1与 STIM1介导的 Ca2+电流,但能激活Orai3与 STIM1介导的 Ca2+电流。Faouzi等[11]研究表明乳腺癌组织中Orai3表达上调,并通过丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路激活c-myc基因,在乳腺癌细胞增殖及细胞周期进展调控中起着重要作用。Motiani等[12]研究显示Orai3的高表达可促进氧化应激介导的效应T淋巴细胞增殖;与此同时有学者指出Orai3参与了血管平滑肌重塑以及血管损伤所致的新生内膜增生[13]。
我们前期研究发现HUVECs中CaR为功能性表达,并证实CaR在介导Ca2+内流、eNOS活性和NO生成中起着重要作用[14],且SOC与ROC是以协同方式参与CaR介导的Ca2+内流及NO生成。而钙通道相关蛋白Orai3是否为其关键分子组件尚不清楚。本研究首先采用脂质体法将设计好的shRNA包裹转染到HUVECs中,将筛选出来的抑制效率最高的shRNA转染HUVECs,在保证沉默Orai3基因有效抑制Orai3表达前提下,以精胺与原代培养HUVECs共孵育激活CaR为细胞模型,首先证实了在HUVECs中沉默Orai3后对 CaR介导的[Ca2+]i升高和 NO生成均有抑制作用,此抑制效应由shRNA特异抑制Orai3基因表达所介导。而后又以ROC模拟剂TPA+CaR负性变构调节剂 Calhex 231、PKC抑制剂Ro31-8220及经典型PKCs和PKCμ抑制剂Go6967共孵育HUVECs为细胞模型,通过分别激活SOC或ROC最终证明在精胺刺激激活CaR介导[Ca2+]i和NO的生成过程中,Orai3既作为SOC的关键组件,又作为ROC的关键组件参与了CaR介导Ca2+内流及NO生成。
综上所述,本研究以HUVECs为研究对象,通过RNAi沉默 HUVECs中Orai3的表达,成功构建了Orai3基因的shOrai3,并为后续相关Orai3功能的研究打下了基础,亦证明了Orai3为CaR经SOC、ROC途径介导钙内流和NO生成的关键组件之一。基于目前文献报道的CaR在调节血管张力、心肌肥厚、动脉粥样硬化、心肌缺血再灌注损伤等心血管生理和病理生理过程中的重要作用,无疑本研究结论将为进一步阐明CaR导致钙超载和血管内皮功能障碍及在相关心血管疾病发病中作用和机制提供重要理论基础,并为其防治提供新靶标。
(致 谢:衷心感谢华中科技大学同济医学院病理生理学系/卫生部呼吸疾病重点实验室提供实验条件和技术指导。)
[1] Ji W,Xu P,Li Z,et al.Functional stoichiometry of the unitary calcium-release-activated calcium channel[J].Proc Natl Acad Sci U S A,2008,105(36):13668-13673.
[2] Mercer JC,Dehaven WI,Smyth JT,et al.Large storeoperated calcium selective currents due to co-expression of Orai1 or Orai2 with the intracellular calcium sensor,Stim1[J].J Biol Chem,2006,282(34):24979-24990.
[3] DeHaven WI,Smyth JT,Boyles RR,et al.Calcium inhibition and calcium potentiation of Orai1,Orai2,and ORAI3 calcium release-activated calcium channels[J].J Biol Chem,2007,282(24):17548-17556.
[4] 王振焕,胡清华,钟 华,等.小凹蛋白-1在脐静脉内皮细胞CaR介导NO生成中的作用和机制[J].中国病理生理杂志,2011,27(5):934-938.
[5] 王振焕,胡清华,钟 华,等.小凹蛋白-1下调人脐静脉内皮细胞外钙敏感受体介导的钙内流[J].生理学报,2011,63(1):39-47.
[6] Ziegelstein RC,Xiong Y,He C,et al.Expression of a functional extracellular calcium-sensing receptor in human aortic endothelial cells[J].Biochem Biophys Res Commun,2006,342(1):153-163.
[7] Smyth JT,Dehaven WI,Jones BF,et al.Emerging perspectives in store-operated Ca2+entry:roles of Oral,Stim and TRP[J].Biochim Biophys Acta,2006,1763(11):1147-1160.
[8] Carafoli E.Calcium signaling:a tale for all seasons[J].Proc Natl Acad Sci USA,2002,99(3):1115-1122.
[9] Gwack Y,Srikanth S,Feske S,et al.Biochemical and functional characterization of Orai proteins[J].J Biol Chem,2007,282(22):16232-16243.
[10] Lis A,Peinelt C,Beck A,et al.CRACM1,CRACM2,and CRACM3 are store-operated Ca2+channels with distinct functional properties[J].Curr Biol,2007,17(9):794-800.
[11]Faouzi M,Kischel P,Hague F,et al.ORAI3 silencing alters cell proliferation and cell cycle progression via c-myc pathway in breast cancer cells[J].Biochem Biophys Acta,2013,1833(3):752-760.
[12] Motiani RK,Stolwijk JA,Newton RL,et al.Emerging role of Orai3 in pathopthysiology[J].Channels(Austin),2013,7(5).[Epub ahead of print]
[13]González-Cobos JC,Zhang X,Zhang W,et al.Store-independent Orai1/3 channels activated by intracrine leukotriene C4:role in neointimal hyperplasia[J].Circ Res,2013,112(7):1013-1025.
[14]梁 霄,罗小林,钟 华,等.小干扰RNA沉默细胞外钙敏感受体抑制人脐静脉内皮细胞钙内流和NO生成[J].生理学报,2012,64(3):289-295.
