容量激活性氯离子通道在低氧高二氧化碳处理的大鼠PASMCs的表达及其与MAPK通路的关系*
2014-11-08黎关龙黄林静何金波马迎春陈海娥王万铁
黎关龙, 黄林静, 何金波, 马迎春, 陈海娥, 应 磊, 汪 洋, 王万铁△
(1温州医科大学基础医学院病理生理学教研室,浙江温州325035;2浙江省医学科学院卫生学研究所毒理学研究室,浙江杭州310013)
以往研究发现,容量激活性氯离子通道(volumeactivated chloride channel,CLC3)广泛存在于肺动脉平滑肌细胞上,与肌张力、细胞容量的调节和电活动有关[1]。Xiao 等[2]研究证实,阻断氯离子通道可明显抑制内皮素1诱导的主动脉平滑肌细胞增殖。Hisadome等[3]研究表明,CLC3阻断剂可显著抑制各类血管的生成,而且CLC3还与各种生物体的跨膜氯离子转运及相关物质分泌密切相关。本室先前研究表明[4],丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路抑制剂能够减弱低氧高二氧化碳引起的肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)的收缩反应。那么此作用与PASMCs上的 CLC3有无关系?尚缺乏实验证据。因此,本实验在低氧高二氧化碳大鼠模型上,观察CLC3在PASMCs中mRNA和蛋白表达的变化,并探讨MAPK信号通路在其中的作用。
材料和方法
1 动物
SPF级标准健康雄性Sprague-Dawley(SD)大鼠14只,体重(220±30)g,由温州医科大学实验动物中心提供[SCXK(浙)2010-0101号]。
2 主要试剂
SB203580(Sigma);U0126(Sigma);二甲基亚砜(dimethyl sulfoxide,DMSO;上海申工生物技术有限公司);茴香霉素(anisomycin;Sigma);10%十二烷基磺酸钠(sodium dodecyl sulfonate,SDS;碧云天生物技术有限公司);四甲基乙二胺(tetramethylethylenediamine,TEMED;碧云天生物技术有限公司);其余试剂为国产分析纯。
3 主要方法
3.1 酶消化法取PASMCs 用10%水合氯醛3.3 mL/kg腹腔麻醉SD大鼠,在超净平台内迅速取出心肺组织,放入盛有4℃ PBS平衡盐缓冲液的培养皿中,取出左叶肺和右肺中最大的肺叶,分离肺动脉与周围组织,保留 3~4级动脉(直径300~700 μm)。去内外膜后将平滑肌剪成1 mm×1 mm×1 mm大小的组织块,装入无菌离心管中,1 000 r/min离心3 min,去上清加入消化酶,于常氧培养箱内静置消化15 min后加入培养基5 mL,吹打。吸出细胞悬液收集于离心管中。原消化酶加回组织块中,37℃、5%CO2培养箱中继续消化5 min,按上述步骤收集细胞。再重复消化操作1~2次。以2×108/L的密度种植于培养瓶中,加入含20%胎牛血清的高糖培养基置于37℃、5%CO2培养箱中培养。
3.2 PASMCs的传代培养 当细胞生长达培养瓶(培养皿)80% ~90%左右时,吸去培养液,用2~3 mL磷酸盐缓冲溶液(phosphate-buffered solution,PBS)清洗培养瓶2次,然后用0.25%胰蛋白酶消化细胞,时间大约为0.5~2 min,反复吹打使贴壁细胞脱落,离心、吹打,制成单细胞悬液。取10~30 μL计数,将适宜密度的单细胞悬液分置于3~4个培养瓶,加适量含15%胎牛血清的高糖培养基,置于37℃、5%CO2培养箱中培养。细胞传代至第2代时可冻存。
3.3 PASMCs的冻存和复苏 (1)冻存:由于实验研究中经常使用第4~5代细胞,而大鼠细胞多次传代会引起异化,生物学性状发生改变,所以需将细胞早期细胞进行冻存。冻存步骤:细胞在第2代时,选择对数生长期细胞,在冻存前1 d换培养液。用胰蛋白酶根据传代方法消化单层生长细胞,1 000 r/min离心5 min,加入配制好的冻存培养液(含20%FBS、10%DMSO的DMEM培养液),冻存液中细胞的最终密度为(5~10)×109cells/L,然后依次4℃、20℃、-70℃液氮保存。冻存须确保密封。(2)复苏:复苏细胞应快速融化,与冻存的要求相反。将冻存管投入37℃温水中,轻轻摇动使其尽快融化后用75%乙醇消毒,将液体移入无菌离心管,加入10倍培养液,1 000 r/min离心5 min,弃上清液,加入1 mL液体吹打,接种细胞密度宜为5×108cells/L,次日观察并换液培养。
3.4 PASMCs存活率的测定 取消化传代的细胞悬液9滴,加入0.4%台盼蓝液1滴,混匀后3 min内吸取1滴于计数板上,静置3 min,在显微镜下观察。若细胞核染色,则为不正常细胞或死亡细胞;若未着色,则为存活细胞。
3.5 差异贴壁法纯化细胞 细胞传至3代后,按传代方法消化、吹打细胞,然后使细胞在第1瓶中贴壁15 min,光镜下可见部分细胞贴壁。后将第1瓶中培养基移入第2瓶中,使细胞再次贴壁15 min,光镜下又可见大部分细胞贴壁。最后再将第2瓶中培养基移入第3瓶中,再使细胞贴壁,后将3瓶均补齐培养基。继续培养1~2 d后,光镜下观察:第1瓶中以较大长梭形细胞为主,为成纤维细胞;第2瓶为混和细胞;第3瓶中为较纯的梭形平滑肌细胞。取第2瓶细胞继续培养,也可重复纯化几次获得较纯的平滑肌细胞[5]。
3.6 PASMCs的鉴定 倒置相差显微镜下观察细胞形态并摄片,激光共聚焦免疫荧光染色法分别检测DAPI(激发光波长488 nm,发射光峰值630 nm)标记的细胞核及FITC(激发光波长488 nm,发射光峰值525 nm)标记的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体。
3.7 实验分组 取第4~5代生长良好的对数生长期PASMCs制成细胞悬液,按2×108cells/L的密度接种于10 cm培养皿中,加入含15%胎牛血清的高糖培养基,置于37℃、5%CO2培养箱中进行培养,待融合成单层细胞时(约80%铺满)换成无血清培养基饥饿24 h,同步后进行药物干预(30 min内完成加药操作)。(1)对照组(C):DMEM、5%CO2、21%O2、37℃、48 h;(2)低氧高二氧化碳组(H):DMEM、6%CO2、1%O2、37 ℃、48 h;(3)DMSO+ 低氧高二氧化碳对照组(D):0.05%DMSO、6%CO2、1%O2、37℃、48 h;(4)U0126+低氧高二氧化碳干预组(U):10 μmol/L U0126、6%CO2、1%O2、37 ℃、48 h;(5)SB203580+低氧高二氧化碳干预组(SB):10 μmol/L SB203580、6%CO2、1%O2、37 ℃、48 h;(6)anisomycin+低氧高二氧化碳干预组(A):10 μmol/L anisomycin、6%CO2、1%O2、37 ℃、48 h。以上每组6 皿细胞。
3.8 蛋白免疫印迹法检测PASMCs CLC3蛋白的表达 详细步骤参考李丹等[6]的实验方法。Quantity One凝胶软件分析系统分析CLC3灰度值,以目的蛋白CLC3条带灰度值和 β-actin灰度值比值代表CLC3表达的含量。
3.9 RT-PCR法检测PASMCs中CLC3 mRNA的表达 详细步骤参考李丹等[6]的实验方法。cDNA采用相应特异性引物进行PCR扩增,引物由上海生工生物工程技术服务有限公司合成,序列如下:CLC3上游引物 5’-GTAAATGGGTTGGTGATGCC-3’,下游引物 5’-CTGAGGGCAAATCCCACTAA-3’,产物 277 bp;β-actin 上 游 引 物 5’-GAGACCTTCAACACCCCAGCC-3’,下游引物 5’-TCGGGGGATCGGAACCGCTCA-3’,产物 400 bp。采用 Gel-Pro Analyzer软件分析测定吸光度(A),以CLC3扩增带与β-actin扩增带的A值之比(relative A value)作为CLC3 mRNA的相对表达量。实验重复6次。
4 统计学处理
采用SPSS 17.0软件分析。计量资料均进行正态性检验,以均数±标准差(mean±SD)表示。多方差齐者组样本均数比较进行方差齐性检验,方差齐者组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD法,方差不齐者进行Dunnett检验;双变量相关性分析采用Bivariate过程的Pearson相关分析法。以P<0.05为差异有统计学意义。
结 果
1 原代培养大鼠PASMCs的培养和鉴定
1.1 细胞形态学生长特点 平滑肌细胞原代培养72 h,此时细胞已经贴壁呈长梭形,换液后生长繁殖加快,间隙变小,成束的平滑肌细胞平行排列,部分细胞可多层重叠。培养到第5天后,细胞密度低时常交织呈网状,密度高时则呈旋涡状或者栅栏状,呈典型的“峰-谷”状生长。镜下显示细胞呈梭形,具有长短不等的数个突起,彼此融合,边界不清,折光性好,细胞核位于细胞中央,呈卵圆形,多为3~5个。传代培养的细胞生长规律与原代培养相似,传代后第2天生长繁殖活跃,4~6 d后生长进入平台期,可以进行下次传代,连续培养多代仍可保持较好状态,见图1A。
1.2 免疫细胞荧光法鉴定PASMCs 培养第4~5代的细胞经小鼠抗大鼠α-SMA单克隆抗体孵育,FITC和DAPI双染色后激光共聚焦显微镜下观察,约99%呈阳性反应。高倍镜下可见胞浆内FITC标记的α-SMA发绿色荧光,与细胞长轴平行呈纤维细丝状,此为α-SMA,仅平滑肌细胞呈阳性反应;DAPI标记的细胞核呈红色荧光,卵圆形居中,见图1B。
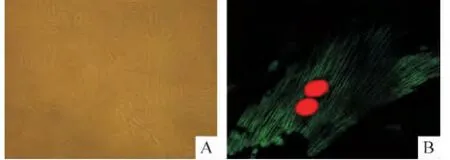
Figure 1.Primarily cultured rat PASMCs(A;×100)and their immunofluorescence identification(B;×400).Green:FITC-labelled α-SMA immunofluorescence;red:DAPI fluorescence.图1 大鼠肺动脉平滑肌细胞的原代培养和免疫荧光鉴定
1.3 台盼蓝染色结果 镜下共计数2 600个细胞,其中71个阳性细胞,阴性率为97.3%,说明用消化法传代的细胞存活率高。经冻存复苏后阴性率达87.2%,说明冻存复苏后的细胞存活率仍较高。
2 各组PASMCs CLC3 mRNA表达的变化
2.1 低氧高二氧化碳对PASMCs中CLC3 mRNA表达的影响 与C组相比,H组CLC3 mRNA表达量均显著增加,差异有统计学意义(P<0.01),见图2和表1。
2.2 低氧高二氧化碳条件下U0126和SB203580对PASMCs CLC3 mRNA表达的影响 与C组比较,H组、D+H组、U+H组、SB+H组及A+H组CLC3 mRNA表达均明显上调(均P<0.01);与H组比较,D+H组CLC3 mRNA表达略微上调,但差异无统计学意义(P>0.05),U+H组和A+H组CLC3 mRNA表达显著下调(均P<0.01),SB+H组CLC3 mRNA表达均明显上调(P<0.01);与D+H组比较,U+H组和A+H组CLC3 mRNA表达显著下调(均P<0.01),SB+H组CLC3 mRNA表达均明显上调(P<0.01),见图2和表1。
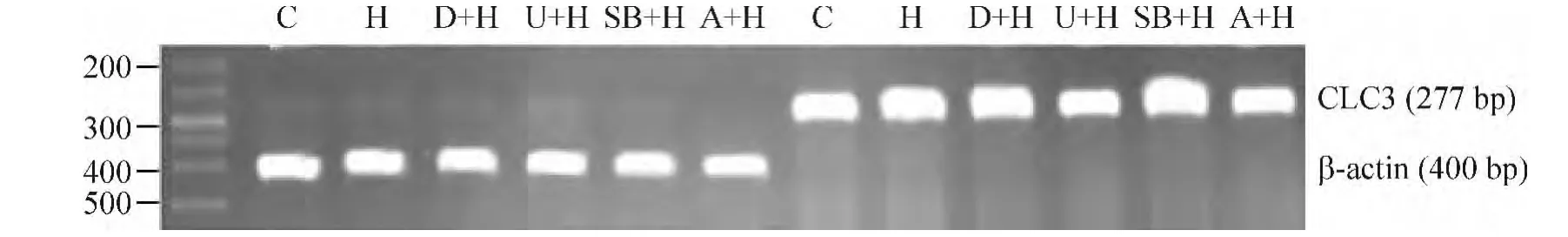
Figure 2.The expression of CLC3 mRNA in all groups.C:control group;H:hypoxic and hypercapnic group;D+H:DMSO+hypoxic and hypercapnic group;U+H:U0126+hypoxic and hypercapnic group;SB+H:SB203580+hypoxic and hypercapnic group;A+H:anisomycin+hypoxic and hypercapnic group.图2 各组细胞CLC3 mRNA的表达

表16 组PASMCs中CLC3 mRNA表达变化的比较Table 1. Changes of CLC3 mRNA expression in all groups(Mean±SD.n=6)
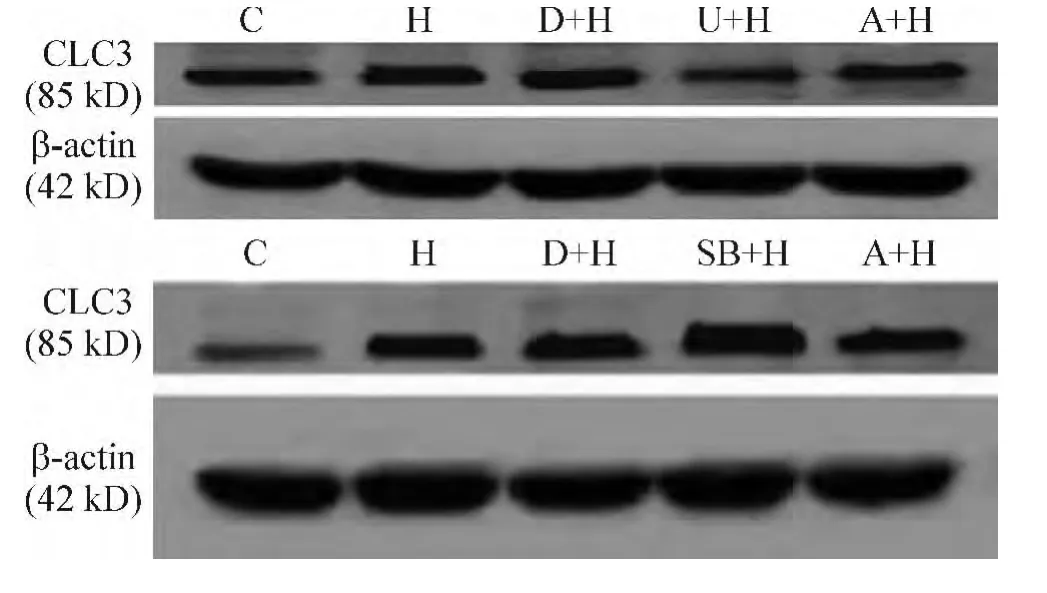
Figure 3.The expression of CLC3 protein in all groups.图3 各组细胞CLC3蛋白的表达
3 各组PASMCs中CLC3蛋白表达的变化
3.1 低氧高二氧化碳对PASMCs CLC3蛋白表达的影响 与C组相比,H组CLC3蛋白的表达显著上调,差异有统计学意义(P<0.01),见图3和表2。
3.2 低氧高二氧化碳条件下U0126和SB203580对PASMCs CLC3蛋白表达的影响 与C组比较,H组、D+H组、SB+H组CLC3蛋白表达均明显上调(均P<0.01),U+H组及A+H组CLC3蛋白表达轻微上调(均P<0.05);与H组比较,D+H组CLC3蛋白表达略微下调,但差异无统计学意义(P>0.05),U+H组CLC3蛋白表达均明显下调(P<0.01),SB+H组CLC3蛋白表达均明显上调(P<0.01),A+H组CLC3蛋白表达轻微下调(P<0.05);与D+H组比较,U+H组CLC3蛋白表达均明显下调(P<0.01),SB+H组CLC3蛋白表达均明显上调(P<0.01),A+H组 CLC3蛋白表达轻微下调(P<0.05),见图3和表2。
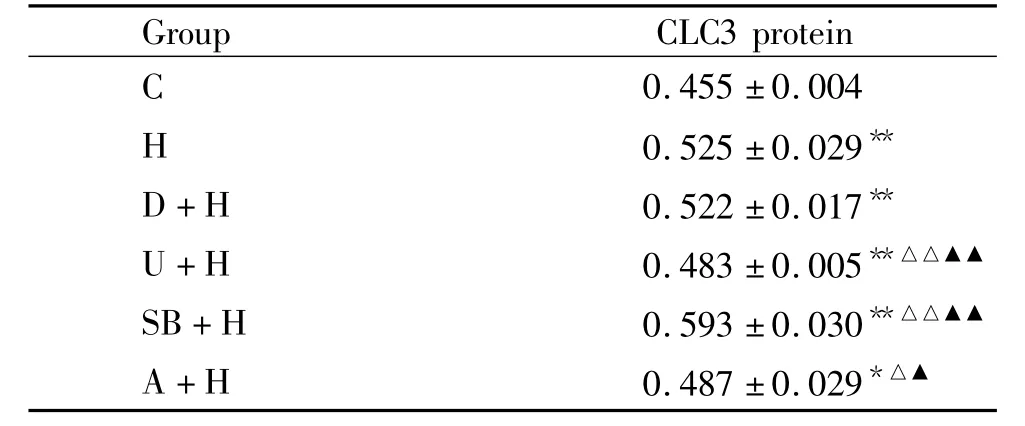
表26 组PASMCs中CLC3蛋白表达变化的比较Table 2. Changes of CLC3 protein expression in all groups(Mean±SD.n=6)
讨 论
CLC3 在血管平滑肌细胞上有高表达,4,4′-二异氰基芪-2,2′-二磺酸(4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid,DIDS)可通过阻断氯离子通道、抑制内皮素使细胞膜去极化,从而导致的胞浆钙离子浓度升高及血管平滑肌细胞增殖,表明其可能在血管平滑肌细胞的生长调控上发挥重要的作用[7-8]。Voets[9]的研究也发现,CLC3与细胞增殖密切相关,表现在肌细胞增殖分裂过程中持续不断地调节其细胞容量。下调CLC3,肌细胞则停止增殖和分化;抑制CLC3时可有效抑制内皮细胞的增殖。本室先前研究显示,低氧高二氧化碳能够通过不同途径引发PAMSCs收缩、增殖,导致肺血管重塑[10]。本实验又发现,低氧高二氧化碳条件下PAMSCs中CLC3 mRNA和蛋白表达量较常氧条件下明显升高,表明低氧高二氧化碳可上调大鼠PASMCs上CLC3 mRNA和蛋白的表达,其机制可能是低氧高二氧化碳引起PASMCs膜通透性增加和[Ca2+]升高,细胞内[Ca2+]升高激活CLC3,氯离子大量外流,引起细胞膜去极化,继而开放电压依赖性钙通道,使细胞外Ca2+大量内流,细胞内[Ca2+]进一步升高,Ca2+与胞浆内的钙调素结合使肌球蛋白轻链激酶磷酸化,进而引发平滑肌细胞收缩、增殖。
Zhang等[11]认为,ERK1/2 通路和 p38 MAPK 通路之间可能存在某种相互制约关系,抑制p38 MAPK通路的同时可加强ERK1/2通路的激活,导致凋亡的延迟。而p38 MAPK促进凋亡或抑制凋亡与p38 MAPK激活的性质有关,如短期p38 MAPK的激活可引起造血肿瘤细胞KT6分化,长期p38 MAPK的激活则可促进其凋亡;在TNF-α处理的中性粒细胞中,早期 p38 MAPK的激活可延迟凋亡,而晚期 p38 MAPK的激活可加速凋亡[12]。因此,可以认为中、晚期p38 MAPK的高活化状态是一种保护机制,以此来对抗低氧高二氧化碳引起的肺血管壁增殖重塑。本实验显示:使用 SB203580后,PASMCs中 CLC3 mRNA和蛋白表达水平明显上调,显著高于低氧高二氧化碳组;应用U0126后,PASMCs CLC3 mRNA和蛋白表达水平却明显低于低氧高二氧化碳组。这提示p38 MAPK通路抑制剂SB203580可上调大鼠PASMCs CLC3 mRNA和蛋白的表达;ERK1/2通路抑制剂U0126能下调大鼠PASMCs CLC3 mRNA和蛋白的表达。
Anisomycin作为p38 MAPK通路的激活剂能够明显抑制单向或双向混合淋巴细胞反应中T细胞的增殖活性,抑制T细胞表面早期及中期活化标志分子CD69和 CD25的表达[13]。本实验也发现,CLC3 mRNA和蛋白含量在anisomycin干预下,较低氧高二氧化碳组明显降低,表明 anisomycin可下调大鼠PASMCs CLC3 mRNA和蛋白的表达。
综上所述,低氧高二氧化碳可上调大鼠PASMCs中CLC3的表达,可能引发平滑肌细胞增殖;p38 MAPK可能参与了抑制CLC3引起的大鼠PASMCs增殖;ERK1/2可能参与了 CLC3引起的大鼠PASMCs增殖。
[1] Kurusu T,Nishikawa D,Yamazaki Y,et al.Plasma membrane protein OsMCA1 is involved in regulation of hypo-osmotic shock-induced Ca2+influx and modulates generation of reactive oxygen species in cultured rice cells[J].BMC Plant Biol,2012,12:11.
[2] Xiao GN,Guan YY,He H.Effects of Cl-channel blockers on endothelin-1-induced proliferation of rat vascular smooth muscle cells[J].Life Sci,2002,70(19):2233-2241.
[3] Hisadome K,Koyama T,Kimura C,et al.Volume-regulated anion channels serve as an auto/paracrine nucleotide felease pathway in aotric endothelial cells[J].J Gen Physiol,2002,119(6):511-520.
[4] 朱阿楠,王万铁,林丽娜,等.MAPK通路抑制剂对低氧高二氧化碳性肺动脉收缩的影响[J].中国病理生理杂志,2008,24(8):1538-1542.
[5] 李悦梅,冯大明,万载阳,等.组织块法培养大鼠肠系膜小动脉的平滑肌细胞[J].南华大学学报:医学版,2003,31(3):251-253.
[6] 李 丹,张艳华,陈少杰,等.大鼠肾缺血-再灌注后JNK mRNA及蛋白表达的变化及银杏达莫注射液的干预作用[J].中国中西医结合肾病杂志,2011,12(4):303-307.
[7] Duan DD.The ClC-3 chloride channels in cardiovascular disease[J].Acta Pharmacol Sin,2011,32(6):675-684.
[8] Matchkov VV,Secher Dam V,Bødtkjer DM,et al.Transport and function of chloride in vascular smooth muscles[J].J Vasc Res,2013,50(1):69-87.
[9] Voets T.Quantifying and modeling the temperature-dependent gating of TRP channels[J].Rev Physiol Biochem Pharmacol,2012,162:91-119.
[10]朱阿楠,王园园,王淑君,等.ERK通路和三七总皂苷干预在低氧高二氧化碳性肺动脉高压中的作用[J].中国病理生理杂志,2011,27(9):1796-1801.
[11] Zhang YX,Kong CZ.The role of mitogen-activated protein kinase cascades in inhibition of proliferation in human prostate carcinoma cells by raloxifene:an in vitro experiment[J].Zhonghua Yi Xue Za Zhi,2008,88(4):271-275.
[12] Nagata Y,Todokoro K.Requirement of activation of JNK and p38 for environmental stress-induced erythroid differentiation and apoptosis and inhibition of ERK for apoptosis[J].Blood,1999,94(3):853-863.
[13] Hori T,kondo T,Tabuchi Y,et al.Molecular mechanism of aptosis and gene expressions in human lymphoma U937 cells treated with anisomycin[J].Chem Biol Interaet,2008,172(2):125-140.
