异丹叶大黄素下调膀胱癌细胞中细胞周期蛋白D1表达的分子机制研究*
2014-11-08王章桂
方 勇, 王章桂, 侯 琦, 卢 瑜
(1浙江大学医学院附属邵逸夫医院肿瘤内科,浙江杭州310016;2中国医学科学院协和医科大学药物研究所,北京100050;3南京军区杭州疗养院,浙江杭州310007)
从多种中药成份中提取出的寡聚二苯乙烯类化合物(oligostilbenes)具有多种生物学活性,尤其是抗肿瘤活性正引起众多研究者的关注[3-4]。我们的前期研究证实,从植物买麻藤中提取分离的中药单体成分异丹叶大黄素(isorhapontigenin,ISO)可有效抑制膀胱癌细胞的增殖,并可下调细胞周期蛋白D1的表达水平,诱导G0/G1细胞周期阻滞,抑制肿瘤细胞迁移[5]。鉴于ISO下调细胞周期蛋白D1表达水平的分子机制尚不明确,本研究进一步深入地研究其分子机制,现报道如下。
材料和方法
1 材料
ISO由中国医学科学院北京协和医科大学药物研究所侯琦教授提供,分子量为258 D[5]。ISO被溶解在DMSO,储存终浓度为10 mmol/L。并进一步用DMSO稀释,最后DMSO终浓度为0.1%(V/V)进行细胞培养实验。相同浓度的DMSO(0.1%,V/V)被用来作为阴性对照。
抗细胞周期蛋白D1和Sp1(specificity protein 1)抗体购自Santa Cruz。抗c-Jun和GAPDH(glyceraldehyde 3-phosphate dehydrogenase)抗体均购自 Cell Signaling。新生牛血清和DMEM购自Gibco。DMSO购自Sigma。ATP生物发光检测试剂盒购自 Promega。绿色荧光蛋白(green fluorescent protein,GFP)标记的细胞周期蛋白D1表达构建载体来自美国纽约大学医学院Huang Chuanshu实验室[6]。具体为:真核表达载体pEGFP-C3经EcoR I和BamH I双酶切。根据GenBank中人cyclin D1 cDNA序列设计合成以下引物:上游引物5’-GCGAATTCCCATGGAACACCAGCTCCTG-3’,下 游 引物 5’-GCGGATCCTCAGATGTCCACGTCCCGCA-3’。反应条件为95℃预变性90 s,94 ℃ 40 s,62 ℃ 40 s,72 ℃ 40 s,共 35个循环。EcoR I和BamH I双酶切后,以琼脂糖胶回收试剂盒回收酶切产物。以T4连接酶连接pEGFP-C3和上述回收片段。转化感受态大肠杆菌,随机挑选菌落,并经测序鉴定。
细胞周期蛋白D1启动子驱动的萤光素酶报告基因质粒载体来自Anil K.Rustgi博士(美国宾夕法尼亚大学医学院肠胃科)[7]。人源性细胞周期蛋白D1野生型和-163位点突变型萤光素酶报告基因质粒载体(WT-cyclin D1-Luc和Sp1mut cyclin D1-Luc)来自Richard G.Pestell博士(美国托马斯·杰斐逊大学 Kimmel癌症中心)[8]。
2 方法
2.1 细胞培养和基因转染 RT4和RT112膀胱癌细胞均购自ATCC。UMUC3细胞来自美国纽约大学医学院 Huang Chuanshu教授处。RT4、RT112和UMUC3膀胱癌细胞分别在 RPMI-1640、Eagle′s MEM和DMEM培养基中培养。细胞培养基中均含有100 mL/L新生牛血清、1×105U/L青霉素及100 mg/L链霉素的,在37℃、5%CO2条件下培养,每3 d传代1次。
基因转染步骤参照LipofectamineTM试剂盒说明书进行,分别在转染后24、48和72 h于荧光倒置显微镜下观察GFP荧光。转染72 h后,加入嘌呤霉素(puromycin)筛选4周,终浓度5 mg/L。克隆细胞形成后,随机挑选克隆,扩增抗性细胞,荧光显微镜观察细胞内GFP表达荧光。
2.2 膀胱癌细胞中细胞周期蛋白D1的蛋白水平表达检测 采用Western blotting法检测膀胱癌细胞株细胞周期蛋白D1的蛋白水平表达。按照常规进行蛋白质的提取、定量和分离[5,9]。转膜后先后与10 g/L脱脂奶粉、鼠或兔抗人抗体(细胞周期蛋白D1、c-Jun和GADPH)I抗4℃孵育过夜,过氧化物酶偶联的II抗孵育,运用ECL Western blotting Kit显色并扫描实验结果。
2.3 UMUC3细胞的细胞周期蛋白D1 mRNA水平表达的检测 以ISO预处理膀胱癌细胞(约1×106细胞)后,收集按 TRIzolTM试剂盒说明书提取总RNA,逆转录反应体系:模板RNA 2 μg,10 mmol/L dNTP 1 μL,RNA 酶抑制剂(RNasin)335 nKat,Oligo dT181 μL,AMV 逆转录酶1 μL,5 ×逆转录酶缓冲液5 μL,终体积为 25 μL。42 ℃水浴30 min,采用NCBI的Primer-BLAST软件设计细胞周期蛋白D1基因的PCR引物(扩增产物大小408 bp),序列如下:上游引物 5’-GAGGTCTGCGAGGAACAGAAGTG-3’,下游引物 5’-GAGGGCGGATTGGAAATGAACTTC-3’。同时以GADPH作为内参照(扩增产物大小258 bp),上游引物 5’-AGAAGGCTGGGGCTCATTTG-3’,下 游 引 物 5 ’-AGGGGCCATCCACAGTCTTC-3 ’[9]。PCR产物经2%琼脂糖凝胶电泳,MGIAS-1000凝胶成像系统扫描定量并拍照。
待到中午下班后,杨力生在室内检查了一下员工们的工作情况,检查完毕,员工们早已走尽。他走出门外,正准备开车回家,却见杨秋香独自站在大门口的一棵银杏树下,她一见到杨力生便含羞地低下头来。杨力生赶忙走到她近前,心情激动地问道:
2.4 PI染色法和流式细胞术检测细胞周期 以ISO预处理膀胱癌细胞(约1×106细胞)后,胰酶消化并收集细胞,70%乙醇固定,4℃保存。600×g离心5 min,并用 PBS液(含有0.5%BSA和0.1%Triton X-100)洗2次。加入PI染色液避光保存30 min后,用流式细胞仪(Beckman Coulter)检测细胞周期DNA含量和凋亡细胞百分数。
2.5 贴壁依赖性细胞生长实验 在6孔培养板内,制备含0.5%软琼脂、10%胎牛血清、不同浓度ISO底层的Basal Medium Eagle(BME)培养基底层。静置4 h凝固后,1×104UMUC3细胞混悬于含10%胎牛血清、0.33%软琼脂培养基和不同浓度ISO的BME培养基,凝固后,6孔板被保持在37℃、5%CO2培养箱中培养21 d后,显微镜下计数细胞集落数超过32个的细胞克隆数,观察菌落及镜下计数。每个浓度分别进行3次独立的实验[9]。
2.6 萤光素酶报告基因分析 稳定转染GFP标记的细胞周期蛋白D1表达构建载体、Sp1mut-cyclin D1-Luc和WT-cyclin D1-Luc报告基因质粒载体至UMUC3膀胱癌细胞,经筛选鉴定后,接种到96孔板(1×104cells/well),当细胞密度达到80% ~90%,给予ISO预处理后,在相对应的时间收集细胞,加入细胞裂解液[25 mmol/L Tris-磷酸(pH 7.8)、2 mmol/L EDTA、1%Triton X-100和10%甘油],使用萤光素酶检测系统(Promega)和微孔板光度计(Berthold LB 96V)检测细胞的萤光素酶活性。每个浓度分别进行3 次独立的实验[10]。
2.7 核蛋白提取及Western blotting法检测核转录因子 UMUC3细胞接种于10 cm培养皿中,ISO预处理12 h后,以核/细胞质分离试剂盒(BioVision)所提供的试剂说明书进行操作,提取细胞的核蛋白和胞浆蛋白,并进行定量,在-80℃冰箱内保存。按照Western blotting法,每孔分别上样40 μg胞浆蛋白和核蛋白,检测核转录因子变化情况。
2.8 染色质免疫沉淀(chromatin immunoprecipitation,ChIP) 根据ChIP试剂盒(Millipore)提供的说明书进行操作。即UMUC3细胞以DMSO处理或ISO(5 μmol/L)预处理12 h后,对细胞的基因组DNA和蛋白质进行分离。针对人源性细胞周期蛋白D1启动子的Sp1结合区域,采用PCR扩增引物[上游引物5’-TTCTCTGCCCGGCTTTGATCTC-3′(从 -92 到-73),下游引物 5’-CTCTCTGCTACTGCGCCAACA-3’(从+7到+27)]进行扩增。扩增后的PCR产物经2%琼脂糖凝胶电泳,用溴化乙啶染色,并进行紫外光扫描[9]。
3 统计学处理
数据以均数±标准差(mean±SD)表示。对各组之间采用t检验或方差分析,SPSS 13.0统计学软件分析,以P<0.05为差异有统计学意义。
结 果
1 ISO可显著抑制多种膀胱癌细胞内的细胞周期蛋白D1的表达
将UMUC3、RT112和RT4细胞与不同剂量(0~20 μmol/L)ISO培养24 h后,收集膀胱癌细胞的蛋白质,经 Western blotting检测均可见,5、10和 20 μmol/L ISO呈剂量依赖性地抑制细胞周期蛋白D1的表达(P<0.01),见图1。由于UMUC3膀胱癌细胞株有较强的转移倾向,并且高表达细胞周期蛋白D1,所以选定该细胞株进行后续的实验。

Figure 1.ISO inhibited cyclin D1 protein expression in different human bladder cancer cells.Cyclin D1 protein expression was determined by Western blotting after the cells were treated with the indicated concentrations of ISO for 24 h.图1 ISO可显著抑制多种膀胱癌细胞内细胞周期蛋白D1的表达
2 ISO可下调膀胱癌细胞细胞周期蛋白D1基因转录水平和Sp1核转录因子水平
如图2A所示,不同剂量(0~20 μmol/L)ISO作用24 h可显著下调UMUC3细胞细胞周期蛋白D1 mRNA的表达。以上结果表明,ISO预处理可在转录水平或mRNA的稳定性水平抑制细胞周期蛋白D1的表达。为此,将细胞周期蛋白D1启动子驱动的萤光素酶报告基因稳定转染到UMUC3细胞,检测ISO对细胞周期蛋白D1转录活性的影响。如图2B所示,ISO可呈时间依赖性地抑制UMUC3细胞中细胞周期蛋白D1启动子的转录活性。
接着,我们使用TRANSFAC®转录因子结合位点软件(7.0版),对细胞周期蛋白D1的启动子区域进行分析,检索参与调控的核转录因子。结果表明,人类细胞周期蛋白D1基因的启动子区域包含多个潜在的转录因子DNA结合位点,主要包括激活蛋白1、热休克转录因子 1、激活转录因子 2、NF-κB 和Sp1。如图2C所示,ISO(5 μmol/L)预处理 UMUC3膀胱癌细胞后,分别收集核蛋白和胞浆蛋白,经Western blotting检测均可见分子量为106 kD的Sp1核转录因子受到显著抑制,而其它核转录因子如c-Jun等无显著改变。

Figure 2.ISO down-regulated cyclin D1 transcription and Sp1 protein expression.A:total RNA isolated from the UMUC3 cells treated with the indicated concentrations of ISO for 24 h was subjected to RT-PCR for determination of cyclin D1 mRNA expression level,and GAPDH was used as a loading control;B:UMUC3 stably transfected with cyclin D1 promoter-driven luciferase reporter was treated with ISO(5 μmol/L)for the indicated time to determine the inhibitory effect of ISO on cyclin D1 promoter transcriptional activity;C:cytoplasmic and nuclear extracts were isolated from the UMUC3 cells treated with either 0.1%DMSO or 5 μmol/L ISO for 12 h and were subjected to Western blotting,with the specific antibodies as indicated.GAPDH was used as protein loading control.Mean±SD.n=3.*P <0.05 vs 0 h.图2 ISO可下调UMUC3膀胱癌细胞周期蛋白D1的转录水平和核转录因子Sp1水平
3 ISO不影响外源性GFP-细胞周期蛋白D1表达
分别稳定转染GFP以及GFP-细胞周期蛋白D1到膀胱癌UMUC3细胞,经筛选鉴定后,进一步检测ISO对内源性和外源性细胞周期蛋白D1的表达、肿瘤细胞增殖和细胞周期的影响。如图3A所示,因GFP-细胞周期蛋白D1不含内源性启动子,ISO预处理后,可显著下调内源性细胞周期蛋白D1的表达,而不影响外源性GFP-细胞周期蛋白D1表达。进一步通过贴壁依赖性生长实验检测(图3B、C),证实ISO可显著抑制稳定转染GFP的UMUC3细胞的增殖,但对稳定转染GFP-细胞周期蛋白D1的UMUC3细胞的增殖影响较小。通过流式细胞术检测,10 μmol/L ISO可诱导稳定转染GFP的UMUC3细胞出现G0/G1细胞周期阻滞(65.59%±2.52% vs 83.81% ±3.48%),而对稳定转染GFP-细胞周期蛋白D1的UMUC3细胞的G0/G1细胞周期影响较小(55.52% ±3.24%vs 59.49% ±3.76%),见图3D。这些结果表明,ISO可通过调控内源性转录水平来下调细胞周期蛋白D1的表达,从而抑制膀胱癌细胞的生长能力,并诱导癌细胞G0/G1期阻滞。
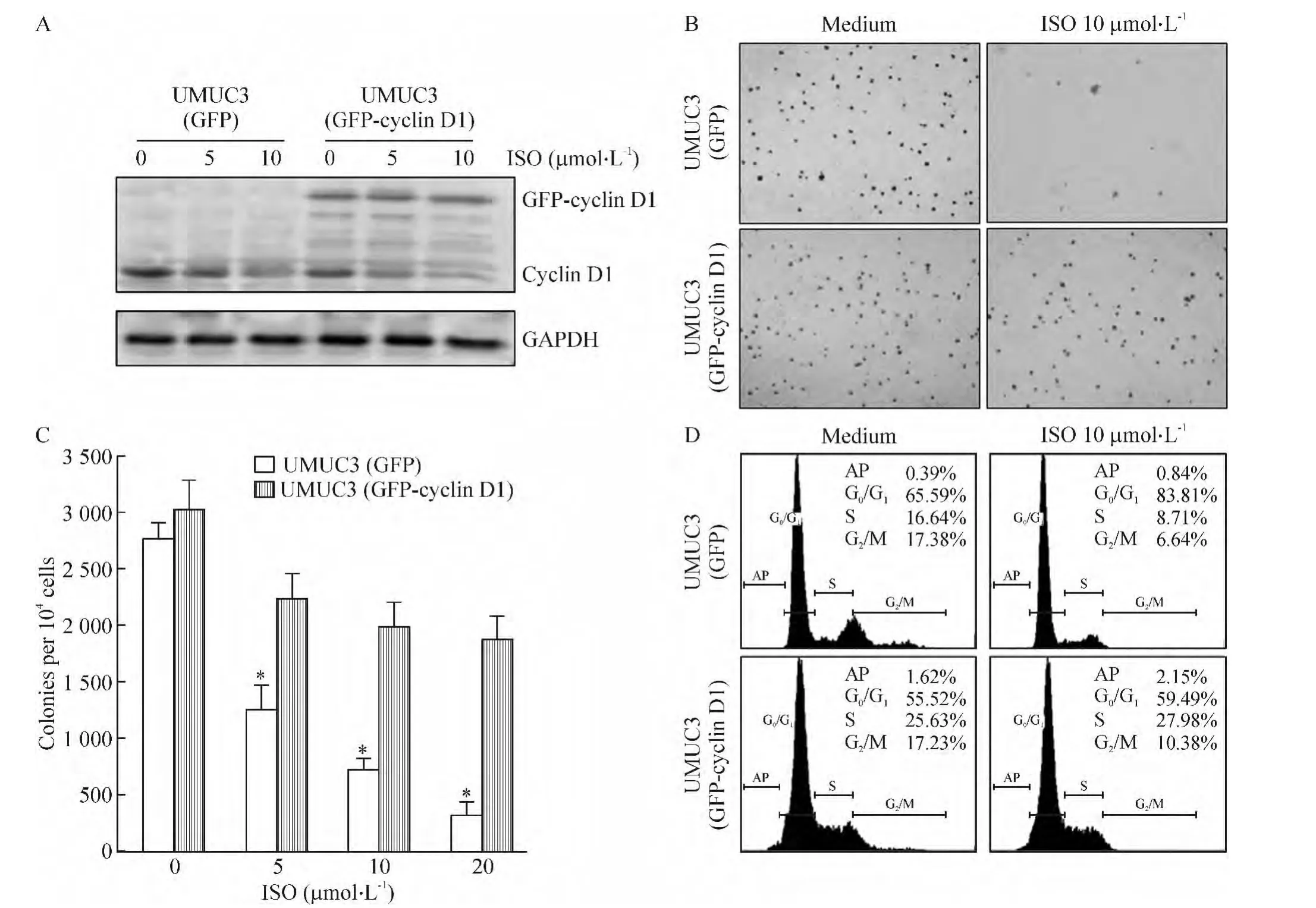
Figure 3.Exogenous expression of GFP-cyclin D1 was not inhibited by ISO and was able to reverse ISO-mediated inhibition of anchorage-independent growth of UMUC3 cells.A:UMUC3 stable transfectants,as indicated,were treated with ISO for 24 h,and the cells were extracted for detection of cyclin D1 protein expressions by Western blotting;B,C:UMUC3 stable transfectants were subjected to anchorage-independent growth assay as indicated in soft agar in the absence or presence of 10 μmol/L of ISO;D:UMUC3 stable transfectants,as indicated,were subjected to cell cycle analysis using flow cytometry after pretreatment with ISO for 48 h.Mean±SD.n=3.*P <0.05 vs 0 μmol/L.图3 外源性GFP-细胞周期蛋白D1稳定转染UMUC3细胞后,ISO不能下调外源性细胞周期蛋白D1的表达水平,也不能抑制ISO所介导的细胞增殖
4 ISO通过抑制核转录因子Sp1与细胞周期蛋白D1的启动子结合,从内源性转录水平来抑制细胞周期D1的表达
图4 A显示细胞周期蛋白D1启动子区与转录因子Sp1结合位点示意图。Marampon等[8]证实,删除了细胞周期蛋白D1的-163到-22启动子序列,将显著降低细胞周期蛋白D1启动子活性。为进一步研究ISO所调控的细胞周期蛋白D1的启动子序列,我们将WT-cyclin D1-Luc和Sp1mut-cyclin D1-Luc分别与pSUPER质粒共转染UMUC3细胞,筛选并建立UMUC3/WT-cyclin D1-Luc和UMUC3/Sp1mut-cyclin D1-Luc细胞系,以ISO(5 μmol/L)处理UMUC3膀胱癌细胞6 h、12 h和24 h后,检测UMUC3细胞中细胞周期蛋白 D1启动子活性。如图4B所示,UMUC3/Sp1mut-cyclin D1-Luc细胞系的细胞周期蛋白D1启动子活性明显低于UMUC3/WT-cyclin D1-Luc的启动子活性(P<0.01)。这一结果证实ISO通过特异性抑制核转录因子Sp1及相应的转录功能来下调细胞周期蛋白D1的转录。
Marampon等[8]亦证实,Sp1 调控人细胞周期蛋白D1表达的作用位点主要位于细胞周期蛋白D1启动子-92到+27 bp的5′-非翻译区。为了进一步检测ISO对核转录因子Sp1与细胞周期蛋白D1启动子特异性结合的影响,我们以ISO(5 mol/L)处理UMUC3细胞12 h,采用ChIP法收集DNA,使用针对细胞周期蛋白D1启动子-92到+27 bp区域的PCR引物进行扩增。如图4C所示,ISO(5 mol/L)可特异性抑制Sp1与细胞周期蛋白D1启动子-92到+27 bp区域的结合。根据上述结果,ISO的作用机制可总结如下:ISO可抑制并下调核转录因子Sp1的表达,并通过抑制Sp1与细胞周期蛋白D1启动子-92到+27 bp的5′-非翻译区结合,下调细胞周期蛋白D1的转录水平,从而诱导肿瘤细胞G0/G1期阻滞,抑制肿瘤细胞增殖,见图4D。
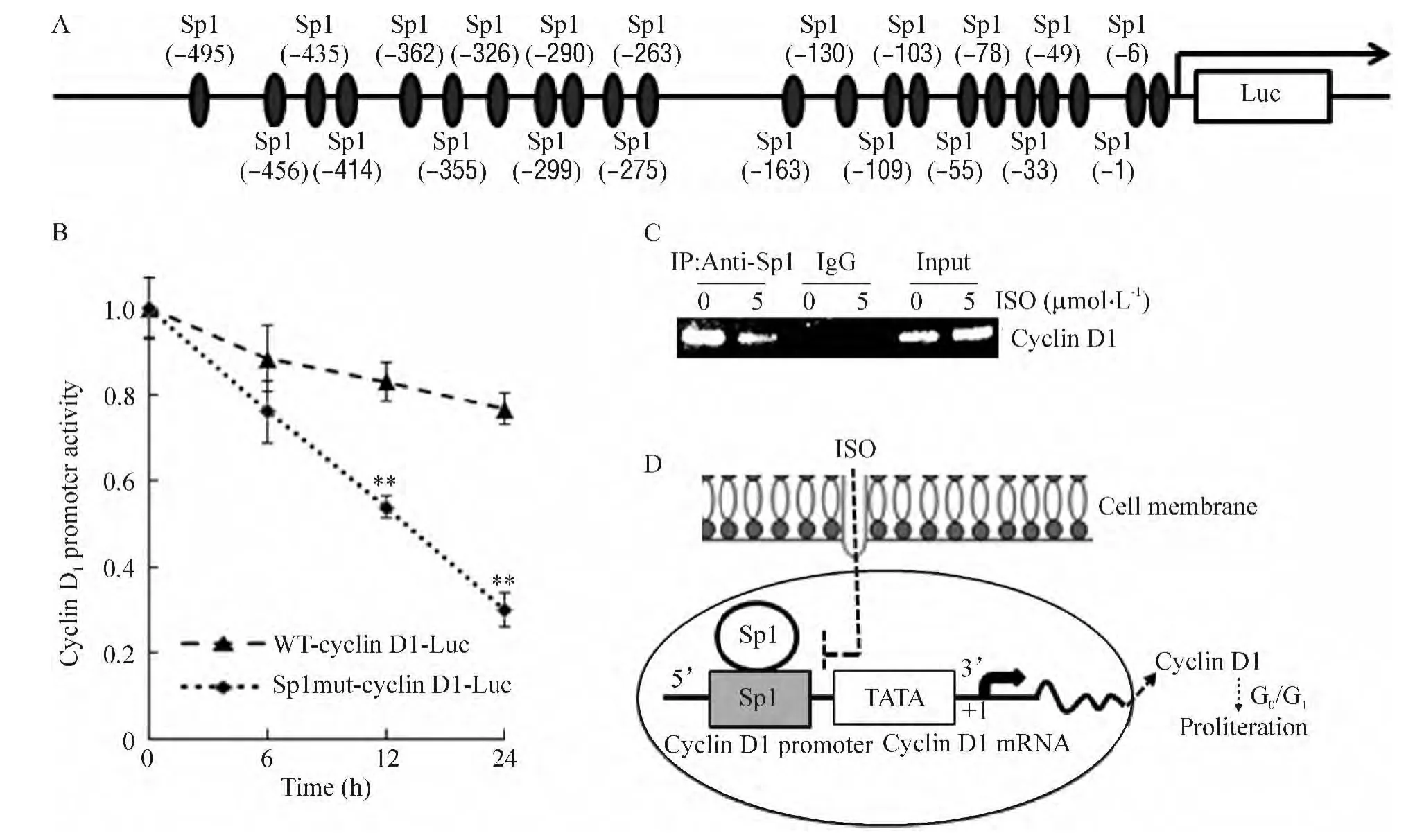
Figure 4.Sp1 was a major target of ISO for its inhibitory effect on cyclin D1 transcription.A:schematic diagram of transcription factor Sp1-binding sites in human cyclin D1 promoter region;B:wild-type cyclin D1 luciferase reporter(WT-cyclin D1-Luc)or its mutant at one of the Sp1-binding sites(-163)in cyclin D1 promoter region(Sp1mut-cyclin D1-Luc)was cotransfected with pSUPER plasmid into UMUC3 cells,and the stable transfectants were exposed to ISO(5 μmol/L)for determination of cyclin D1 promoter activity;C:ChIP assay was used to analyze the effect of ISO on Sp1 binding activity to cyclin D1 promoter region;D:the proposed model of ISO regulating cyclin D1 expression in human bladder cancer cells.Mean±SD.n=3.**P <0.01 vs WT-cyclin D1-Luc.图5 ISO通过抑制核转录因子Sp1蛋白与细胞周期蛋白D1启动子的结合来抑制其内源性转录水平
讨 论
泌尿系统来源的膀胱上皮肿瘤是我国最常见的泌尿系统恶性肿瘤,晚期患者的治疗效果仍不理想[1,11-12]。既往的一些研究表明,ISO可通过对氧化型低密度脂蛋白的抑制作用(OxLDL)来抑制牛主动脉平滑肌细胞的有丝分裂增殖[13],并且具备抗氧化和抗心血管炎症反应[14]。但ISO抗肿瘤的作用机制研究接近于空白。我们新近的研究结果证实,当ISO浓度超过20 μmol/L时可通过下调膀胱癌细胞的X染色体连锁凋亡抑制蛋白水平,诱导肿瘤细胞凋亡并抑制肿瘤细胞增殖[9]。ISO浓度低于20 μmol/L时,虽然没有显示出明显的细胞毒作用,但却可下调细胞周期蛋白D1表达,抑制膀胱癌细胞增殖[5]。其具体分子机制不明。通过开展本研究,将进一步深入了解中药买麻藤属及其分离出的单体ISO的抗癌活性的分子机制。
细胞周期蛋白D1为细胞内主要的癌基因之一,又称 PRAD1、CCND1或 BCL-1,它位于 11q13,长约15 kb,含5个外显子,4个内含子,编码的蛋白含295个氨基酸残基,分子量37 kD[15]。在恶性肿瘤的形成过程中,细胞周期蛋白D1比细胞周期蛋白D2和D3更加重要[16]。多个研究证据表明,在包括致癌物质在内的各种促进细胞炎症增殖反应、诱导细胞突变的过程中,可首先引起细胞周期蛋白的改变。其中细胞周期蛋白D1的过度表达是恶性肿瘤过度增殖的主要原因;在包括膀胱癌、乳腺癌、子宫颈癌、结肠癌、前列腺癌和皮肤癌等多种常见肿瘤,均可检测到细胞周期蛋白D1的过度表达[17]。因此,细胞周期蛋白D1是一种最常见的肿瘤细胞的细胞周期调节蛋白,是一个潜在的治疗靶点[18]。
本系列研究证实,ISO在浓度为5 μmol/L水平,就可在转录水平下调细胞周期蛋白D1的表达,并诱导肿瘤细胞的G0/G1期阻滞,并可抑制膀胱癌细胞的增殖,但并不影响其细胞活力或其它细胞周期调控蛋白的表达,包括细胞周期蛋白A、细胞周期蛋白B、细胞周期蛋白 E、CDK4 和 CDK6[5]。这些结果表明ISO可作为一种潜在的、以细胞周期蛋白D1为靶点的药物用于预防和治疗肿瘤;并对多种异常高表达细胞周期蛋白D1的肿瘤患者,尝试采用ISO治疗具备相应的临床基础。
研究证实,可以在转录和转录后水平来调控细胞周期蛋白D1的表达水平[19]。通过本试验的一系列研究,证实ISO可通过转录水平对细胞周期蛋白D1进行调控。至目前为止,已被报道调节细胞周期蛋白 D1转录水平的核转录因子包括 NF-κB[20]、Sp1[21]、Ras/MAPK/Akt/ERK1/2[22]、PI3K/Akt[23,24]和 GSK-3β/β-catenin[25]。Sp1 是一个重要的核转录因子,可直接与启动子结合来参与包括细胞周期蛋白D1在内的多种基因的表达和细胞功能的调节[26]。本研究证实,ISO可抑制并下调核转录因子Sp1的表达,并介导抑制Sp1与细胞周期蛋白D1启动子区域结合,该结合位点主要位于启动子的-92和+27 bp的5’-非翻译区。通过下调细胞周期蛋白D1的转录水平,ISO可进一步诱导肿瘤细胞G0/G1期阻滞并抑制其增殖。细胞周期蛋白D1是肿瘤细胞周期调控及药物治疗中潜在的治疗靶点。因此,本研究将对ISO用于预防和治疗高表达细胞周期蛋白D1的多种人类肿瘤奠定理论基础。同时,本研究也将为治疗膀胱癌和其它肿瘤提供新的思路和治疗策略,为进一步研究细胞周期蛋白D1基因在参与实体肿瘤细胞迁移、肿瘤细胞G0/G1周期调控中的作用提供了新的思路和策略。
本研究还有不足之处。如对PCR结果没有采用real-time PCR检测;ISO可在内源性转录水平下调细胞周期蛋白D1表达,尚需进一步地通过动物的体内实验去证实;本文通过ChIP实验证实ISO可特异性抑制Sp1与细胞周期蛋白D1启动子区域(-92到+27 bp)的结合,还需要其它实验如凝胶电泳迁移率实验(EMSA)来证实。另外,ISO未对细胞内其它细胞周期调控蛋白如CDK产生影响,但对其它信号转导途径如JNK/c-Jun、JAK/STAT等是否产生影响,有待下一步研究。
[1] Shariat SF,Ashfaq R,Sagalowsky AI,et al.Correlation of cyclin D1 and E1 expression with bladder cancer presence,invasion,progression,and metastasis [J].Hum Pathol,2006,37(12):1568-1576.
[2] Yuan L,Gu X,Shao J,et al.Cyclin D1 G870A polymorphism is associated with risk and clinicopathologic characteristics of bladder cancer[J].DNA Cell Biol,2010,29(10):611-617.
[3] Yamada M,Hayashi K,Ikeda S,et al.Inhibitory activity of plant stilbene oligomers against DNA topoisomerase II[J].Biol Pharm Bull,2006,29(7):1504-1507.
[4] Hagiwara K,Kosaka N,Yoshioka Y,et al.Stilbene derivatives promote Ago2-dependent tumour-suppressive microRNA activity[J].Sci Rep,2012,2:314.
[5] 方 勇,侯 琦,卢 瑜.异丹叶大黄素下调膀胱癌细胞的细胞周期蛋白D1表达并诱导G0/G1细胞周期阻滞[J].中国病理生理杂志,2013,29(3):442-448.
[6] Zhang J,Ouyang W,Li J,et al.Suberoylanilide hydroxamic acid(SAHA)inhibits EGF-induced cell transformation via reduction of cyclin D1 mRNA stability[J].Toxicol Appl Pharmacol,2012,263(2):218-224.
[7] Jenkins TD,Mueller A,Odze R,et al.Cyclin D1 overexpression combined with N-nitrosomethylbenzylamine increases dysplasia and cellular proliferation in murine esophageal squamous epithelium [J].Oncogene,1999,18(1):59-66.
[8] Marampon F,Casimiro MC,Fu M,et al.Nerve growth factor regulation of cyclin D1 in PC12 cells through a p21RASextracellular signal-regulated kinase pathway requires cooperative interactions between Sp1 and nuclear factor-kappaB [J].Mol Biol Cell,2008,19(6):2566-2578.
[9] Fang Y,Yu Y,Hou Q,et al.The Chinese herb isolate isorhapontigenin induces apoptosis in human cancer cells by down-regulating overexpression of antiapoptotic protein XIAP[J].J Biol Chem,2012,287(42):35234-35243.
[10]Fang Y,Cao Z,Hou Q,et al.Cyclin D1 downregulation contributes to anticancer effect of isorhapontigenin on human bladder cancer cells[J].Mol Cancer Ther,2013,12(8):1492-1503.
[11] Kaufman DS,Shipley WU,Feldman AS.Bladder cancer[J].Lancet,2009,374(9685):239-249.
[12] Gerullis H,Ecke TH,Janusch B,et al.Long-term re-sponse in advanced bladder cancer involving the use of temsirolimus and vinflunine after platin resistance[J].Anticancer Drugs,2011,22(9):940-943.
[13] Liu Y,Liu G.Isorhapontigenin and resveratrol suppress oxLDL-induced proliferation and activation of ERK1/2 mitogen-activated protein kinases of bovine aortic smooth muscle cells [J].Biochem Pharmacol,2004,67(4):777-785.
[14] Li HL,Wang AB,Huang Y,et al.Isorhapontigenin,a new resveratrol analog,attenuates cardiac hypertrophy via blocking signaling transduction pathways[J].Free Radic Biol Med,2005,38(2):243-257.
[15] Heighway J.HaeIII polymorphism within 3′untranslated region of PRAD1 [J].Nucleic Acids Res,1991,19(19):5451.
[16]Takaba K,Saeki K,Suzuki K,et al.Significant overexpression of metallothionein and cyclin D1 and apoptosis in the early process of rat urinary bladder carcinogenesis induced by treatment with N-butyl-N-(4-hydroxybutyl)nitrosamine or sodium L-ascorbate [J].Carcinogenesis,2000,21(4):691-700.
[17] Kim JK,Diehl JA.Nuclear cyclin D1:an oncogenic driver in human cancer[J].J Cell Physiol,2009,220(2):292-296.
[18] Lehn S,Tobin NP,Berglund P,et al.Down-regulation of the oncogene cyclin D1 increases migratory capacity in breast cancer and is linked to unfavorable prognostic features[J].Am J Pathol,2010,177(6):2886-2897.
[19] Musgrove EA.Cyclins:roles in mitogenic signaling and oncogenic transformation [J].Growth Factors,2006,24(1):13-19.
[20]Klein EA,Yang C,Kazanietz MG,et al.NFkappaB-independent signaling to the cyclin D1 gene by Rac[J].Cell Cycle,2007,6(9):1115-1121.
[21] Bartusel T,Schubert S,Klempnauer KH.Regulation of the cyclin D1 and cyclin A1 promoters by B-Myb is mediated by Sp1 binding sites[J].Gene,2005,351:171-180.
[22] Liu Y,Hock JM,Sullivan C,et al.Activation of the p38 MAPK/Akt/ERK1/2 signal pathways is required for the protein stabilization of CDC6 and cyclin D1 in low-dose arsenite-induced cell proliferation [J].J Cell Biochem,2010,111(6):1546-1555.
[23]Ouyang W,Luo W,Zhang D,et al.PI-3K/Akt pathwaydependent cyclin D1 expression is responsible for arseniteinduced human keratinocyte transformation[J].Environ Health Perspect,2008,116(1):1-6.
[24] Vartanian R,Masri J,Martin J,et al.AP-1 regulates cyclin D1 and c-MYC transcription in an AKT-dependent manner in response to mTOR inhibition:role of AIP4/Itch-mediated JUNB degradation [J].Mol Cancer Res,2011,9(1):115-130.
[25] D′Amico M,Hulit J,Amanatullah DF,et al.The integrinlinked kinase regulates the cyclin D1 gene through glycogen synthase kinase 3beta and cAMP-responsive elementbinding protein-dependent pathways[J].J Biol Chem,2000,275(42):32649-32657.
[26] Seznec J,Silkenstedt B,Naumann U.Therapeutic effects of the Sp1 inhibitor mithramycin A in glioblastoma[J].J Neurooncol,2011,101(3):365-377.
