IL-24基因重组腺病毒载体转染的树突状细胞促进宫颈癌CaSki细胞凋亡*
2014-11-08潘巍巍曹利仙沈忠飞易发平宋方洲
潘巍巍, 曹利仙, 徐 营, 沈忠飞, 易发平, 宋方洲
(1嘉兴学院医学院生物教研室,浙江嘉兴314001;2重庆医科大学生物化学与分子生物学教研室,重庆400016)
子宫颈癌是危害广大妇女健康最常见的恶性肿瘤之一,近年来发病率明显升高,仅次于乳腺癌而位居第2位,且呈现年轻化和病变进展快的趋势。因此,研究预防治疗宫颈癌的方法已成为人们关注的热点[1-2]。研究表明,人乳头瘤病毒(human papillomavirus,HPV)与宫颈癌的发病密切相关[3-4]。白细胞介素24(interleukin-24或melanoma differentiation associated gene-7,IL-24/Mda-7)是由Jiang等于1995年用干扰素 β(interferon β,IFN-β)和密执毒素(mezerein,MEZ)诱导黑素瘤细胞终末分化时,利用消减杂交克隆得到,其后鉴定为IL-10家族的新成员,感染重组腺病毒并表达IL-24的树突状细胞具有较强的肿瘤抑制作用[5-7]。树突状细胞(dendritic cells,DCs)由Steinman等于1973年首先发现,因其成熟时具有特殊的树突状外型而得名[8-9]。研究表明,树突状细胞可广泛分布于动物除脑、睾丸以外的所有器官、组织,但含量极少。树突状细胞是机体中功能最强的专职抗原递呈细胞,既能直接激活初始型T淋巴细胞,启动早期特异性免疫应答,又能诱导免疫耐受,已成为免疫学及相关领域的研究热点。本研究以IL-24重组腺病毒(Ad-IL-24)感染小鼠未成熟DCs,制备DCs疫苗,观察其在体内、外产生的特异性抗宫颈癌细胞的免疫效应,为宫颈癌的肿瘤生物治疗提供实验依据。
材料和方法
1 材料
1.1 主要试剂 Pme I和Pac I限制性内切酶购自NEB。LipofectamineTM2000脂质体转染试剂盒购自Invitrogen。DL500 DNA marker、DL2000 DNA marker、质粒提取试剂盒、PCR产物回收试剂盒和DNA小量胶回收纯化试剂盒购自Axygen Biosciences。Ultrapure TEMED、小牛血清、DMEM/F12细胞培养基、胰蛋白酶和青链霉素均购自Invitrogen。DMSO购自Sigma。细胞培养板购自康宁公司。PVDE硝酸纤维膜(Roche),蛋白marker(Bio-Rad),DAB显色试剂盒购自中杉金挢公司,M.O.M试剂盒和ABC试剂盒购自Vector Laboratories。IL-24和β-actin抗体购自Santa Cruz。Cleaved caspase-3抗体购自 Cell Signaling。血管生成相关蛋白IV型胶原(collagen IV)抗体购自Abcam。各种Ⅱ抗均购自Jackson Laboratory。PE-Annexin V试剂盒购自BD。
1.2 动物 健康C57BL/6小鼠,SPF级,雌性,4~5周龄,体重(18±2)g,购自重庆医科大学实验动物中心。BALB/c裸鼠(6~8周)购自上海斯莱克。裸鼠以SPF级饲养在重庆医科大学实验动物中心。
1.3 细胞培养 宫颈癌CaSki细胞和HEK293细胞(重庆医科大学提供)以含10%小牛血清DMEM/F12培养基(1×105U/L青霉素、100 mg/L链霉素),在37℃、5%CO2条件下培养。0.25%EDTA胰酶消化细胞,2~3 d传代1次,取对数生长期细胞用于后续实验。
1.4 腺病毒 腺病毒空载体pAd-GFP,带有绿色荧光蛋白(green fluorescent protein,GFP)和IL-24的腺病毒载体pAd-IL-24由重庆医科大学提供。
2 方法
2.1 IL-24基因的重组腺病毒特异性感染DCs 小鼠骨髓未成熟DCs的分离和培养见参考文献[10-11],我们用已获得的带有IL-24基因的腺病毒(Ad-IL-24)[12]感染分离培养第6天的 DCs,2 h后弃去含有病毒的DMEM培养液,更换新鲜的培养液含5 μg/L粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)和重组小鼠白细胞介素4(rmIL-4),培养24 h后荧光显微镜下观察GFP的表达,36 h后收集DCs细胞,提取细胞总蛋白,Western blotting检测IL-24的表达。
2.2 腺病毒感染DCs诱导细胞毒性T淋巴细胞(cytotoxic T-lymphocytes,CTLs)的产生 颈椎脱臼处死C57BL/6小鼠(6~8周龄),无菌取出小鼠脾脏,研磨制成脾细胞悬液,收集细胞加入小鼠淋巴细胞分离液4 mL,800×g离心35 min,取淋巴细胞层,用DMEM/F12完全培养液(10%小牛血清)洗细胞2次,收集非黏附的细胞即为纯化的T细胞。将感染腺病毒后的DCs与T细胞以1∶10混合培养于24孔板,加入对照腺病毒和Ad-IL-24(1×105U/L),收集培养7 d的T细胞作为CTLs效应细胞。
2.3 MTT方法检测腺病毒转染DCs诱导CTLs对CaSki细胞生长的影响 将CTL效应细胞与CaSki细胞1∶10混合培养,培养24 h后用胰酶消化细胞,用培养液轻轻吹打细胞呈单细胞悬液,血细胞计数板计数后,每孔接种3×103个细胞于96孔培养板,同时设空白对照。细胞培养72 h后加入20 μL MTT(5 g/L),4 ~6 h 后加 DMSO(150 μL/well),振荡 10 s,490 nm检测。每组设3个重复,实验重复3次。
2.4 PE-Annexin V染色检测细胞凋亡 将CTL效应细胞与CaSki细胞混合培养(1∶10),培养24 h后用胰酶消化细胞,收集细胞,用预冷1×PBS洗涤2次,1×binding buffer重悬细胞,取105个细胞放置到5 mL离心管中,分别加入5 μL PE-Annexin V和5 μL 7-氨基放线菌素 D(7-aminoactinomycin D,7-AAD)混悬细胞,混匀、室温避光放置10 min,加400 μL 1×binding buffer应用流式细胞仪检测细胞凋亡。
2.5 克隆形成实验 将CTL效应细胞与CaSki细胞混合培养(1∶10),培养24 h后用胰酶消化细胞,用培养液将细胞吹打成单细胞悬液,血细胞计数板计数,每个6 cm培养皿中种1 000个细胞,37℃、5%CO2培养10~14 d,用考马斯亮蓝染色后计算克隆数(细胞数目大于50 cells/colony)。
2.6 Transwell细胞迁移实验 将CTL效应细胞与CaSki细胞混合培养,培养24 h后用胰酶消化细胞,细胞计数,分别在Transwell培养板上室加入100 μL细胞悬液(3×103个)并加入无血清培养基200 μL,下室加入500 μL有血清培养液,37℃、5%CO2培养24 h,取出上室,用冰预冷的甲醇固定30 min,苏木素染色30 s,细胞在高倍镜下(×400)随机取10个视野计数,取平均数。实验重复3次。
2.7 免疫印迹分析 将CTL效应细胞与CaSki细胞混合培养,培养48 h后弃去培养液,用1×PBS将细胞洗涤2次,收集细胞,提取细胞总蛋白,取30 μg总蛋白做 SDS-PAGE,转至 PVDF膜上,5%脱脂奶粉室温封闭1 h,1×TBST洗膜3次,每次5 min,分别与内参照 β-actin抗体(1∶1 000)、cleaved caspase-3抗体(1∶1 000)和 IL-24抗体(1∶1 000)4℃孵育过夜,1×TBST洗膜3次,每次5 min。抗兔的HRP标记的Ⅱ抗(1∶400)室温孵育1 h,洗膜3次,每次5 min,杂交反应后应用ECL Western blotting化学发光试剂盒暗房显影。
2.8 裸鼠荷瘤模型 雌性裸鼠10只SPF级饲养(6~8周龄),将裸鼠分成2组,每组各5只。无菌条件下分别给第1组每只裸鼠的背部皮下注射2×106个(Ad-IL-24-DCs)CaSki细胞和给第2组每只裸鼠背部注射(Ad-CON-DCs)的CaSki细胞,30 d后取出裸鼠皮下肿瘤组织,称重,中性甲醛固定,脱水,石蜡包埋,切片(5 μm)。HE 染色。
2.9 免疫组化和免疫荧光
2.9.1 免疫组化 石蜡切片经二甲苯(3次)、乙醇(3次)脱蜡,每次3 min,水化,3%H2O2避光10 min,0.02 mol/L枸橼酸钠抗原修复,95℃ 15 min,冷却至室温,用M.O.M试剂盒里鼠IgG封闭液室温封闭1 h,用1× PBST洗2次,用M.O.M稀释液孵育5 min,M.O.M 稀释液配 BrdU(I抗,1∶200)室温孵育30 min,1× PBST洗3遍,每次3 min,用M.O.M抗鼠IgG试剂孵片10 min(Ⅱ抗),1×PBST洗3次,每次3 min,ABC试剂盒室温孵育30 min(Ⅲ抗),1× PBST洗3次,每次3 min。DAB显色,终止,逐级脱水,中性树脂封片。
2.9.2 免疫荧光 冰冻切片经PBS洗3次,每次3 min,5%BSA封闭液室温封闭30 min,用含5%BSA的 PBS配 collagen IV(Ⅰ抗,1∶100)室温孵育1 h,1×PBS洗3次,每次3 min,抗兔 Cy3Ⅱ抗,避光室温30 min,1× PBS洗3次,每次3 min,DAPI染色5 min,1× PBS洗3次,每次3 min,甘油封片,荧光显微镜下观察。
3 统计学处理
数据用均数±标准差(mean±SD)表示,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 感染腺病毒的HEK293细胞和DCs
荧光显微镜下观察,感染对照腺病毒(Ad-CON)和感染带有 IL-24腺病毒(Ad-IL-24)的人胚肾HEK293细胞均有明显的GFP表达;空病毒转染的DCs和重组IL-24腺病毒载体转染的 DCs在培养1~2 d后 GFP开始表达,并逐渐增多,见图 1A。Western blotting结果显示,感染Ad-IL-24重组腺病毒组细胞有1条能与IL-24单抗特异性结合的蛋白印迹条带,而对照组无特异性条带,见图1B。
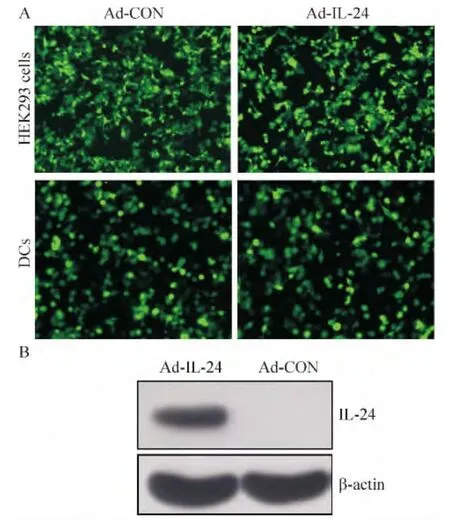
Figure 1.The expression of IL-24 in HEK293 cells and DCs.A:fluorescence microscopy results for GFP expression in HEK293 cells(×100)and DCs(×200)infected with Ad-CON or Ad-IL-24;B:Western blotting results for the expression of IL-24 in DCs.图1 IL-24在HEK293细胞和未成熟树突细胞中的表达
2 Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞增殖
显微镜观察发现,用Ad-IL-24-DCs体外诱导的CTLs处理 CaSki细胞,存活的CaSki细胞数目明显少于用Ad-CON-DCs处理的细胞数,见图2A;MTT检测结果发现,实验组CaSki细胞数目明显减少,存活细胞数目仅为对照组的20%,见图2B。这些结果表明Ad-IL-24-DCs体外诱导的CTLs对 CaSki细胞有明显的杀伤作用。
3 Ad-IL-24-DCs诱导的CTLs促进CaSki细胞凋亡
如图3A、B所示,对照组CaSki细胞凋亡数目为(2.30±0.13)%,而实验组 CaSki细胞凋亡的数目为(14.70±1.26)%。Western blotting检测发现凋亡相关蛋白cleaved caspase-3在实验组CaSki细胞中表达明显增加,见图3C。这些结果表明,Ad-IL-24-DCs诱导的CTLs促进CaSki细胞发生凋亡。
4 Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞克隆形成
如图4所示,对照组CaSki细胞培养10 d以后考马斯亮蓝染色计数发现克隆形成数目为(105.0±12.0)个,而实验组CaSki细胞培养10 d形成的克隆数目仅为(11.0±1.4)个。这一结果表明Ad-IL-24-DCs诱导的CTLs可以抑制CaSki细胞的克隆形成。
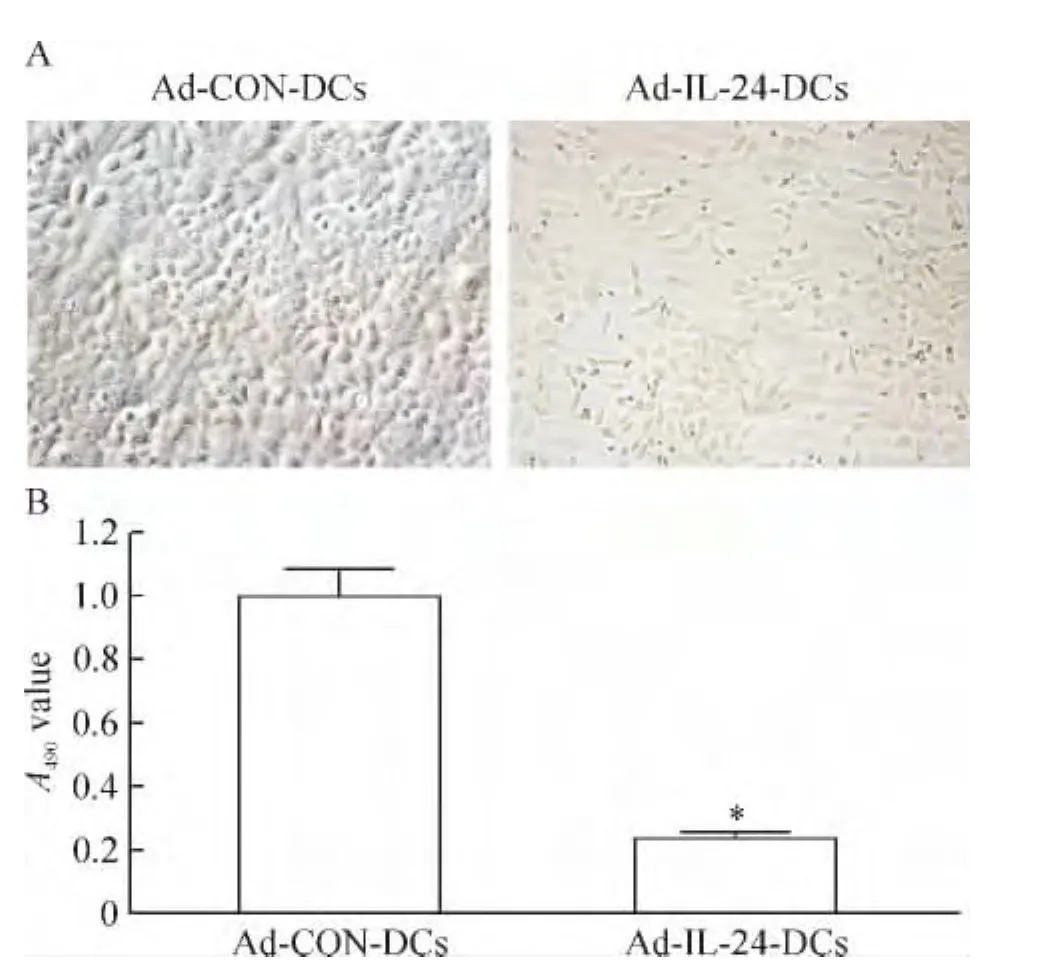
Figure 2.Ad-IL-24-DCs-induced CTLs inhibited CaSki cell proliferation.A:1×105cells were observed in 6-well paltes for 72 h(×200);B:cells were seeded into 96-well plates(3 000 cells/well)for 72 h and then assessed by MTT assay.Mean ± SD.n=3.*P < 0.05 vs Ad-CON-DCs.图2 Ad-IL-24-DCs诱导的CTLs细胞抑制CaSki细胞增殖
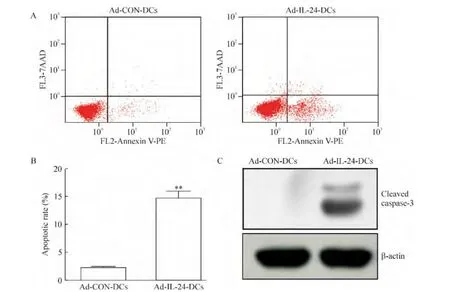
Figure 3.Ad-IL-24-DCs-induced CTLs promoted CaSki cell apoptosis.A:apoptisis of CaSki cells in Ad-CON-DCs and Ad-IL-24-DCs groups were detected by PE-Annexin V;B:quantification of apoptotic cells;C:Western blotting analysis of cleaved caspase-3 protein expression in CaSki cells.Mean ± SD.n=3.**P <0.01 vs Ad-CON-DCs.图3 Ad-IL-24-DCs诱导的效应细胞CTLs促进CaSki凋亡
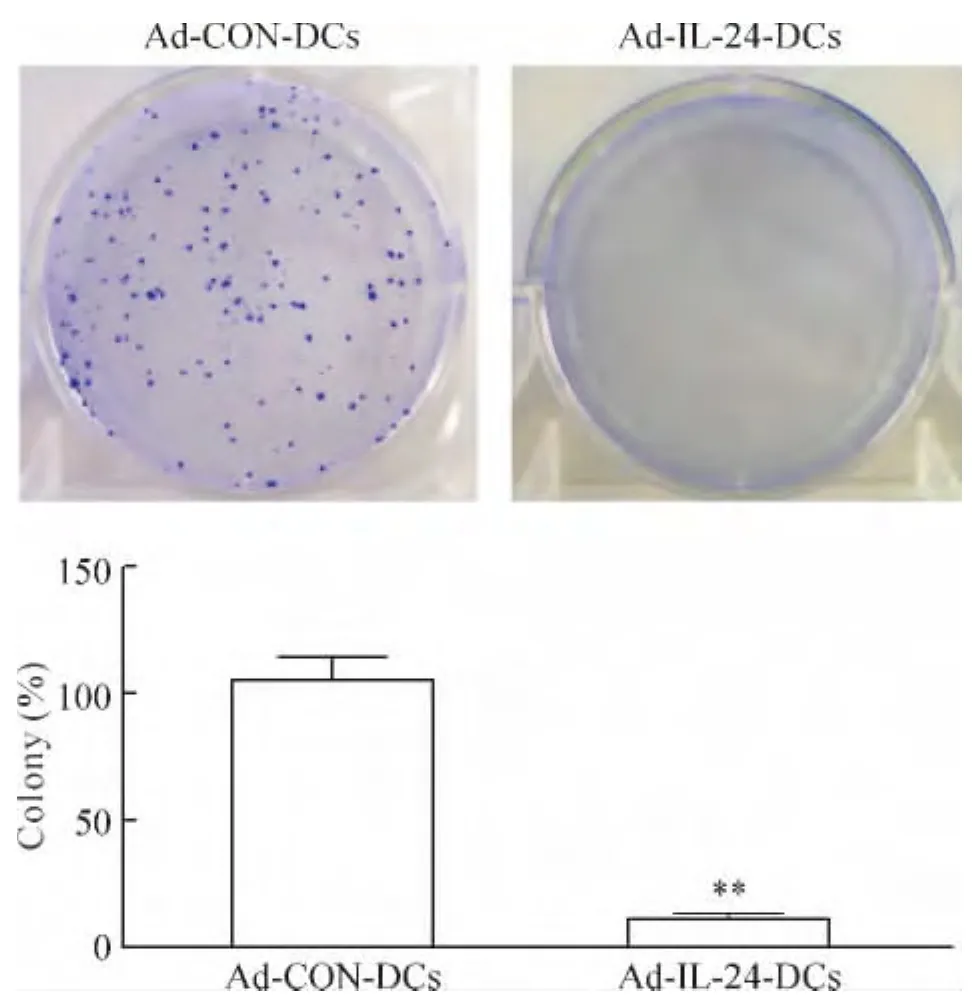
Figure 4.Ad-IL-24-DCs-induced CTLs inhibited CaSki cell colony formation.Colony numbers were counted at day 10 after culture.Mean ± SD.n=3.**P < 0.01 vs Ad-CON-DCs.图4 Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞的克隆形成
5 Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞迁移
如图5所示,对照组CaSki细胞具有较强的迁移能力,而实验组CaSki细胞可抑制其迁移,实验组迁移的细胞为对照组的40%。这表明Ad-IL-24-DCs诱导的CTLs可以抑制肿瘤细胞迁移。
6 裸鼠皮下成瘤实验体内验证Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞增殖
为了在体内进一步验证Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞的增殖,我们分别在不同裸鼠皮下注射对照组和实验组的CaSki细胞,30 d后观察发现注射实验组CaSki细胞的裸鼠皮下肿瘤明显小于对照组,其重量是对照组肿瘤的0.5倍(图6A)。另外,我们取出不同裸鼠的肿瘤组织,中性甲醛固定,包埋、切片,通过HE染色发现对照组肿瘤组织增殖较活跃,细胞核增大,核分裂相增加;免疫组化检测BrdU发现,对照组裸鼠肿瘤组织BrdU表达量较高,而实验组裸鼠肿瘤组织BrdU表达量明显降低;免疫荧光检测肿瘤组织中血管生成相关蛋白collagen IV,发现对照组裸鼠肿瘤组织collagen IV表达量较高,而实验组裸鼠肿瘤组织collagen IV表达量明显降低,见图6B。这表明Ad-IL-24-DCs诱导的CTLs可以抑制CaSki肿瘤组织的增殖和血管生成。
讨 论
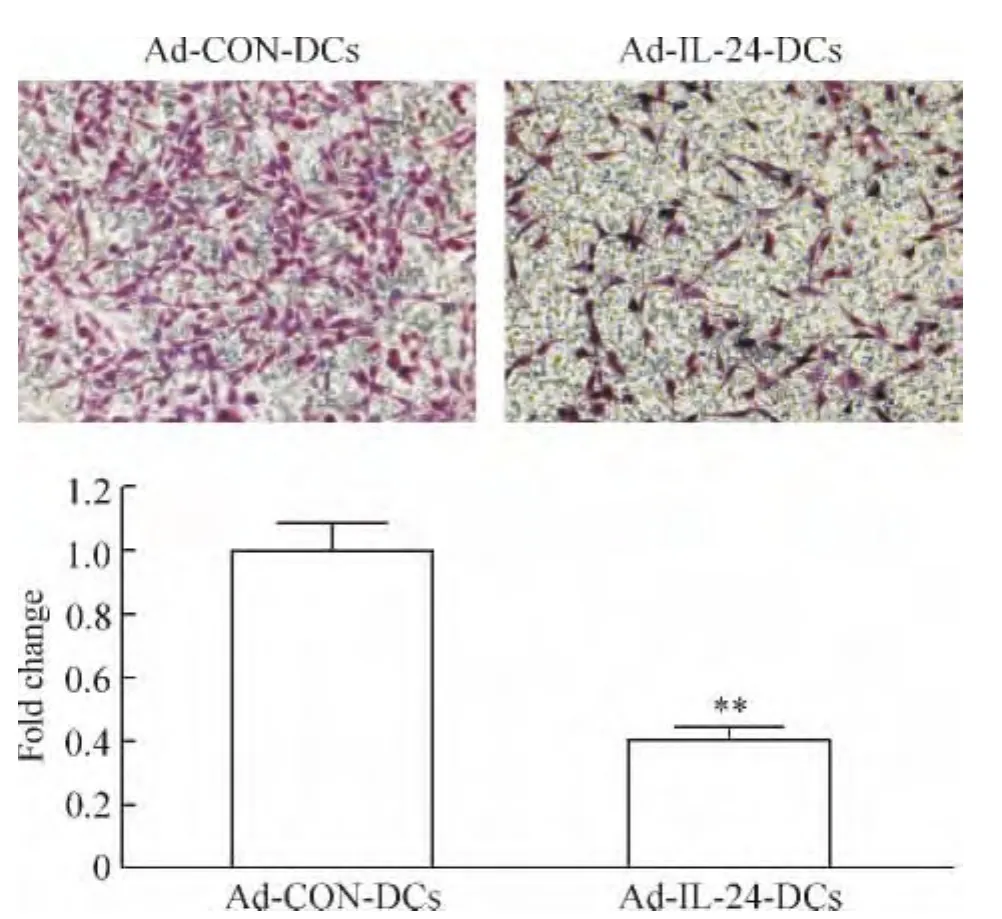
Figure 5.Ad-IL-24-DCs-induced CTLs inhibited CaSki cell migration(crystal violet staining,×200).Mean±SD.n=3.**P <0.01 vs Ad-CON-DCs.图5 Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞的迁移
子宫颈癌是女性生殖系统常见的恶性肿瘤,发病率位于女性肿瘤的第2位。全世界每年大约有20万妇女死于这种疾病,近年来发病率显著上升。全球发病率最高的是南非,其次在亚洲,我国发病率每年新增发病数超过13万,占女性生殖系统恶性肿瘤发病率的73%~93%。IL-24是近年来新发现的细胞因子,具有广谱抗肿瘤活性,对多种组织起源的肿瘤细胞,如:黑素瘤、多形性胶质母细胞瘤、前列腺癌、乳腺癌、卵巢癌、肾癌、结肠癌、直肠癌、子宫内膜癌等均有显著的生长抑制效应和诱导凋亡作用,但对正常细胞无明显毒副作用。而且,它还能在肿瘤组织内促进血管内皮细胞分化从而抑制血管形成[13]。IL-24是一个分泌型细胞因子,可对周围癌细胞产生旁观者杀灭效应,具有刺激免疫系统的功能,还能使某些癌细胞对射线更加敏感[5,15-16]。目前的研究显示,IL-24基因很可能是一个既抑制肿瘤生长又表达刺激免疫系统的蛋白基因,是目前发现的唯一一个细胞因子类的抑癌基因。在多种组织起源的肿瘤细胞中,IL-24的抗肿瘤效应与 p53、Rb、p16、Ras、Bax和caspase-3的突变状态无关,所以对p53失活的子宫颈癌CaSki细胞系特别适用(这些细胞不能被其它肿瘤抑制基因有效杀灭)。
细胞内的许多信号刺激可以诱导细胞发生凋亡,研究表明,细胞凋亡后期的共同途径是caspase的激活。激活caspase的主要途径是各种凋亡诱导因素降低线粒体膜的跨膜电位,导致线粒体膜通透性增加,使细胞凋亡启动子如细胞色素C、凋亡蛋白酶激活因子等从线粒体释放出来,最终激活caspase 3,引起细胞凋亡[17-19]。我们通过多种方法验证感染IL-24的 DCs诱导的CTLs可以促进 CaSki细胞凋亡,Western blotting检测了凋亡相关蛋白 cleaved caspase-3的表达。实验结果显示,感染IL-24的DCs cleaved caspase-3的表达增加,这就表明IL-24感染的DCs诱导的CTLs可以在细胞水平抑制子宫颈癌CaSki的存活。
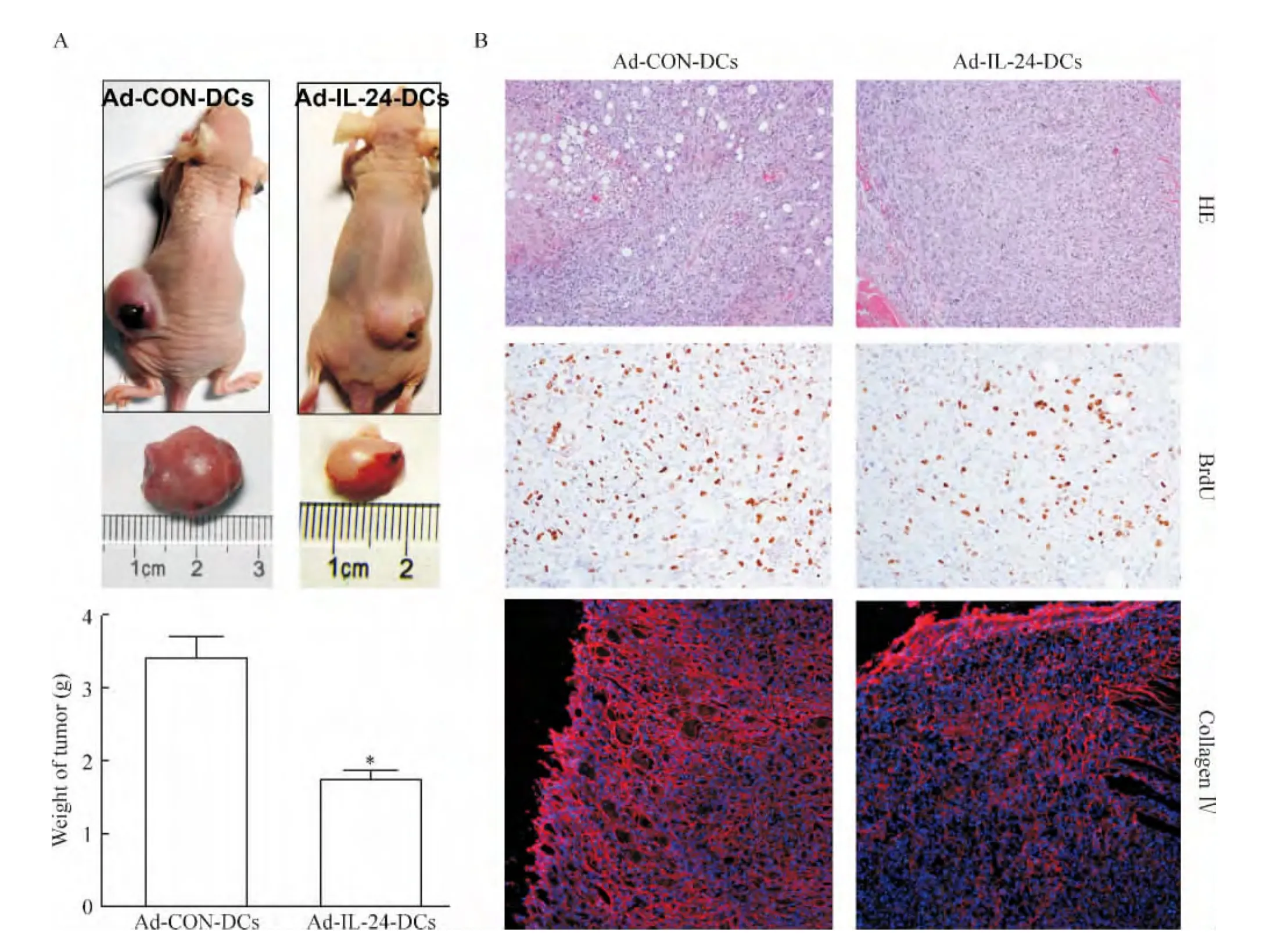
Figure 6.Ad-IL-24-DCs-induced CTLs inhibited CaSki cell proliferation in vivo.A:CaSki cells with Ad-CON-DCs or Ad-IL-24-DCs(1 ×106cells for each)were subcutaneously implanted into the left and right flanks of nude mice.After 30 days,tumors were removed and weighed.Mean ± SD.n=5.*P < 0.05 vs Ad-CON-DCs.B:hematoxylin and eosin(HE)staining for tumor tissues,immunohistochemical staining for BrdU expression and immunofluorescent staining for collagen IV(red)in tumor tissues[counterstained with DAPI(blue),×200].图6 在裸鼠体内Ad-IL-24-DCs诱导的CTLs抑制CaSki细胞增殖
本课题在已有工作基础上,将带有IL-24基因的重组腺病毒载体感染DCs后诱导CTLs产生,从而开展对宫颈癌的治疗研究。通过研究课题组从体内外验证了IL-24转染DCs诱导产生的CTLs可以对宫颈癌CaSki细胞的生长起到了抑制作用,同时也诱导宫颈癌CaSki细胞发生凋亡;体内成瘤实验也表明将IL-24转染后的DCs诱导产生的CTLs与宫颈癌CaS-ki细胞共同培养,通过皮下注射裸鼠体内,30 d后发现其明显抑制裸鼠肿瘤的大小和重量,免疫组化方法检测发现注射Ad-IL-24-DCs的裸鼠肿瘤组织BrdU的表达量明显低于对照组。体内、外研究结果表明重组腺病毒载体转染后的树突状细胞可以抑制子宫颈癌细胞的增殖,诱导其发生凋亡,为临床治疗子宫颈癌提供了理论依据。
[1] Ueno T,Sasaki K,Yoshida S,et al.Molecular mechanisms of hyperplasia induction by human papillomavirus E7 [J].Oncogene,2006,25(30):4155-4164.
[2] Vazquez OG,Garcia JA,Ciudad CJ,et al.Differentially expressed genes between high-risk human papillomavirus types in human cervical cancer cells[J].Int J Gynecol Cancer,2007,17(2):484-491.
[3] 潘巍巍,徐 营,易发平,等.人乳头瘤病毒关键基因在裸鼠体内表达的初步研究[J].中国病理生理杂志,2009,25(2):205-214.
[4] Shai A,Brake T,Somoza C,et al.The human papillomavirus E6 oncogene dysregulates the cell cycle and contributes to cervical carcinogenesis through two independent activities[J].Cancer Res,2007,67(4):1626-1635.
[5] Xiao L,Li X,Niu N,et al.Dichloroacetate(DCA)enhances tumor cell death in combination with oncolytic adenovirus armed with MDA-7/IL-24[J].Mol Cell Biochem,2010,340(1-2):31-40.
[6] Liu J,Zhang Y,Sun P,et al.Enhanced therapeutic efficacy of adenovirus-mediated interleukin-24 gene therapy combined with ionizing radiotherapy for nasopharyngeal carcinoma[J].Oncol Rep,2013,30(3):1165-1174.
[7] Mao Z,Bian G,Sheng W,et al.Adenovirus-mediated IL-24 expression enhances the chemosensitivity of multidrug-resistantgastric cancer cells to cisplatin[J].Oncol Rep,2013,30(5):2288-2296.
[8] Wei N,Fan JK,Gu J,et al.Double-regulated oncolytic adenovirus-mediated interleukin-24 overexpression exhibits potent antitumor activity on gastric adenocarcinoma [J].Hum Gene Ther,2010,21(7):855-864.
[9] Dash R,Dmitriev I,Su ZZ,et al.Enhanced delivery of mda-7/IL-24 using a serotype chimeric adenovirus(Ad.5/3)improves therapeutic efficacy in low CAR prostate cancer cells[J].Cancer Gene Ther,2010,17(7):447-456.
[10]焦庆昉,潘巍巍,易发平,等.人乳头状瘤病毒16亚型E6E7基因重组腺病毒的构建及其在小鼠骨髓源树突状细胞中的表达[J].中国生物制品学杂志,2011,24(1):25-29.
[11]焦庆昉,易发平,陈 全,等.树突状细胞疫苗的制备及其体外诱导细胞毒性T淋巴细胞对宫颈癌CaSki细胞的杀伤作用[J].肿瘤,2011,31(2):106-110.
[12]魏丽丽,崔 涛,丁嵩涛,等.人白介素24腺病毒载体构建及其生物学活性分析[J].中国免疫学杂志,2008,24(3):252-256.
[13] Dalloul A,Sainz-Perez A.Interleukin-24:a molecule with potential anti-cancer activity and a cytokine in search of a function[J].Endocr Metab Immune Disord Drug Targets,2009,9(4):353-360.
[14]Maarof G,Bouchet-Delbos L,Gary-Gouy H,et al.Interleukin-24 inhibits the plasma cell differentiation program in human germinal center B cells[J].Blood,2010,115(9):1718-1726.
[15] Zhuo B,Wang R,Yin Y,et al.Adenovirus arming human IL-24 inhibits neuroblastoma cell proliferation in vitro and xenograft tumor growth in vivo[J].Tumor Biol,2013,34(4):2419-2426.
[16] Zhao Y,Li Z,Sheng W,et al.Adenovirus-mediated ING4/IL-24 double tumor suppressor gene co-transfer enhances antitumor activity in human breast cancer cells[J].Oncol Rep,2012,28(4):1315-1324.
[17]Sun KW,Ma YY,Guan TP,et al.Oridonin induces apoptosis in gastric cancer through Apaf-1,cytochrome c and caspase-3 signaling pathway[J].World J Gastroenterol,2012 ,18(48):7166-7174.
[18]潘巍巍,徐 营,曹利仙,等.shRNA介导的 hWAPL表达沉默对人宫颈癌CaSki细胞增殖与凋亡的影响[J].中国病理生理杂志,2013,29(7):1213-1218.
[19]张雅丽,高维娟.c-Jun氨基末端激酶与caspase在细胞凋亡中的作用及相互关系[J].中国病理生理杂志,2009,25(3):607-609,613.
