经皮三叉神经电刺激减轻戊四氮诱导的大鼠癫痫发作并抑制海马内IL-1β和TNF-α的表达*
2014-11-08刘益民王倩倩贺慧艳
刘益民, 王倩倩, 贺慧艳, 王 玉△
近年的研究表明,三叉神经电刺激有明确的抗癫痫作用,其具体机制尚未见明确的研究报道[1-2]。我们的前期实验研究表明,经皮三叉神经电刺激(external trigeminal nerve electrostimulation,eTNS)预处理增加了戊四氮(pentylenetetrazole,PTZ)致痫大鼠海马区谷氨酸脱羧酶的表达,进而可能通过诱导脑内抑制性机制的增强来实现抗癫痫作用[3]。诸多因素参与癫痫发生、发展过程[4-6],越来越多的实验和临床研究表明炎症反应和免疫调节是癫痫的的重要病理机制[7-8]。有鉴于此,我们对大鼠进行经皮三叉神经电刺激,之后应用PTZ点燃癫痫大鼠,观察预处理对癫痫是否具有抑制作用以及对海马致痫细胞因子的影响,为经皮三叉神经电刺激在癫痫防治中的应用提供实验依据。
材料和方法
1 动物与分组
选用成年健康雄性 SD大鼠,220~250 g,SPF级,由安徽医科大学实验动物中心提供。置于安静、避光、自由摄取食水的室温环境下饲养2周,以适应环境。动物随机分为对照组(control组)、致痫组(PTZ组)和eTNS组,eTNS组动物给予PTZ点燃癫痫及7 d、14 d和28 d连续的经皮三叉神经电刺激,PTZ组大鼠给予PTZ点燃癫痫及相同时间的0参数假刺激,而control组大鼠仅给予相同时间的0参数假刺激。
2 主要试剂
PTZ购自Sigma,兔抗大鼠白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)多克隆抗体购于 Abcam,ELISA 试剂盒购自Invitrogen,免疫组化II抗试剂盒购于北京博奥森生物技术公司。经皮电刺激仪(KD-2A型,北京博洋生物器械公司)。
3 主要方法
3.1 经皮三叉神经电刺激 实验操作时动作轻柔,大鼠先腹腔注射10%水合氯醛(350 mg/kg)麻醉动物。经皮三叉神经电刺激组:大鼠俯卧固定,将2个膜式电极对称外置于眼眶上方约1 cm中内1/3处的三叉神经眼支分布区域,固定后外接经皮电刺激仪。刺激参数[9]:频率 140 Hz、电流 10 mA、脉宽 500 μs、正相脉冲刺激30 s,间歇5 min,每天连续刺激2 h。Control组和PTZ组大鼠亦被固定,外接刺激仪器,刺激参数均设置为0,持续2 h。各组操作均在8:00-12:00间进行。
3.2 急性痫性痉挛模型的建立 各实验动物于7 d、14 d和28 d经皮电刺激或假刺激结束后分别给予PTZ(75 mg/kg)腹腔注射并观察行为学变化。依据Rudge等[10]对大鼠癫痫发作时的行为描述来判断动物是否痫性发作并进行评分:0分:无任何反应;1分:面部痉挛,包括眨眼、动须、节律性咀嚼等;2分:1分加节律性点头;3分:出现单肢痉挛;4分:出现双前肢痉挛,甩尾;5分:四肢或全身痉挛大发作,摔倒;6分:癫痫持续状态,持续30 min以上的双前肢痉挛或全身痉挛即可认为是持续状态;7分:死亡。行为学观察后24 h给予10%水合氯醛深度麻醉后(400 mg/kg,腹腔注射)取材,分别行免疫组化灌注固定取材及海马组织提取两部分。
3.3 免疫组化灌注取材及固定 大鼠麻醉满意后,迅速开胸暴露心脏,用灌注穿刺针沿着心脏的纵轴方向经心尖刺入左心室至升主动脉根部缝扎固定,在右心耳剪一小口,可见血液流出,先用0.9%氯化钠注射液200 mL快速灌注以冲净血液,待右心耳流出清亮液体时,再用4%多聚甲醛磷酸缓冲液(0.1 mmol/L PBS,pH 7.4)100 mL先快后慢灌注,灌注时间约15 min,灌注至大鼠四肢及尾巴伸直变硬时,断头取脑组织固定于4% 多聚甲醛中72 h,流水冲洗标本18 h后常规脱水、透明、浸蜡、包埋,取含背侧海马最大冠状层面的脑组织作石蜡切片,片厚4 μm。
3.4 免疫组化法染色 切片常规脱蜡至水,抗原热修复后依次加入3%过氧化氢 、10%山羊血清封闭液,之后分别加Ⅰ抗 IL-1β(1∶100)或 TNF-α(1∶200),于4℃冰箱过夜孵育,滴加II抗工作液及辣根酶,DAB显色清晰后冲洗,烤干后中性树胶封片,阴性对照用PBS代替Ⅰ抗。
3.5 ELISA海马组织提取及组织处理 各实验动物于癫痫持续状态后24 h,腹腔注射10%水合氯醛(400 mg/kg)深度麻醉后断头取脑,冰盘内沿矢状线直切成对半,两侧大脑半球的海马组织被离断,存于液氮罐中。
3.6 细胞因子ELISA定量测定 取出液氮罐中留置海马组织,标本保持低温条件下,各标本称重后用固定倍数的生理盐水稀释,快速电动匀浆后移入离心管,4℃低温离心20 min(3 000 r/min)。离心后取上清,分装后1份待测,其余-80℃冰箱保存待用。ELISA法检测各标本内IL-1β和TNF-α的含量,具体方法按说明书进行。
3.7 免疫组化图像采集 图像采集在Olympus显微摄像系统观察阳性细胞的表达,切片置光学显微镜下,分别对每张切片的海马各区进行详细观察及摄片。同一指标采用相同的曝光度,并以计算机提供的窗口为单位(×400),利用Image-Pro Plus 6.0图像分析系统(Media Cybernetics),随机测定窗口区阳性细胞的平均光密度值。系统自动把测定区转换为纯白背景,阳性细胞转换为灰色,在系统进行各指标平均吸光测定时,参数保持不变。
4 统计学处理
数据用均数±标准差(mean±SD)表示,用SPSS 16.0统计软件处理。行为学分析时,组间癫痫持续时间的比较运用t检验,发作强度比较运用曼-惠特尼U检验。海马细胞因子的定量比较采用单因素方差分析(One-way ANOVA)及 SNK-q检验,以 P<0.05为差异有统计学意义。
结 果
1 三叉神经电刺激减轻PTZ点燃大鼠的发作程度
Control组大鼠表现正常,无癫痫发作症状。PTZ组和eTNS组动物在腹腔注入PTZ后2~5 min内均出现癫痫大发作症状,如全身肌肉阵发性抽搐、强直性抽搐、尖叫、跳跃、甩尾等。15 min左右症状逐渐减轻,随时间延长,抽搐幅度逐渐减小,持续约1~2 h完全缓解。三叉神经刺激后28 d的动物痫性发作等级和发作时间较PTZ组明显降低(P<0.05),见表1。

表1 急性惊厥大鼠的发作强度及持续时间Table 1.Severity and duration of acute seizure in rats(Mean±SD)
2 免疫组化半定量分析
Control组大鼠各时点IL-1β和TNF-α未见明显阳性细胞的表达。从形态学观察,IL-1β在胶质细胞和少量散在神经元中表达(图1),而TNF-α仅表达于胶质细胞中(图2)。与control组比较,7 d PTZ组和eTNS组的IL-1β及TNF-α表达差异不显著,14 d及28 d差异明显(P<0.01);与PTZ组比较,eTNS组IL-1β及TNF-α表达在7 d未见明显差异,但在14 d及28 d,eTNS组IL-1β和TNF-α表达显著减少(P <0.05),见表2。
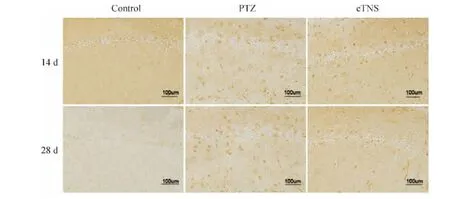
Figure 1.The expression of IL-1β at 14 d and 28 d after consecutive electrostimulation.图1 连续电刺激14 d和28 d海马CA1区IL-1β的表达

Figure 2.The expression of TNF-α at 14 d and 28 d after consecutive electrostimulation.图2 连续电刺激14 d和28 d海马CA1区TNF-α的表达
3 ELISA定量分析
Control组大鼠海马IL-1β及TNF-α蛋白含量甚微;PTZ点燃后,与control组比较,各时点PTZ组和eTNS组的IL-1β及TNF-α蛋白含量增加明显(P<0.01)。与PTZ组比较,刺激后7 d,eTNS组的 IL-1β及TNF-α蛋白含量无明显差异(P>0.05);而刺激后14 d,eTNS组的IL-1β及TNF-α蛋白含量显著减少(P <0.05);刺激后28 d,eTNS组的IL-1β 及 TNF-α蛋白含量减少更明显(P<0.01),见图3、4。
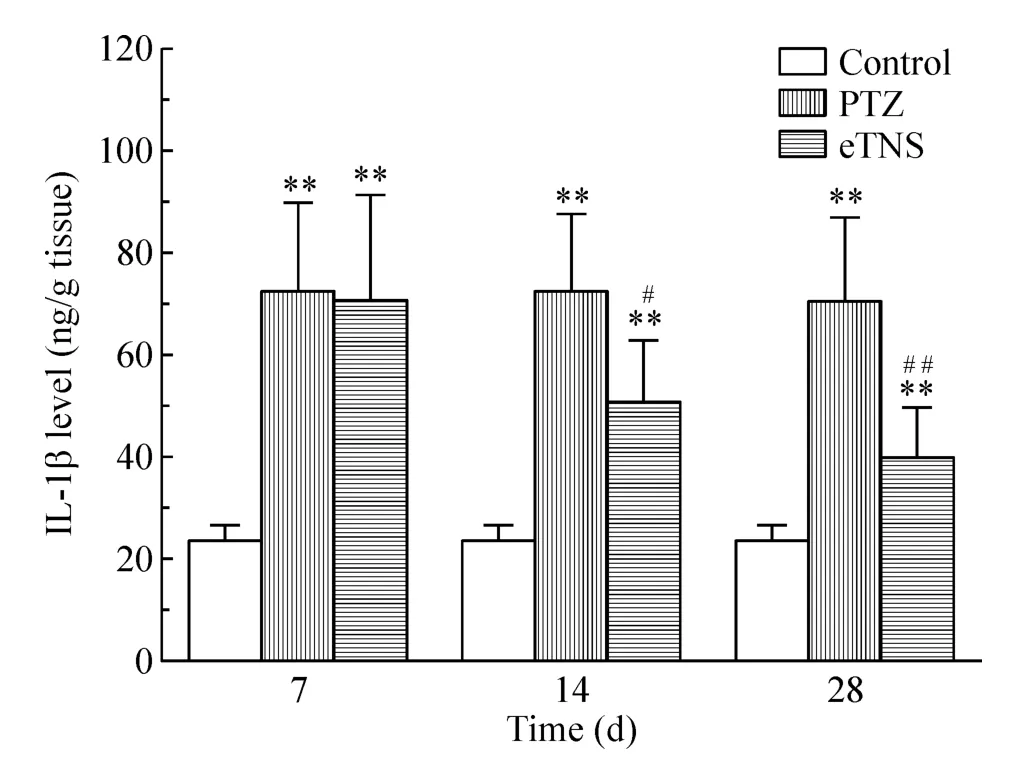
Figure 3.Comparison of the content of IL-1β in hippocampus at different time points among control group,PTZ group and eTNS group.Mean ± SD.n=6.**P <0.01 vs control group;#P <0.05,##P <0.01 vs PTZ group.图3 不同时点control组、PTZ组和eTNS组间海马IL-1β蛋白含量的比较
讨 论
最新研究报道经皮三叉神经电刺激这一技术在美国已初步应用于临床顽固性癫痫病人的治疗探索,半数以上的顽固性癫痫发作得到显著改善或完全控制发作[1]。经皮三叉神经电刺激在操作方面简便易行,无明显的心血管不良事件发生[11],在便利性和经济性方面明显优于脑深部电刺激、脊髓电刺激和迷走神经电刺激,对其抗癫痫作用及具体机制的进一步探索具有重要的理论和实践意义。
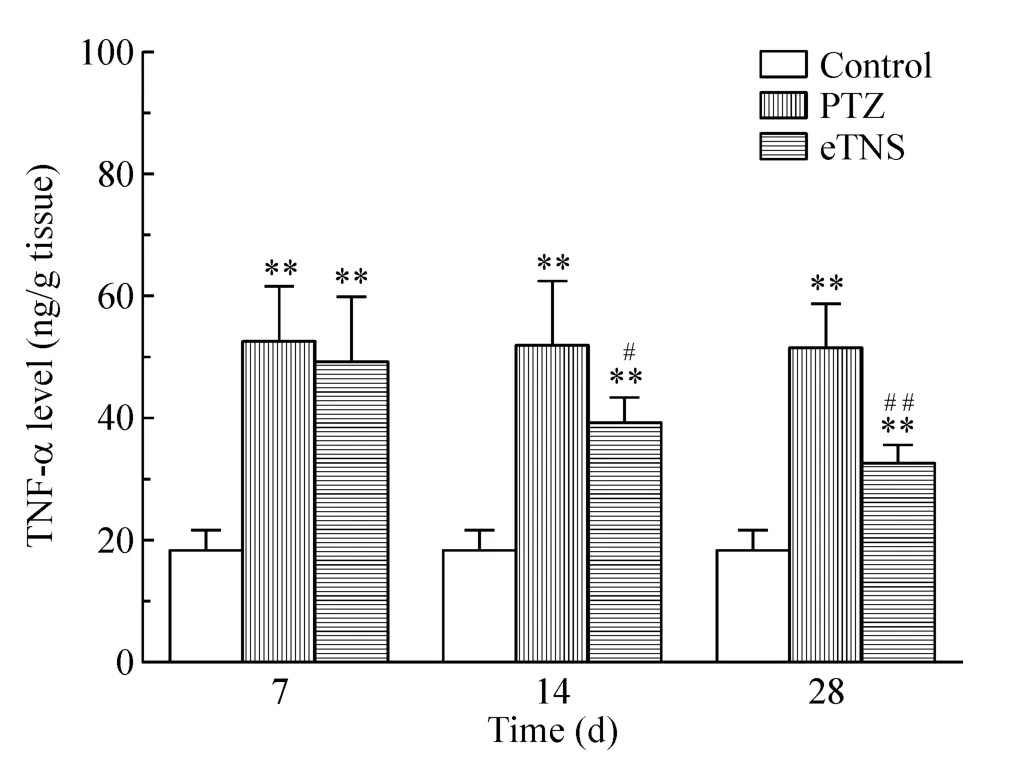
Figure 4.Comparison of the content of TNF-α in hippocampus at different time points among control group,PTZ group and eTNS group.Mean ± SD.n=6.**P <0.01 vs control group;#P <0.05,##P <0.01 vs PTZ group.图4 不同时点control组、PTZ组和eTNS组间海马TNF-α蛋白含量的比较
既往的研究表明,癫痫与细胞因子密切相关,癫痫持续状态导致海马区神经元选择性死亡,同时引起海马区炎症细胞因子的改变[12]。目前认为,促炎症细胞因子IL-1β及其受体在癫痫形成中起到关键作用,IL-1β的产生促进了癫痫的形成[7-8]。药物研究明确证实抑制IL-1β生物合成减弱了小鼠的自发性发作[13]。实验研究表明,TNF-α作为一种经典的促炎症细胞因子,能调整突触的传递,尤其是胶质细胞释放的TNF-α,可以通过调整神经元表面的α-氨基羟甲基恶唑丙酸受体,加快突触的传递,并且通过与不同受体调整与谷氨酸能系统相互作用,调整神经兴奋性,进而影响癫痫发生的敏感性[14-15]。
PTZ通过影响氯离子通道活性从而使神经元过度兴奋,引起癫痫发作。PTZ引起的慢性癫痫发作与人类的自发性癫痫较为类似,可引起与人类较为相似的行为和神经病理的改变[16]。本研究经皮三叉神经电刺激组较致痫组大鼠在行为学上的表现明显减轻,并且刺激组动物海马IL-1β和TNF-α蛋白的表达明显减少,表明经皮三叉神经电刺激减少致痫细胞因子IL-1β和TNF-α的合成与释放,减弱中枢神经系统的兴奋性,减轻致痫动物的脑损伤,进而可能影响癫痫的形成。有关三叉神经刺激与中枢神经系统炎症调节机制尚未明确,需进一步探索,经皮三叉神经电刺激可能为癫痫的防治提供新的思路。
[1] DeGiorgio CM,Murray D,Markovic D,et al.Trigeminal nerve stimulation for epilepsy:long-term feasibility and efficacy[J].Neurology,2009,72(10):936-938.
[2] DeGiorgio CM,Fanselow EE,Schrader LM,et al.Trigeminal nerve stimulation:seminal animal and human studies for epilepsy and depression[J].Neurosurg Clin N Am,2011,22(4):449-456.
[3] 张慧敏,李良勇,李家林,等.经皮三叉神经电刺激预处理对戊四氮致痫大鼠海马谷氨酸脱羧酶表达的影响[J].安徽医科大学学报,2011,46(8):732-736.
[4] 王胜军,赵秀鹤,刘学伍,等.聚腺苷二磷酸核糖糖苷水解酶调节癫痫大鼠海马组织凋亡诱导因子及炎症因子的研究[J].中国病理生理杂志,2012,28(2):258-262.
[5] 王胜军,迟兆富,王树华,等PARP调节癫痫大鼠海马核转录因子κB及相关炎症因子的表达[J].中国病理生理杂志,2010,26(1):86-90.
[6] 彭毓棻,宋 治.NMDA受体在癫痫发病机制中的作用[J].中国病理生理杂志,2011,27(6):1230-1233,1239.
[7] Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011,52(Suppl 3):33-39.
[8] Vezzani A,French J,Bartfai T,et al.The role of inflammation in epilepsy[J].Nat Rev Neurol,2011,7(1):31-40.
[9] Fanselow EE,Reid AP,Nicolelis MA.Reduction of pentylenetetrazole-induced seizure activity in awake rats by seizure-triggered trigeminal nerve stimulation[J].J Neurosci,2000,20(21):8160-8168.
[10] Rudge JS,Mather PE,Pasnikowski EM,et al.Endogenous BDNF protein is increased in adult rat hippocampus after a kainic acid induced excitotoxic insult but exogenous BDNF is not neuroprotective[J].Exp Neurol,1998,149(2):398-410.
[11] Pop J,Murray D,Markovic D,et al.Acute and long-term safety of external trigeminal nerve stimulation for drug-resistant epilepsy[J].Epilepsy Behav,2011,22(3):574-576.
[12] De Simoni MG,Perego C,Ravizza T,et al.Inflammatory cytokines and related genes are induced in the rat hippocampus by limbic status epilepticus[J].Eur J Neurosci,2000,12(7):2623-2633.
[13] Maroso M,Balosso S,Ravizza T,et al.Interleukin-1beta biosynthesis inhibition reduces acute seizures and drug resistant chronic epileptic activity in mice[J].Neurotherapeutics,2011,8(2):304-315.
[14] Balosso S,Ravizza T,Pierucci M,et al.Molecular and functional interactions between tumor necrosis factor-alpha receptors and the glutamatergic system in the mouse hippocampus:implications for seizure susceptibility[J].Neuroscience,2009,161(1):293-300.
[15] Stellwagen D,Beattie EC,Seo JY,et al.Differential regulation of AMPA receptor and GABA receptor trafficking by tumor necrosis factor-alpha[J].J Neurosci,2005,25(12):3219-3228.
[16] Qu H,Eloqayli H,Sonnewald U.Pentylenetetrazole affects metabolism of astrocytes in culture[J].J Neurosci Res,2005,79(1-2):48-54.
