心肌缺血对大鼠延髓利钠肽受体表达的影响*
2014-11-08牛丽静苗智慧管振龙夏晓红王燕凌王惠娟
牛丽静, 白 云, 苗智慧, 管振龙, 夏晓红, 王燕凌, 王惠娟
利钠肽受体(natriuretic peptide receptors,NPRs)主要包括 NPR-A、NPR-B和 NPR-C,其中 NPR-A和NPR-B属于具有鸟苷酸环化酶活性的受体,而NPRC通常被认为是可以从循环中清除利钠肽的受体。利钠肽通过激活细胞膜上的NPR-A或NPR-B参与对抗交感神经系统和肾素-血管紧张素系统的促进血管收缩、促有丝分裂的作用,并具有促进水钠排泄的功能[1]。研究发现,利钠肽及其受体广泛分布于中枢神经系统,特别在第三脑室区域、内侧基底下丘脑[2-3]、脑干[4]及室周器官有密集的表达,其在中枢调控心血管稳态中起着重要的作用[5]。Sills等[6]向大鼠视交叉上核微量注射心房利钠肽(atrial natriuretic peptide,ANP)后,引起血压升高、心率加快;McKitrick等[7]在大鼠孤束核微量注射ANP,导致血压降低,心率减慢。骆鸿等[8]将α-hANP直接应用于大鼠延髓腹外侧吻端加压区,引起血压下降、心率减慢。这些研究结果表明,利钠肽参与了中枢心血管稳态的调控,但具体机制不明。在病理条件下,尤其心肌缺血后利钠肽受体在延髓心血管中枢按时程表达的变化,未见研究报道。本实验拟以SD大鼠为实验对象,复制急性心肌缺血动物模型,应用Western blotting技术检测不同时点的NPR-A和NPR-C在脑干心血管调节相关区域的表达变化,以期找到其在心肌缺血后的时程变化规律,为探究中枢心血管调节区利钠肽的作用机制及其在急性心肌缺血后中枢心血管调节中的可能作用提供基础资料。
材料和方法
1 材料和试剂
3月龄雄性Sprague-Dawley大鼠(体重280~330 g,河北医科大学实验动物中心提供)60只,购入后于避强光、温暖安静的环境中饲养48 h。兔抗NPR-A多克隆抗体(Abcom)、兔抗NPR-C多克隆抗体(Abcom)、山羊抗胆碱乙酰转移酶(choline acetyltransferase,ChAT)单克隆抗体(Millpore)和小鼠抗酪氨酸羟化酶(tyrosine hydroxylase,TH)单克隆抗体(Sigma)。
2 方法
2.1 实验分组及模型复制 大鼠随机分为实验组(模型组,43只)、假手术组(sham,8只)和空白对照组(control,9只)。实验组大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,在第4~5肋骨间开胸,暴露心脏,用6号缝合线迅速结扎心脏的冠状动脉左前降支复制心肌缺血动物模型。大鼠手术后进行恢复性饲养。将成活的模型组大鼠随机分为3 d取材组(9只)、术后7 d取材组(7只)、术后14 d取材组(9只)、术后18 d取材组(9只)和术后28 d取材组(9只)。假手术组大鼠除了不结扎冠状动脉左前降支外,其它手术与实验组的处理相同。空白对照组大鼠不做手术处理,正常饲养。
2.2 取材 实验组动物分别在手术后3 d(9只)、7 d(7只)、14 d(9只)、18 d(9只)和28 d(9只)深度麻醉(腹腔注射80 mg/kg戊巴比妥钠),剪开胸腔,暴露心脏,经升主动脉插管,先用100 mL生理盐水冲洗血液。血液冲洗干净后,迅速摘下心脏,用吸水纸吸干多余水分后称重;打开颅骨取出脑组织,将脑组织置于冷的生理盐水中,剥离大脑皮层及小脑,暴露脑干;由脊髓与延髓分界处至菱形窝中部为延髓,延髓腹侧深约5 mm、前后约1.5 cm为延髓腹侧部,并以最后区为界分为延髓腹侧部吻段(约0.06 g)和延髓腹侧部尾段(约0.035 g)。将取下的脑组织置于低温环境(0~4℃)备用。实验对照组大鼠、空白对照组大鼠于实验组术后3 d按上述方法进行取材处理。
2.3 伊文思蓝和TTC染色 从上述取材过程中取下的心脏的心尖部注入1 mL 3%伊文思蓝。数秒后将心脏在4℃生理盐水中冲洗,滤纸吸干水后-20℃保存30 min。随后把冷冻后的心脏沿房室沟轴横切成2.0~2.5 mm 厚的断面,用0.1%的 TTC 生理盐水溶液37℃孵育30 min。正常组织被染成蓝色,缺血区未梗死心肌被染成红色,梗死区不着色,以此判定心肌缺血模型是否复制成功[9-10]。
2.4 Western blotting分析 按解剖位置分区取材,分别将实验组、实验对照组以及空白对照组大鼠(n=3~4)处理并备用的组织混合,低温下加入RIPA裂解液研磨成浆液,离心后取上清液,考马斯亮蓝蛋白定量。按照蛋白标准曲线测定组织上清液中的蛋白含量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(每加样孔中蛋白上样量60 μg)之后,将凝胶进行转膜,并进行NPR-A、NPR-C、ChAT和TH的印迹杂交(抗体稀释浓度为1∶500)。以内参照β-actin条带吸光度作为标准,计算NPR-A、NPR-C、ChAT和TH蛋白的相对表达量。
3 统计学处理
用ImageJ图像分析软件采集灰度值,并以SPSS 13.0数据处理软件分析。数据以均数 ±标准差(mean±SD)表示,组间比较用单因素方差分析和Student-Newman-Keuls检验。以P<0.05为差异有统计学意义。
结 果
1 伊文思蓝和TTC染色结果
活的心肌纤维里存在脱氢酶,TTC被其转化成红色的甲臜,而梗死区域的心肌纤维没有脱氢酶,TTC会流失掉,心肌组织被染成苍白色。被伊文思蓝染色的组织是灌流充分未发生心肌缺血的组织,苍白色的是心肌缺血后发生坏死的心肌组织。
模型动物心脏呈现深蓝色,在冠脉结扎创口附近可见明显的红色缺血区和白色梗死区;假手术组动物心肌可见少量红色区域;空白对照组动物心脏未见红色缺血区及白色梗死区域,见图1。这提示所有大鼠心肌缺血模型复制成功。
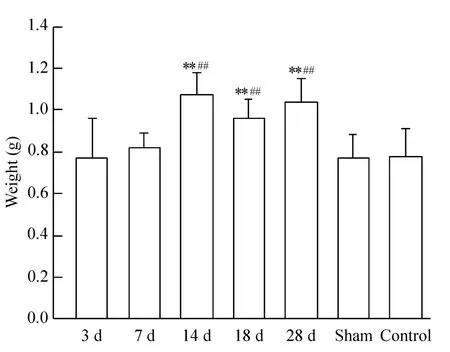
Figure 2.Heart weight after coronary artery ligation.Mean±SD.n=6.**P <0.01 vs control;##P <0.01 vs sham.图2 大鼠心脏在结扎手术后的平均重量
2 心肌缺血后大鼠心脏的变化
结扎大鼠心脏冠状动脉左前降支复制大鼠心肌缺血模型后,随时间的延长大鼠心脏明显肥大,心脏重量也有升高的趋势,并在术后14 d、18 d和28 d与空白对照组及假手术组相比均有极显著的增加,见图2。这些指标符合实验预期的要求。
3 延髓腹侧部吻段Western blotting结果
心肌梗死后大鼠延髓吻段Western blotting检测结果如图3所示。以β-actin(42 kD)作为内参照,NPR-A在相对分子量118 kD处有明显的阳性条带,NPR-C在相对分子量65 kD处有明显的阳性条带。心肌梗死后NPR-A的表达显著升高,明显高于空白对照组(P<0.01),梗死后3 d表达量约为空白对照组的3.5倍,随后有逐渐下降的趋势,到梗死后28 d蛋白表达量约为空白对照组的1.5倍。NPR-C的表达波动性较为明显,心肌梗死后7 d开始逐渐升高,14和18 d显著高于空白对照组(P<0.01),约为空白对照组蛋白表达量的1.5倍,而到28 d NPR-C的表达已经恢复到了正常水平。
ChAT在相对分子量约68 kD处有明显的阳性条带,TH在相对分子量59 kD处有明显阳性条带。在心肌梗死后7 d,在延髓腹侧部吻段的ChAT表达显著低于空白对照组(P<0.01),随后ChAT的表达有所升高,始终低于空白对照组,但无显著差异。心肌梗死后,在延髓腹侧部吻段的TH表达均显著低于空白对照组(P<0.05),显著差异,梗死后14 d和18 d表达最低(P<0.01),但波动性不显著。
4 延髓腹部尾段Western blotting结果
心肌梗死后大鼠延髓尾段Western blotting检测结果如图4所示。心肌梗死后3 d NPR-A的表达量显著高于空白对照组(P<0.05),约为空白对照组蛋白表达量的1.4倍,之后随时间推移有所波动,梗死后14 d蛋白表达量降至最低,不到空白对照组蛋白表达量的7/10,梗死后18 d,蛋白表达量高于空白对照组,但这些变化与对照组无显著差异。心肌梗死后NPR-C的表达均有降低,28 d时与空白对照组比差异显著,蛋白表达量不及对照组的3/10。心肌梗死后,ChAT和TH在延髓腹侧部尾段的表达也有先降低后升高的趋势,心肌梗死后3 d和7 d,TH的表达与空白对照组比有显著差异(P<0.05)。
讨 论
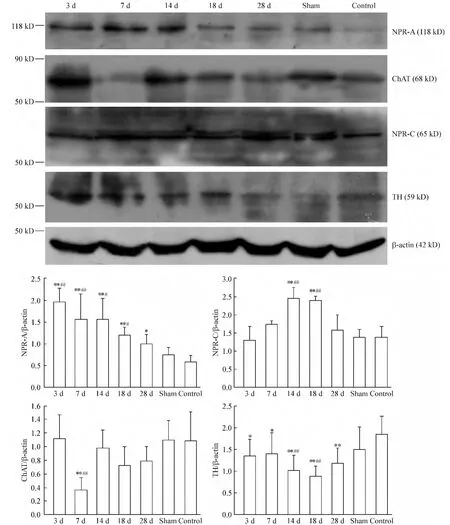
Figure 3.NPR-A,NPR-C,ChAT and TH expression in the rostral ventral medulla oblongata after coronary artery ligation.Mean±SD.n=6.*P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs sham.图3 冠脉结扎后大鼠延髓腹侧部吻段NPR-A、NPR-C、ChAT和TH的表达变化
大量的基础和临床实验研究表明,心肌缺血后由于心肌收缩无力,心脏内积存的血液过多,对室壁压力的增加诱导了利钠肽大量的分泌,脑钠肽的分泌量与心肌病变的程度呈正相关[11]。基础实验研究发现,心肌梗死模型大鼠的血浆脑钠肽浓度在第3天和第14天有2次升高[12],所以临床上已将血液中脑钠肽的变化作为评估冠心病的重要指标。血液中升高的利钠肽一方面通过抑制肾上腺醛固酮的分泌,降低肾小管细胞的代谢活动,促进排钠排水,降低血压和回心血量,减少心脏内的血液积存;另一方面,血液内升高的利钠肽可通过无血脑屏障的部位入脑,作用于不同中枢部位,通过影响激素的分泌和交感、副交感神经的活动调节心血管的功能,以适应心肌缺血后的机能状态。利钠肽是通过细胞膜上的受体发挥作用的,所以血液中利钠肽含量的升高必然影响其相应受体的表达及其功能。有研究证实,心肌缺血后的心肌组织内,心房肽和脑钠肽的表达均显著升高,NPR-C的表达也随之增多,但于缺血后的第28 d在肾脏和肺内显著降低[13],所以作者推测心肌缺血后,脑干心血管中枢区域的NPR-A、NPRC的表达可能也发生类似的适应性变化。
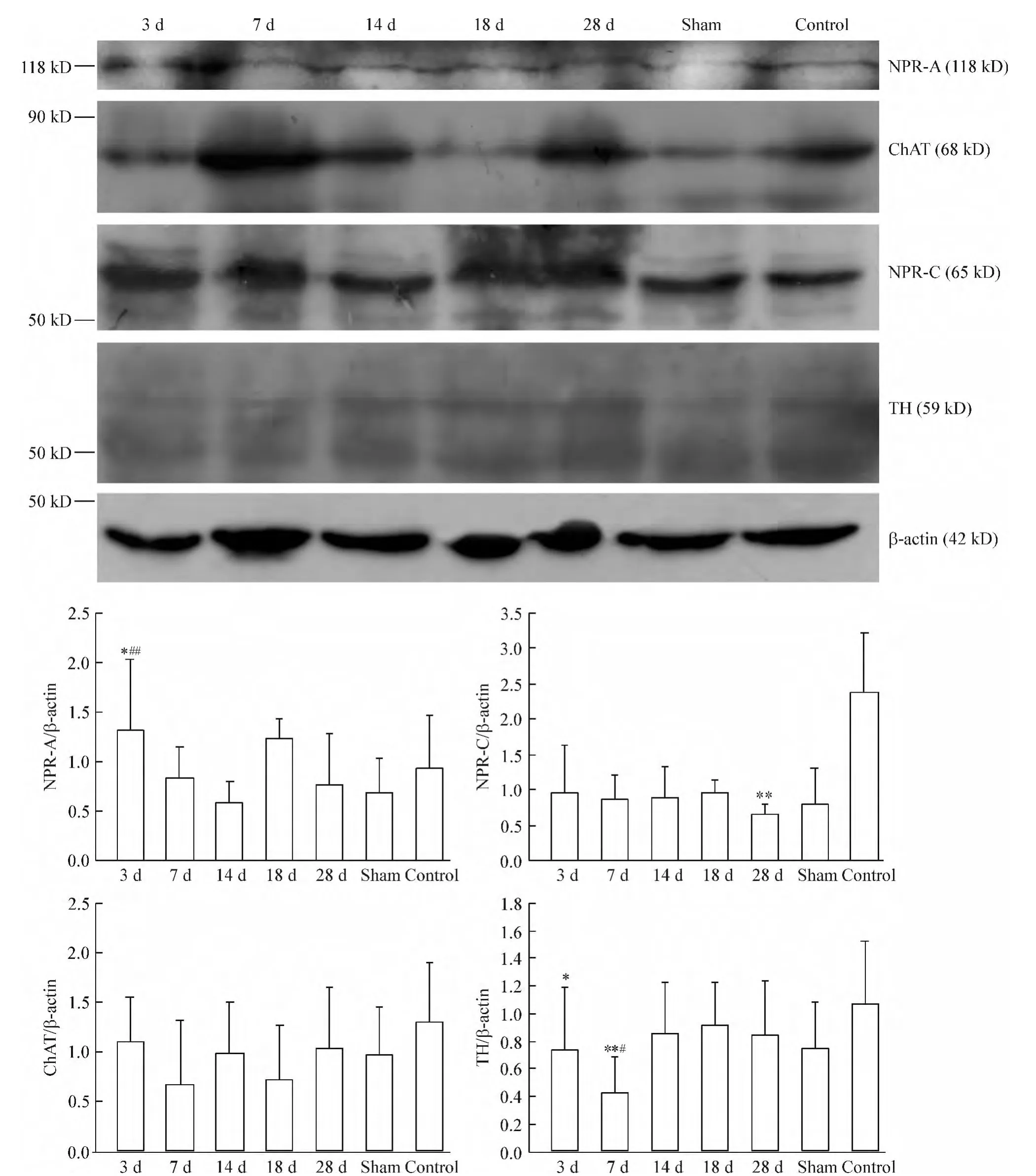
Figure 4.NPR-A,NPR-C,ChAT and TH expression in the caudal ventral medulla oblongata after coronary artery ligation.Mean±SD.n=6.*P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs sham.图4 冠脉结扎后大鼠延髓腹侧部尾段NPR-A、NPR-C、ChAT和TH的表达
本研究结果显示,延髓腹侧部吻段NPR-A的表达在缺血3 d后迅速升高,而后逐渐降低,但始终高于空白对照组,这与心肌缺血后血液中利钠肽含量变化的时点和趋势一致[12]。有实验表明,向延髓腹侧部吻段(升压区)微量注射心房肽能显著降低心率和血压[8]。所以,NPR-A表达的增加可提高利钠肽对中枢的作用,可能通过对内脏神经活动的调节保护受损的心肌。NPR-A在延髓腹侧部尾段的表达与吻段相似,可能通过激活此处的神经元来抑制升压区的交感兴奋,达到相似的效果。清除型的利钠肽受体NPR-C的表达,在缺血后的第14 d和18 d达到峰值,显著高于空白对照组(P<0.05)。其比血液中利钠肽升高的时程稍晚,提示NPR-C表达增多与及时清除脑内过多的利钠肽相关,这可能是在中枢内形成负反馈调节的机制之一。
本实验对心肌缺血后ChAT和TH在延髓节段表达的检测显示,ChAT在延髓腹侧部吻段、TH在延髓腹侧部的表达均降低。以往的资料显示,NPR-A与ChAT、NPR-A与TH均在延髓节段的神经元上有共表达[14],NPR-C 也有相似的共表达模式[15]。心肌缺血后,NPR-A表达的升高与ChAT和TH表达的降低可能是影响交感、副交感神经活动的途径之一,但其具体的生理机制尚需进一步探讨。
上述结果表明,心肌缺血后,延髓心血管调节中枢内神经元的NPR-A和NPR-C表达显著增加,而ChAT和TH的表达显著降低。利钠肽在延髓心血管中枢内与NPR-A结合,影响交感、副交感神经的调节,完成对受损心肌的保护作用。NPR-C的表达增加可能是机体对利钠肽升高后的负反馈调节机制之一。至于ChAT和TH的表达变化是利钠肽系统中枢心血管调控的上游因素还是结果有待进一步研究。本研究结果为进一步研究心肌缺血后利钠肽的中枢调控机制提供了基础资料。
[1] Potter LR,Yoder AR,Flora DR,et al.Natriuretic peptides:their structures,receptors,physiologic functions and therapeutic applications[J].Handb Exp Pharmacol,2009,191:341-366.
[2] Herman JP,Langub MC Jr,Watson RE Jr.Localization of C-type natriuretic peptide mRNA in rat hypothalamus[J].Endocrinology,1993,133(4):1903-1906.
[3] Marei HE.Fine structural and immunohistochemical localization of cardiac hormones(ANP)in the right atrium and hypothalamus of the white rat[J].Eur J Morphol,2002,40(1):37-41.
[4] Tsukada T,Nobata S,Hyodo S,et al.Area postrema,a brain circumventricular organ,is the site of antidipsogenic action of circulating atrial natriuretic peptide in eels[J].J Exp Biol,2007,210(Pt 22):3970-3978.
[5] Imura H,Nakao K,Itoh H.The natriuretic peptide system in the brain:implications in the central control of cardiovascular and neuroendocrine functions[J].Front Neuroendocrinol,1992,13(3):217-249.
[6] Sills MA,Nguyen KQ,Jacobowitz DM.Increases in heart rate and blood pressure produced by microinjections of atrial natriuretic factor into the AV3V region of rat brain[J].Peptides,1985,6(6):1037-1042.
[7] McKitrick DJ,Calaresu FR.Cardiovascular responses to microinjection of ANF into dorsal medulla of rats[J].Am J Physiol,1988,255(1 Pt 2):R182-R187.
[8] 骆 鸿,赵 工,何瑞荣.大鼠延髓腹外侧部微量注射心房钠尿肽的心血管效应[J].生理学报,1992,44(5):515-519.
[9] Izumi T,Saito Y,Kishimoto I,et al.Blockade of the natriuretic peptide receptor guanylyl cyclase-A inhibits NF-κB activation and alleviates myocardial ischemia/reperfusion injury[J].J Clin Invest,2001,108(2):203-213.
[10]于宗良,陈 乐,杨向军.粒细胞集落刺激因子联合缺血后适应治疗急性心肌梗死的实验研究[J].中国病理生理杂志,2012,28(11):1933-1937.
[11]刘红樱,王 蔚,葛均波.B型利钠肽与急性冠状动脉综合征的研究进展[J].上海医学,2011,34(3):237-239.
[12] Sawada Y,Inoue M,Kanda T,et al.Co-elevation of brain natriuretic peptide and proprotein-processing endoprotease furin after myocardial infarction in rats[J].FEBS Lett,1997,400(2):177-182.
[13] Hystad ME,Oie E,Grogaard HK,et al.Gene expression of natriuretic peptides and their receptors type-A and-C after myocardial infarction in rats[J].Scand J Clin Lab Invest,2001,61(2):139-150.
[14] Abdelalim EM,Osman AH,Takada T,et al.Immunohistochemical mapping of natriuretic peptide receptor-A in the brainstem of Macaca fascicularis[J]. Neuroscience,2007,145(3):1087-1096.
[15]Abdelalim EM,Masuda C,Bellier JP,et al.Distribution of natriuretic peptide receptor-C immunoreactivity in the rat brainstem and its relationship to cholinergic and catecholaminergic neurons[J].Neuroscience,2008,155(1):192-202.
