半枝莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞NOS、HSP70及apoE异常表达的影响*
2014-05-16范悦吴晓光赵泓翔商亚珍
范悦,吴晓光,赵泓翔,商亚珍
(河北省中药研究与开发重点实验室,承德医学院中药研究所,河北承德 067000)
半枝莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞NOS、HSP70及apoE异常表达的影响*
范悦,吴晓光,赵泓翔,商亚珍△
(河北省中药研究与开发重点实验室,承德医学院中药研究所,河北承德 067000)
目的:探讨半枝莲黄酮对Aβ25-35引起大鼠皮层星形胶质细胞一氧化氮合酶(NOS)热休克蛋白70 (HSP70)及载脂蛋白E(apoE)蛋白表达异常变化的影响。方法:培养第3代的大鼠星形胶质细胞随机分为空白对照组、模型组和3个剂量药物组,药物组细胞分别加入17.5、35和70 mg/L半枝莲黄酮作用24 h后,模型组和3个剂量药物组均加入Aβ25-35100 μmol/L作用24 h,免疫组化法测定星形胶质细胞中内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS)和神经元型一氧化氮合酶(nNOS)蛋白的表达;Western blotting检测星形胶质细胞中HSP70蛋白的表达;RT-PCR测定细胞中apoE mRNA的表达。结果:与空白组相比,模型组eNOS蛋白含量降低60.83%(P<0.01),iNOS蛋白含量增加215.03%(P<0.01),HSP70蛋白含量增加166.67%(P<0.01),apoE mRNA含量增加150.00%(P<0.01);半枝莲黄酮17.5、35及70 mg/L能不同程度地提高eNOS蛋白含量73.66%~137.77%(P<0.05),降低iNOS蛋白含量19.40%~44.50%(P<0.01),降低HSP70蛋白含量18.52%~49.38% (P<0.01),降低apoE mRNA的含量14.17%~41.67%(P<0.01)。结论:半枝莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞的损伤具有抑制作用。半枝莲黄酮可能通过影响星形胶质细胞发挥对阿尔茨海默病的治疗作用。
阿尔茨海默病;星形细胞;半枝莲黄酮;一氧化氮合酶;热休克蛋白70;载脂蛋白E类
阿尔茨海默病(Alzheimer disease,AD)是最常见的痴呆类型,临床上表现为进行性认知障碍和精神异常。AD的发病机制目前还不完全明确,但神经炎症、氧化应激、胆碱能神经功能紊乱、免疫异常和基因遗传等因素[1]都与之密切相关。Aβ是39~43个氨基酸残基组成的肽段,Aβ25-35是其中的主要毒性片段,对体外培养及在体的神经细胞均有毒性[2]。
自一氧化氮(nitric oxide,NO)和一氧化氮合酶(nitric oxide synthase,NOS)被发现以来,对它的研究日益深入。大量的研究发现,NO不仅是在正常情况下与学习、记忆相关的信号分子,在异常的情况下也参与AD的发生和进展[3]。热休克蛋白在细胞损伤修复方面有重要作用,目前对热休克蛋白的研究也越来越得到研究人员的重视,体外实验发现,热休克蛋白70(heat-shock protein 70,HSP70)可以在早期阶段抑制Aβ1-42的聚集[4],抑制Aβ相关的毒性作用,故HSP70与AD的病理生理过程有密切联系。载脂蛋白E(apolipoprotein E,apoE)也广泛参与了AD发病的各个方面,包括Aβ的沉积、tau蛋白的异常磷酸化、神经原纤维缠结(neurofibrillary tangles,NFTs)的形成、神经变性以及精神和行为缺陷等[5]。
星形胶质细胞作为数量最多的神经胶质细胞,与神经退行性疾病关系极为密切。目前对胶质细胞的影响随着研究进展则越来越受到重视,因此,干预星形胶质细胞异常变化可能有利于神经退行性疾病的治疗。
半枝莲黄酮(Scutellaria barbata flavonoids,SBF)是从半枝莲地上部分提取、分离的黄酮类化合物,现代药理学发现其具有抗肿瘤、抗氧化和改善记忆障碍等多种药理学作用[6-8]。其神经保护作用缘于其多羟基结构具有较强还原性,但对胶质细胞的影响未见报道,本研究利用Aβ25-35损伤星形胶质细胞体外模型,探讨半枝莲黄酮是否通过对星形胶质细胞的NOS、HSP70 及apoE表达的影响发挥抗痴呆作用。
材料和方法
1 动物和药品
新生1~3 d的SD大鼠(合格证为No.90912),雌雄不限,河北医科大学实验动物中心提供。半枝莲黄酮承德医学院中药研究所提供。DMEM-F12培养基购于Gibco,胎牛血清购于PAA,胰蛋白酶购于华美生物工程有限公司。Aβ25-35购于上海强耀生物科技有限公司,NOS、HSP70Ⅰ抗购于北京博奥森生物技术有限公司。Ⅱ抗试剂盒、DAB显色试剂盒购于武汉博士德生物工程有限公司。ApoE(67 bp)上游引物5’-GCAGAGCTCCCAAGTCACACAG-3’,下游引物5’-TGCCTTTACTTCCGTCA-TAGTGTCC-3’;βactin(150 bp)上游引物5’-GGAGATTACTGCCCTGGCTCCTA-3’,下游引物5’-GACTCATCGTACTCCTGCTTGCTG-3’;TaKaRa RNA PCR Kit(AMV)Ver.3.0(100次量)购于大连宝生物工程有限公司。
2 方法
2.1 星形胶质细胞培养新生1~3 d的SD大鼠,消毒,取出双侧大脑皮层,剔除脑膜及血管,剪碎,加入0.125%胰蛋白酶置于37℃、5%CO2培养箱中,孵育消化30 min,含20%胎牛血清的培养液终止消化。离心,以5×104cells/cm2的密度接种于用0.1%多聚赖氨酸包被的培养瓶中。30 min后轻轻翻转培养瓶,吸出未贴壁的细胞悬液,重新接种于多聚赖氨酸包被的培养瓶中。培养3 d换液1次,培养10 d左右细胞长满瓶底进行传代。传代第3代细胞利用免疫组化法对星形胶质细胞内特异性蛋白——胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)进行细胞鉴定,通过随机选取若干视野,阳性细胞计数,结果发现传代第3代95%细胞为星形胶质细胞[9]。
2.2 Aβ25-35和半枝莲黄酮的配制将Aβ25-35溶于三蒸水中过滤除菌,再与培养液混合配成200 μmol/L贮备液,分装-20℃保存,使用前需置37℃温箱孵育7 d以形成有神经毒性的聚集型Aβ25-35。半枝莲黄酮溶于培养液中,配成100 mg/L贮备液,过滤除菌,分装4℃保存。
2.3 Aβ25-35和半枝莲黄酮的作用3代以上的细胞以5×104cells/well接种于24孔板内的0.1%多聚赖氨酸包被的盖玻片上,37℃、5%CO2培养箱培养48 h后,分为空白对照组、模型组和半枝莲3个剂量药物组,3个剂量药物组细胞加含17.5、35和70 mg/L半枝莲黄酮的培养液,空白组和模型组细胞给予无血清培养液,培养24 h。随后除空白组加无血清DMEM/F12培养液外,其余各组再加Aβ25-35使其终浓度为100 μmol/L,再培养24 h,进行指标的检测。
2.4 星形胶质细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)蛋白含量的检测半枝莲黄酮和Aβ25-35分组处理后,分别将细胞进行eNOS、iNOS和nNOS蛋白表达的常规免疫组化测定,I抗浓度1∶100,DAB显色,脱水,透明,中性树胶封片。同时用PBS代替Ⅰ抗作阴性对照。
2.5 星形胶质细胞中HSP70的检测培养第3代的星形胶质细胞5×104cells/cm2的密度接种至培养瓶中,贴壁48 h后半枝莲黄酮和Aβ25-35处理后,常规方法提取细胞总蛋白,电泳,转膜,5%脱脂奶粉封闭2 h,I抗为HSP70(1∶100)和β-actin(1∶500),4℃孵育过夜,II抗(1∶3 000)孵育1 h,ECL发光液覆盖3min后,暗匣曝光,显影,定影。利用Quantity One 4.6.2软件进行定量分析,以目的条带吸光度与βactin条带吸光度的比值作为HSP70蛋白表达的相对水平。
2.6 星形胶质细胞中apoE的检测采用RT-PCR法检测星形胶质细胞中的apoE的含量,培养至第3代的星形胶质细胞以5×104cells/cm2的密度接种至6孔板中,48 h后用半枝莲黄酮和Aβ25-35处理,抽提总RNA,用DU800紫外可见分光光度计测定RNA浓度和纯度。TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒进行反转录和PCR反应,PCR反应结束后,进行琼脂糖凝胶电泳,凝胶于紫外透射仪中确认PCR反应产物并摄取图像。利用Quantity One 4.6.2软件进行定量分析,以目的条带吸光度值与β-actin条带吸光度值的比值作为各目的基因mRNA表达的相对水平。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用统计软件SPSS 17.0进行统计学分析,多样本均数间比较采用One-way ANOVA,组间两两比较采用SNK检验,以P<0.05为差异有统计学意义。
结果
1 SBF对星形胶质细胞中NOS蛋白表达的影响
1.1 SBF对星形胶质细胞中eNOS蛋白表达的影响与空白组相比,模型组星形胶质细胞中棕色颗粒数量明显减少,颜色变浅,阳性细胞数量也明显减少,通过阳性面积比例的统计学分析,模型组细胞eNOS含量降低60.83%(P<0.01)。与模型组相比,半枝莲黄酮3个剂量组能不同程度提高星形胶质细胞中eNOS的蛋白含量,半枝莲黄酮17.5、35及70 mg/L能分别提高eNOS含量73.66%、137.77% (P<0.01)及81.67%(P<0.05),见图1。
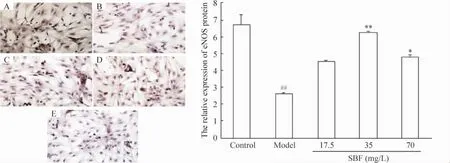
Figure 1.Effect of SBF on eNOS expression in Aβ25-35-damaged astrocytes.A:control group;B:model group;C~E:SBF groups at doses of 17.5,35 and 70 mg/L,respectively(DAB staining,×200).Mean±SD.n=6.##P<0.01 vs control;*P<0.05,**P<0.01 vs model.图1 SBF对Aβ25-35损伤的星形胶质细胞中eNOS蛋白表达的影响
1.2 SBF对星形胶质细胞中iNOS蛋白表达的影响
与空白组相比,模型组星形胶质细胞中阳性细胞数量明显增加,且细胞内棕色颗粒数量明显增加,颜色变深,通过阳性面积比例统计学分析,模型组细胞iNOS含量增加215.03%(P<0.01)。与模型组相比,半枝莲黄酮3个剂量组能不同程度降低星形胶质细胞中iNOS蛋白含量,半枝莲黄酮17.5、35及70 mg/L能分别降低iNOS含量29.36%(P<0.01)、44.50%(P<0.01)及19.40%(P<0.01),见图2。
1.3 SBF对星形胶质细胞中nNOS蛋白表达的影响
通过nNOS免疫组化测定,发现各组细胞胞核蓝染,胞浆内无阳性棕黄色颗粒,星形胶质细胞中不表达nNOS。
2 SBF对星形胶质细胞中HSP70蛋白表达的影响
与空白组相比,模型组细胞HSP70蛋白表达增加166.67%(P<0.01)。与模型组相比,半枝莲黄酮3个剂量组能不同程度减少星形胶质细胞中的HSP70蛋白表达,半枝莲黄酮17.5、35及70 mg/L能分别减少HSP70蛋白的表达18.52%(P<0.01)、49.38%(P<0.01)及33.95%(P<0.01),见图3。
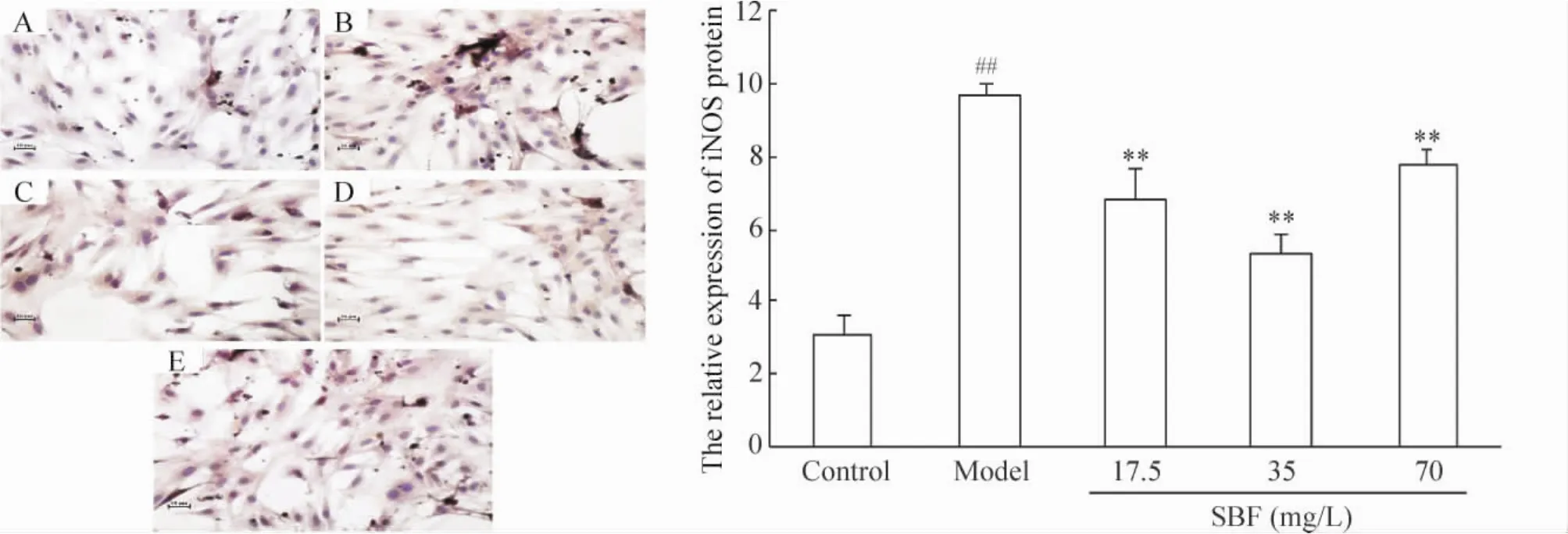
Figure 2.Effect of SBF on iNOS expression in Aβ25-35-damaged astrocytes.A:control group;B:model group;C~E:SBF groups at doses of 17.5,35 and 70 mg/L,respectively(DAB staining,×200).Mean±SD.n=6.##P<0.01 vs control;**P<0.01 vs model.图2 SBF对Aβ25-35损伤的星形胶质细胞中iNOS蛋白表达的影响

Figure 3.Effect of SBF on HSP70 expression in Aβ25-35-damaged astrocytes.The expression of HSP70 was assayed by Western blotting.Mean±SD.n=6.##P<0.01 vs control;**P<0.01 vs model.图3 SBF对Aβ25-35损伤的星形胶质细胞中HSP70蛋白表达的影响
3 SBF对星形胶质细胞中apoE表达的影响
与空白组比较,模型组apoE mRNA含量增加150%(P<0.01)。与模型组相比,半枝莲黄酮3个剂量组能不同程度降低星形胶质细胞中apoE mRNA的含量,其中半枝莲黄酮17.5、35及70 mg/L能分别降低apoE mRNA含量14.17%(P<0.01)、41.67%(P<0.01)及37.50%(P<0.01),见图4。

Figure 4.Effect of SBF on apoE expression in Aβ25-35-damaged astrocytes.The expression of apoE was determined by RT-PCR.Mean ±SD.n=6.##P<0.01 vs control;**P<0.01 vs model.图4 SBF对Aβ25-35损伤的星形胶质细胞中apoE mRNA表达的影响
讨论
AD的特征性病理改变是脑内出现Aβ聚集而形成的老年斑(senile plaques,SPs)和tau蛋白过度磷酸化而产生的NFTs,同时伴随以海马、皮层区域为主的神经元的大量丢失。星形胶质细胞是神经胶质细胞中数量最多的一种,除了以往认识的在神经系统中有支持营养作用外,与神经元之间还存在复杂的相互作用,也与许多神经退行性疾病有密切相关。NO/NOS在AD病程中可能具有双重作用,低浓度(<100 nmol/L)NO激活鸟苷酸环化酶,可促进神经元内cGMP依赖性蛋白激酶磷酸化,经复杂信号网络途径,促进神经生长及抗凋亡,发挥神经保护作用。而高浓度(>400 nmol/L)NO,可导致线粒体功能障碍、凋亡通路的激活等,从而介导神经毒性[10]。NOS是NO合成最关键的限速酶,其含量及活性的变化直接影响NO的生成,大量研究通过NOS来探讨其有关作用。目前已确定的NOS有3种亚型,分别是nNOS、iNOS和eNOS。nNOS主要存在于神经元中,本实验发现星形胶质细胞几乎不表达nNOS或表达很少。大量激活的星形胶质细胞出现在AD早期阶段的未成熟老年斑周围,同时,这些星形胶质细胞中iNOS的表达也增加,提示iNOS持续产生过量的NO在AD的发展过程中起到促进作用[11]。本实验模型组星形胶质细胞中iNOS表达明显增加,eNOS表达明显减少,半枝莲黄酮能不同程度改善NOS蛋白表达紊乱的现象,减少NO的神经损伤。
HSP是细胞受到各种刺激时产生的具有重要生理功能和高度保守的多肽类蛋白质分子家族,参与蛋白质的合成、折叠、装配、转运和降解等过程,以维持细胞蛋白自稳,提高细胞对应激原的耐受性,并有助于细胞恢复正常的结构和机能。HSP70是生物中含量最多、最重要的HSP家族之一,细胞应激后生成最显著[12]。有研究利用Aβ转基因C.elegans线虫模型,通过siRNA技术内源性调节HSP70的表达,发现HSP70可以减少Aβ聚集,抑制Aβ的毒性作用[13]。同时,有实验证实了外源性HSP70能够促进小胶质细胞吞噬和清除Aβ1-42,机制可能与外源性HSP70通过Toll样受体4诱导NF-κB及激活p38 MAPK途径有关,说明HSP70在促进Aβ的清除中起到重要作用[14]。本实验发现,在Aβ的刺激损伤下星形胶质细胞中HSP70蛋白表达明显代偿性增加,来抵御Aβ的神经毒性损伤,以保护细胞。半枝莲黄酮干预后,细胞得到一定程度的保护,HSP70蛋白的表达开始出现不同程度的下调,间接说明了半枝莲黄酮对于Aβ损伤星形胶质细胞有一定保护作用。
ApoE主要在肝脏和大脑中合成,在中枢神经系统主要是星形胶质细胞产生,而在周围神经系统是通过巨噬细胞合成。Aβ是老年斑的核心成分,其毒性作用使神经突起变性,导致神经元损伤。当中枢神经系统损伤时,星形胶质细胞合成apoE增加,并向受损部位运送增加,apoE与Aβ结合,形成apoEAβ复合物由中性粒细胞通过LRP介导清除[15]。ApoE-Aβ复合物是AD脑中淀粉样沉淀的主要成分,在AD病人中,apoEε4纯合个体表现出更大的细胞外淀粉样斑块和密度[16]。进一步研究显示,apoE在体外实验中可以促进可溶性Aβ向淀粉样纤维的β-折叠片层构造的转化,由此可以得到apoE参与Aβ聚合和老年斑形成的假说[17]。ApoE在神经元损伤后的修复过程中起到重要作用,在对脑组织损伤的反应中,apoE mRNA的水平升高,神经元胆固醇合成降低,与细胞结合的脂蛋白增多[18],这些改变都说明apoE通过重复利用受损细胞的膜成分进而帮助细胞修复。本实验发现,与空白组相比,模型组星形胶质细胞apoE mRNA含量明显增加,说明在Aβ损伤情况下,细胞合成apoE增加,半枝莲黄酮能不同程度减少apoE mRNA,对于改善Aβ损伤星形胶质细胞有明显作用。
半枝莲含有多种化学成分,以黄酮类化合物为主,其中以野黄芩苷含量最多,研究发现,半枝莲及其提取成分具有抗肿瘤、抗衰老和抗氧化等功效[19],但除了黄酮类成分,还含有生物碱、酚类和鞣质等,本研究部分实验结果中,某些被检指标中剂量作用出现降低,量效曲线呈倒U形,这一结果符合中药药效学常见的实验结果。综上所述,本实验发现半枝莲黄酮在一定浓度范围内对Aβ25-35引起的损伤具有保护作用;通过药物对星形胶质细胞的干预成为对AD治疗的新靶点。
[1]马永兴,俞卓伟.现代痴呆学[M].第1版.北京:科学技术文献出版社,2007:295-302.
[2]张萌涛,钱亦华,杨杰,等.丹参酮ⅡA对谷氨酸联合淀粉样蛋白诱导细胞损伤的保护作用[J].中国老年学杂志,2009,29(19):2465-2468.
[3]吴晓强,王小姗.一氧化氮/一氧化氮合酶在阿尔茨海默病中的研究进展[J].医学综述,2012,18(1):25-27.
[4]Evans JC,Wisen S,Gestwicki JE.Heat shock proteins 70 and 90 inhibit early stages of amyloid beta-(1-42)aggregation in vitro[J].J Biol Chem,2006,281(44):33182-33191.
[5]刘英华,尹君,王丹玲,等.载脂蛋白E与阿尔茨海默病的关系[J].生命的化学,2005,25(1):10-12.
[6]殷秀霞,张树峰,郗玉玲,等.去卵巢大鼠脑内凋亡基因蛋白表达及半枝莲黄酮的干预作用[J].中国新药杂志,2010,19(14):1255-1259.
[7]郗玉玲,刘敏华,张晓峰,等.半枝莲黄酮对去卵巢大鼠记忆障碍的改善作用[J].中国老年学杂志,2011,31 (2):242-245.
[8]董永彩,董雅洁,龚玉芳,等.半枝莲黄酮对去卵巢大鼠血脂水平的影响[J].中国医院药学杂志,2010,30 (15):1260-1263.
[9]范悦,颜勇,商亚珍.大鼠大脑皮层星形胶质细胞体外培养方法建立及鉴定[J].神经药理学报,2011,1 (6):22-27.
[10]Lüth HJ,Holzer M,Gärtner U,et al.Expression of endothelial and inducible NOS-isoforms is increased in Alzheimer's disease,in APP23 transgenic mice and after experimental brain lesion in rat:evidence for an induction by amyloid pathology[J].Brain Res,2001,913(1):57-67.
[11]刘辉,陈俊抛,梁丰,等.NOS及NO在介导Aβ神经毒性和阿尔茨海默病发病机制中的作用[J].中国临床康复,2003,7(19):2682-2683.
[12]鲍娟,杨期东.热休克蛋白70在阿尔茨海默病中作用的研究进展[J].国际神经病学神经外科学杂志,2008,35(3):264-267.
[13]Fonte V,Kapulkin V,Taft A,et al.Interaction of intracellular beta amyloid peptide with chaperone proteins[J].Proc Natl Acad Sci U S A,2002,99(14):9439-9444.
[14]Kakimura J,Kitamura Y,Takata K,et al.Microglial activation and amyloid-beta clearance induced by exogenous heat-shock proteins[J].FASEB J,2002,16(6):601-603.
[15]贾晓静,贾少杰,张昱,等.雌激素、apoE与阿尔茨海默病[J].中国老年学杂志,2007,3(6):593-595.
[16]Schmechel DE,Saunders AM,Strittmatter WJ,et al.Increased amyloid beta-peptide deposition in cerebral cortex as a consequence of apolipoprotein E genotype in late-onset Alzheimer disease[J].Proc Natl Acad Sci U S A,1993,90 (20):9649-9653.
[17]Castano EM,Prelli F,Wisniewski T,et al.Fibrillogenesis in Alzheimer's disease of amyloid beta peptides and apolipoprotein E[J].Biochem J,1995,306(Pt 2):599-604.
[18]Morris JC.The challenge of characterizing normal brain aging in relation to Alzheimer's disease[J].Neurobiol Aging,1997,18(4):388-389.
[19]董永彩,商亚珍.半枝莲的药理学研究进展[J].承德医学院学报,2009,26(1):98-100.
Effects of Scutellaria barbata flavonoids on abnormal expression of NOS,HSP70 and apoE induced by Aβ25-35in rat astrocytes
FAN Yue,WU Xiao-guang,ZHAO Hong-xiang,SHANG Ya-zhen
(Hebei Provincial Key Laboratory of Traditional Chinese Medicine Research and Development,Institute of Traditional Chinese Medicine,Chengde Medical College,Chengde 067000,China.E-mail:shangyz1018@sina.com)
AIM:To study the effects of Scutellaria barbata flavonoids(SBF)on abnormal expression of nitric oxide synthase(NOS),heat-shock protein 70(HSP70)and apolipoprotein E(apoE)induced by Aβ25-35in rat astrocytes.METHODS:The third generation of cultured rat astrocytes was divided into 5 groups.The cells in 3 drug treatment groups were given SBF at dose of 17.5 mg/L,35 mg/L and 70 mg/L for 24 h,and then the cells in model group and 3 doses of SBF groups were exposed to Aβ25-35at concentration of 100 μmol/L for 24 h.The expression of endothelial nitric oxide synthase(eNOS),inducible nitric oxide synthase(iNOS)and neuronal nitric oxide synthase(nNOS)in the cultured cells was assayed by immunohistochemical method.The expression of HSP70 was estimated by Western blotting and the mRNA expression of apoE was assessed by RT-PCR.RESULTS:Compared with control group,the protein level of eNOS were significantly decreased and the protein level of iNOS increased(P<0.01)in model group.The protein expression of HSP70 and mRNA expression of apoE were notably increased(P<0.01)in model group.However,these disturbances were attenuated by SBF at dose of 17.5,35 and 70 mg/L(P<0.01).CONCLUSION:SBF has an obvious protective effect on damaged astrocytes induced by Aβ25-35,suggesting that SBF may be helpful for the treatment of Alzheimer disease.
Alzheimer disease;Astrocytes;Scutellaria barbata flavonoids;Nitric oxide synthase;Heat-shock protein 70;Apolipoproteins E
R363
A
10.3969/j.issn.1000-4718.2014.02.031
1000-4718(2014)02-0359-06
2013-07-05
2013-12-04
河北省自然科学基金资助项目(No.C2009001007);河北省中医药管理局资助项目(No.05027)
△通讯作者Tel:0314-2290616;E-mail:shangyz1018@sina.com
