门静脉积气的超声表现(6例报道及文献复习)
2014-11-08周春周建桥詹维伟周伟顾炫
周春 周建桥 詹维伟 周伟 顾炫
上海交通大学医学院附属瑞金医院超声科,上海 200025
门静脉积气(portal venous gas,PVG)不是一种疾病,而是伴随一些疾病出现的征象。当PVG继发于肠道缺血和坏死性病变时,具有高度危险性,病死率较高,需引起高度重视。研究证实超声对PVG非常敏感,是诊断PVG的良好方法[1-2]。目前国内这方面的报道较少[3-6]。本文报告6例PVG,探讨超声诊断PVG的价值及其临床意义。
1 资料和方法
1.1 研究对象
选取2005年1月—2007年7月在本院行急诊超声检查的PVG患者共6例,其中男性、女性各3例;年龄45~79岁,平均(54.67±12.67)岁。2例为肠系膜上动脉栓塞伴肠坏死;2例为小肠梗阻,其中1例伴局部肠管坏死,阑尾坏疽,头部穿孔;1例为坏疽性阑尾炎;1例为胆总管结石伴急性胆道感染。
1.2 仪器和方法
采用GE公司Logiq9,PHILIPS公司HDI 5000、Envisor,ESAOTE公司MyLab 30及ALOKA公司SSD 1700彩色多普勒超声诊断仪,凸阵探头,频率2.5~7.0 MHz。用灰阶超声多切面扫查肝脏,重点观察肝内门静脉分支及门静脉主干,同时观察肝静脉、下腔静脉、脾静脉、肠系膜上静脉、肠系膜上动脉;用脉冲多普勒检测门静脉、肠系膜上动脉血流。
2 结果
6例患者皆在门静脉内探及气体强回声。从气体强回声的分布部位看, 5例患者气体出现在肠系膜上静脉、门静脉主干及分支管腔内,1例肠系膜动脉栓塞患者气体仅出现在门静脉近肝包膜下小分支内。从气体强回声的形态看,可表现为点状、短线状及条索状。从气体强回声的流动性看,5例患者可见强回声随血流向肝脏移动;1例患者积气仅局限于门静脉近肝包膜下小分支内的,其气体未见明显流动征象。从气体强回声的数量看,不同患者门静脉内强回声的数量相差非常显著。4例患者门静脉分支内强回声数量甚多,分布范围甚广,表现为肝左右叶弥漫性分布不均匀斑点状、短线状强回声,并可在门静脉分支,特别是在左支内可见气体出现大量积聚现象,表现为条索状强回声,伴振铃样伪像(图1),强回声分布区域正常肝实质回声无法显示(图2);1例患者积气仅局限于门静脉近肝包膜下小分支内;1例患者仅在门静脉主干及大分支内见数个强回声点快速移动,肝实质回声无改变。6例患者肝静脉、下腔静脉及脾静脉内皆未见明显异常回声。4例患者见胃肠扩张,肠道内大量气体强回声。
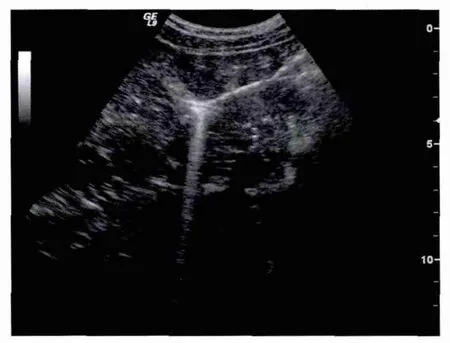
图1 门静脉积气声像图(一)
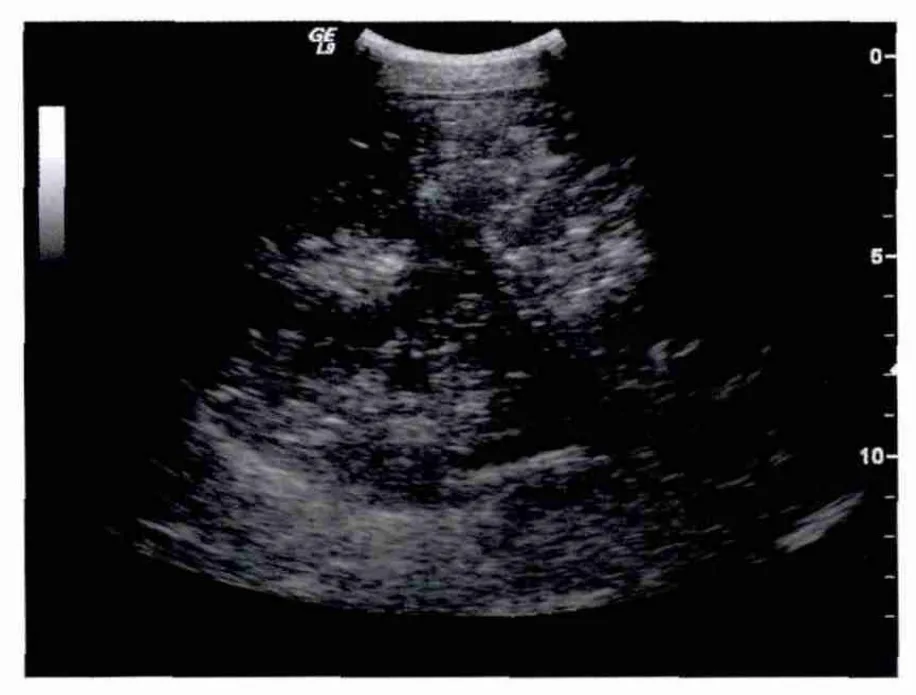
图2 门静脉积气声像图(二)
脉冲多普勒显示,2例患者门静脉血流流速曲线正常,4例多普勒流速曲线上可间断出现高强度毛刺状信号(图3)。2例肠系膜上动脉栓塞患者中,1例因肠道积气明显致肠系膜上动脉无法显示;另1例则见管腔内充满实性低回声,彩色多普勒血流成像(color Doppler flow imaging,CDFI)动脉主干内未能探及明显血流信号。

图3 门静脉积气血流流速曲线
2例肠系膜上动脉栓塞伴肠坏死患者皆未能治愈而死亡。其中1例急诊手术发现肠系膜动脉栓塞,搏动消失,全部小肠、升结肠和横结肠坏死发黑;1例行CT扫描发现肠系膜上动脉栓塞、肠腔扩张、肠壁囊样积气症,入院后行保守治疗36 h病情未明显缓解,血便数次,主动要求出院,出院诊断“肠系膜上动脉栓塞,肠坏死”,后随访证实患者死亡。2例小肠梗阻患者中,1例术中发现梗阻空肠高度扩张,呈酱紫色,因消化液误吸,术后发生严重肺部感染,呼吸衰竭而死亡;1例术中见局部小肠肠管变黑坏死,阑尾坏疽,头部穿孔,术后患者康复。1例坏疽性阑尾炎患者行阑尾切除术,术后康复良好。1例胆总管结石伴急性胆道感染患者行胆肠吻合术,术后恢复良好。
3 讨论
PVG是一种罕见征象,最常见于肠缺血和坏死[7],其他还包括:①消化道病变,如胃肠道扩张或溃疡、急性阑尾炎、肥厚性幽门狭窄、克罗恩病和溃疡性结肠炎等;②非消化道病变,如休克、败血症、腹部脓肿或感染、腹部钝器伤、肝脏或心脏移植术后等;③另约15%的PVG为特发性[8-13]。
PVG的发生机制较复杂,一种或多种因素的协同作用可导致这种征象:①肠壁黏膜发生破坏性改变,气体通过肠壁进入肠系膜静脉。②消化管内压力增高,迫使气体进入门静脉循环。③产气细菌感染。肠壁细菌感染产生气体进入门静脉系统;身体其他部位感染的细菌到达肠壁,在门静脉系统生成或促使气体生成;脾脏的产气细菌感染,气体经脾静脉流入门静脉[1,4,14-16]。
本组6例PVG患者中,5例为肠道病变所致,与文献报道PVG多见于消化道病变相符[7,11]。该5例患者的消化道异常包括肠道坏死、肠梗阻、阑尾坏疽及胃扩张等,这些因素导致肠黏膜破坏,消化管内压力增高,使肠道气体进入门静脉系统。胆管感染导致PVG有数例报道[17-20],其产生机制尚未明了,有学者认为这可能与胆管感染所致败血症有关[19]。本组1例急性胆管感染患者出现PVG的原因也难以明确,是否有产气细菌感染参与,因未做细菌培养,故难以定论。
PVG的典型实时超声表现是在门静脉管腔内显示有小的点状强回声顺血液流动方向往肝脏移动[7]。本组5例患者可见门静脉管腔内气体流动征象,但1例气体相对固定在肝包膜下门静脉小分支内而无流动感,可能由于邻近肝包膜的门静脉分支血流速度较低,加上气体受阻于肝血窦前的终末门微静脉所致。此时需注意与胆管积气鉴别,后者无流动现象。PVG在积气数量较少时,只在门静脉内观察到点状强回声。随着积气量增加,气体可积聚于门静脉分支内,形成条索状强回声,积聚在细小分支内,可导致肝脏回声不均。气体积聚还有一个特点,即门静脉左支气体的积聚最明显,这是由于平卧位时肝左叶在空间上处于最高位置,利于低比重的气体积聚。气体在肝内门静脉各分支积聚的现象可从以下两方面来解释:①由于自由气泡的径线较大,无法通过肝血窦,所以在肝小叶间的门静脉细小分支内积聚。②气体的积聚速度大于气体在血液中的溶解速度。正是由于自由气泡无法通过肝血窦,所以本组6例患者的肝静脉、下腔静脉皆未出现气体回声。
6例PVG患者中,有4例门静脉主干血流流速曲线上间断出现高强度毛刺状信号,这是由于在处理这些气体强回声信号时,多普勒接收器“过载”产生的伪像[21];1例可能由于气泡数目稀少,加上密度较低而分布在靠近前壁的静脉管腔处,而取样时取样容积过小且置于门静脉中央,故未能检测到气体产生的毛刺状多普勒信号;另1例则气体仅分布于肝包膜下门静脉分支内,故主干未探及毛刺状信号。
PVG主要需与胆管积气相鉴别,可从两方面进行评估:①胆管积气的气体常堆积在肝门区域,而PVG则分布在肝脏边缘部位[16]。这是因为门静脉内的气体可随血流移动,被携带至肝脏边缘部位。②胆管积气的位置相对较固定,通常不发生快速流动现象;而门静脉的气体随血流流动。但本组1例PVG未出现流动征象,增加了鉴别诊断的难度。门静脉内的高回声点有时还可能是聚集的红细胞,此时可以从3个方面来鉴别:①聚集的红细胞回声强度要比气体低。②气泡由于比重很低,故仰卧位时气体强回声点易出现在管腔靠近静脉前壁处,聚集红细胞无这种征象。③流动气泡在脉冲多普勒检测时可出现特征性的锐利尖峰毛刺状信号。
PVG预后取决于患者的基础病变和PVG的发病机制。当PVG是肠道缺血和坏死所致时,一般需手术治疗,预后通常较差。Bloom等[15]报道,当病因是肠缺血坏死时,其病死率超过90%。本组2例肠系膜上动脉栓塞患者皆未能治愈而死亡。本组1例肠梗阻患者虽然局部小肠肠管变黑坏死,但术后患者康复良好。这与Wiesner等[22]的研究结论相符,后者研究发现肠梗死累及一个肠段时病死率仅为14%。本组另1例肠梗阻患者因术中消化液误吸,术后并发肺部严重感染而死亡,其死亡原因与肠梗阻本身应无直接关系。1例坏疽性阑尾炎患者、1例急性胆管感染患者皆得以康复,这也验证了以往研究结果,即非肠道缺血性病变导致的PVG往往预后良好,生存率可高达71%[16]。
总之,超声是检测PVG的可靠方法,可为临床急诊及时决策提供重要依据。
[1]CHEVALLIER P, PETEN E, SOUCI J, et al.Detection of portal venous gas on sonography, but not on CT [J].Eur Radiol, 2002, 12(5): 1175-1178.
[2]SHAH P A, CUNNINGHAM S C, MORGAN T A, et al.Hepatic gas: widening spectrum of causes detected at CT and US in the interventional era [J].Radiographics,2011, 31(5): 1403-1143.
[3]崔立刚,王金锐,王淑敏,等.肝门静脉积气的超声表现及临床意义[J].中国医学影像技术, 2005, 21(8):1242-1244.
[4]李汇文, 王建华, 杨敬英, 等.超声诊断脾转移瘤感染积气并门静脉积气1例[J].中国超声医学杂志, 2002,18(8): 638.
[5]李林, 王世城, 裴广华, 等.门静脉积气的超声表现和临床意义[J].临床儿科杂志, 2008, 26(7): 621-623.
[6]于洪娜, 张秀珍.门静脉积气超声表现1例[J].中华超声影像学杂志,2004, 13(8): 625.
[7]PELOPONISSIOS N, HALKIC N, PUGNALE M, et al.Hepatic portal gas in adults: review of the literature and presentation of a consecutive series of 11 cases [J].Arch Surg, 2003, 138(12): 1367-1370.
[8]BHARGAVAP,PARISIM.Gastric pneumatosis and portal venous gas: benign findings in hypertrophic pyloric stenosis [J].Pediatr Radiol, 2009, 39(4): 413.
[9]WU C H, CHEN C J, TSAI S J, et al.Hepatic portal venous gas after shock episode [J].J Emerg Med, 2011,40(4): 439-440.
[10]TRITOU I, MEGREMIS S, STEFANAKI E, et al.Sonographic detection of transient gas in the portal vein in an infant following abdominal surgery: a possible sign of adhesive small bowel obstruction [J].J Clin Ultrasound,2012, 40(5): 306-309.
[11]KINOSHITA H, SHINOZAKI M, TANIMURAH,et al.Clinical features and management of hepatic portal venous gas: four case reports and cumulative review of the literature [J].Arch Surg, 2001, 136(12): 1410-1414.
[12]LEWIN M, POCARD M, CAPLIN S, et al.Benign hepatic portal venous gas following caustic ingestion [J].Eur Radiol, 2002, 12(Suppl 3): S59-S61.
[13]LIM JE,DUKE GL,EACHEMPATI SR.Superior mesenteric artery syndrome presenting with acute massive gastric dilatation, gastric wall pneumatosis, and portal venous gas [J].Surgery, 2003,134(5): 840-843.
[14]DORDELMANNM, RAU G A,BARTELS D, et al.Evaluation of portal venous gas detected by ultrasound examination for diagnosis of necrotis in genterocoli-tis [J].Arch Dis Child Fetal Neonatal Ed, 2009, 94(3):F183-F187.
[15]BLOOM R A, LEBENSART P D, LEVY P, et al.Survival after ultrasonographic demonstration of portal venous gas due to mesenteric artery occlusion [J].Postgrad Med J,1990, 66(772): 137-139.
[16]FABERMAN R S, MAYO-SMITH W W.Outcome of 17 patients with portal venous gas detected by CT [J].Am J Roentgenol, 1997, 169(6): 1535-1538.
[17]DENNIS M A, PRETORIUS D, MANCO-JOHNSON M L, et al.CT detection of portal venous gas associated with suppurative cholangitis and cholecystitis [J].AJR Am J Roentgenol, 1985, 145(5): 1017-1018.
[18]HOU S K, CHERN CH,HOW CK, et al.Hepatic portal venous gas: clinical significance of computed tomography findings [J].Am J Emerg Med, 2004, 22(3):214-218.
[19]LEE C S,KUO Y C,PENG SM, et al.Sonographic detection of hepatic portal venous gas associated with suppurative cholangitis [J].J ClinUltrasound,1993,21(5):331-334.
[20]TSUBONO T,SATOK,FUKUDAM.Hepatic portal venous gas associated with cholangitis following pancreaticoduodenectomy:report of a case [J].Surg Today, 1994, 24(4): 375-377.
[21]LAFORTUNE M, TRINH B C, BURNS P N, et al.Air in the portal vein: sonographic and Doppler manifestations[J].Radiology, 1991, 180(3): 667-670.
[22]WIESNERW,MORTELEKJ,GLICKMAN J N, et al.Pneumatosis intestinalis andportomesenteric venous gas in intestinalischemia: correlation of CT findings with severity of ischemia and clinical outcome[J].Am J Roentgenol, 2001, 177(6): 1319-1323.
