动态三维超声造影在肝癌消融疗效评估中的初步研究
2014-11-08王彦冬经翔丁建民赵新民张倩华
王彦冬 经翔 丁建民 赵新民 张倩华
天津市第三中心医院超声科,天津市人工细胞重点实验室,天津 300170
肝癌经皮消融是一种安全有效的局部微创治疗方法,在临床广泛应用[1-2]。超声作为理想的引导治疗手段,具有定位准确、实时监控等优点,已成功应用于其疗效评价[3-4]。但由于消融治疗后残癌多位于肿瘤边缘,而造影时动脉期时相短,很难在短时间内兼顾整个消融区边缘;同时,残癌形态多不规则,难以在短时间内获得良好的空间信息。本研究旨在评价动态三维超声造影(three-dimensional contrast-enhanced ultrasound,3D-CEUS)对消融局部疗效的诊断效能。
1 资料和方法
1.1 研究对象
回顾性分析2011 年10月—2012年9月因肝细胞癌(hepatocellular carcinoma,HCC)在本院行超声引导经皮消融治疗的75例患者共89个病灶,全部经穿刺活检得到病理证实。其中男性58例、女性27例;年龄29~84岁,平均(57.5±13.5)岁。肿瘤最大径1.2~6.3 cm,平均(3.7±1.3)cm。施行经皮射频或微波消融57例(68个病灶)、无水乙醇消融18例(21个病灶)。全部病例在消融治疗后1个月均接受3D-CEUS和对比增强CT(contrastenhanced CT,CECT)或对比增强MRI(contrastenhanced MRI,CEMRI)检查。
1.2 仪器和方法
应用PHILIPS iU 22彩色超声诊断仪,X6-1 xMATRIX全电子矩阵相控偏转三维容积探头,频率为1.0~6.0 MHz。超声造影的机械指数为0.05~0.09,用于动态3D-CEUS。造影剂为SonoVue(意大利Bracco公司),59 mg干粉剂中加入生理盐水5 mL振荡溶解稀释,配成容积浓度为8μL/mL的SF6微泡混悬液。
先按常规对肝脏及病灶行二维灰阶检查,然后进入动态3D-CEUS模式,选择最佳声窗,调节取样框及取样角度至合适范围,经肘部浅静脉注入1.0~1.5 mL造影剂并在注入开始时计时,在第10秒嘱患者屏气,同时启动3D-CEUS采集数据,连续采集4~6 min以记录完整时相。参照《欧洲临床超声造影指南(2008)》的分期,将整个动态3D-CESU过程分为动脉期(注射造影剂10~20s开始,25~35 s结束),门静脉期(30~45 s开始,120 s结束),延迟期(120 s开始,微泡消失结束)。
1.3 图像处理和分析
使用PHILIPS公司提供的Qlab专用图像处理软件,对所采集动态3D-CEUS 的DICOM数据进行分析。三维立体检测消融灶的增强水平、增强形态及增强随时间的变化。
1.4 结果判定
CECT/CEMRI以消融灶整体无增强判定为完全消融,表现为完全的低密度或低信号区。如消融灶内局部出现动脉期高增强,并在门静脉期增强减退,则判定为消融不全,即有癌灶残留[5]。3DCEUS以消融灶整体无增强呈边界清晰的空洞样改变判定为完全消融。如消融灶局部出现动脉期结节状、新月状高增强,并在门静脉期消退,则判定为消融不全[6]。以CECT/CEMRI的判定结果为标准,用诊断性试验检测动态3D-CEUS对消融疗效的诊断效能。
2 结果
本组75例HCC共89个结节,消融治疗后1个月的CECT/CEMRI检查显示,80.9%(72/89)的消融灶无增强,判定为肿瘤得到完全消融。动态3DCEUS检查显示,82.0%(73/89)的消融灶在造影显像全过程中未见增强表现,呈边界清晰空洞样改变,符合完全消融。CECT/CEMRI显示,19.1%(17/89)的肿瘤边缘部分在动脉期可见结节状高增强,门静脉期消退,诊断为癌灶残留。3D-CEUS显示,18.0%(16/89)的肿瘤于动脉期在边缘处见结节状、新月状高增强,至门静脉期消退为低增强,提示癌灶残留(图1、2)。以CECT/CEMRI作为金标准,诊断性试验表明CEUS判定消融后癌灶残留的灵敏度、特异度、阳性预测值、阴性预测值及准确率分别为88.2% (15/17)、98.6% (71/72)、93.8%(15/16)、97.3% (71/73)、96.6% (86/89)。动态3DCEUS出现假阴性2例:1例消融灶位于近膈顶处显示困难,1例消融灶范围较大而显示不全。假阳性1例,表现为动脉期消融灶边缘环状高增强,门静脉期及延迟期略减退为稍低增强。
3 讨论
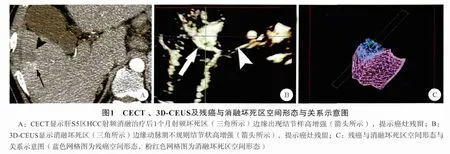
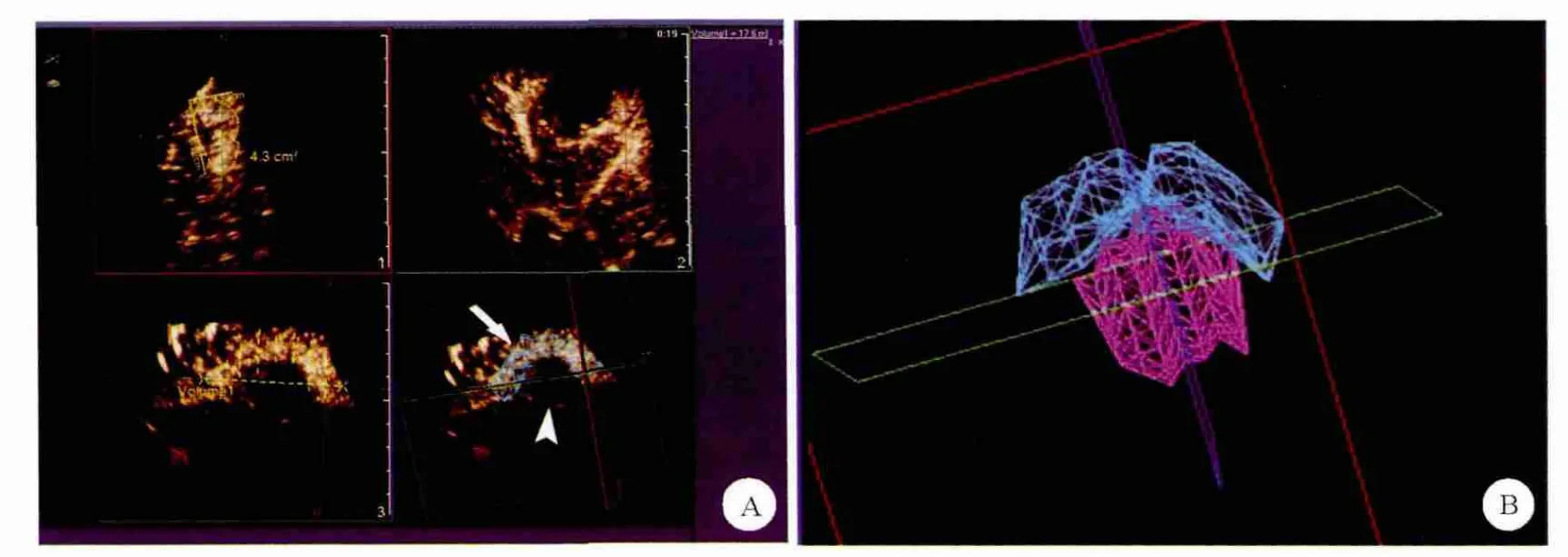
图2 3D-CEUS及残癌与消融坏死区空间形态与关系示意图
超声引导下肝癌经皮热消融或化学消融是目前广泛应用的肝癌非手术治疗方法,影响其疗效的因素仍是术后肿瘤残留与复发[2]。尽早发现肿瘤残留与复发,并及时补充相应治疗是提高疗效的关键。影像学方法在评价和随访肝肿瘤射频消融治疗中发挥着重要作用。CECT或CEMRI显示无强化被公认为判断消融治疗后肿瘤完全坏死的金标准[5,7]。近年来,超声造影在消融治疗效果评价中的作用已得到广泛认可。但超声造影仅是从一个断面对消融灶进行观察,其整体观察需超声医师通过连续侧动探头以获取不同断面的信息在大脑中重建后获得,容易忽略切面以外异常血供信息而导致误诊。
3D-CEUS融合了2D-CEUS与三维超声成像技术的优势,可从立体角度动态、全程获取感兴趣区血流灌注信息。已有学者将其应用于肝肿瘤的诊断[8-9]。但以往研究多采用静态3D-CEUS,所显示的是超声造影某一时刻肿瘤内血流灌注瞬间的三维图像,图像质量水平与影像采集开始时间及采集速度密切相关,操作难度较大,可能需多次重复注药和采集才能获得理想图像。本研究采用最新动态3D-CEUS技术,可连续动态采集整个造影剂灌注过程,同步生成一系列连续的动态3D-CEUS图像。将三维超声的空间显示优势与超声造影的实时显示优势相互结合,并将2D-CEUS的实时平面造影拓展为动态立体造影,不同时相会出现与2D-CEUS相匹配的立体造影图像,有效弥补了2D-CEUS及静态3D-CEUS的不足,对提高消融灶边缘异常血供的显示及诊断准确率具有实际意义。
本研究显示,消融治疗后残癌动态3D-CEUS主要表现为动脉期消融灶边缘不规则结节状、新月状高增强,门静脉期、延迟期造影剂消退呈低增强,这与HCC以肝动脉供血为主的病理特点有关。对残癌空间形态显示以动脉期效果最好,立体感最强,这与HCC的超声造影血流灌注特征相关。通常动脉期增强早于肝实质,与肝实质的回声反差最大,故立体感效果最好。
分析动态3D-CEUS对89个肝癌消融病灶局部疗效的判定结果,诊断性试验显示动态3D-CEUS与CECT或CEMRI具有很高的一致性,3D-CEUS判断癌灶局部残留具有较高的灵敏度、特异度、阳性预测值、阴性预测值和准确率,显示3D-CEUS在肿瘤消融局部监测方面与CECT或CEMRI具有同等的判断效能。3D-CEUS与CECT或CEMRI相比,还具有以下优点:从三维视角立体显示整个肿瘤边缘的血流动态灌注情况,更直观、更形象,造影过程无放射性损伤,过敏发生率极低,对心、肾功能无影响,操作简便快捷,费用相对低廉。
动态3D-CEUS在本研究中出现2例假阴性,其中1例由于肿瘤靠近膈顶而超声显示困难,另1例则由于消融灶较大而显示不全,反映了动态3D-CEUS的不足,同时也提示在这种情况下更适合用CECT或CEMRI来评估。1例假阳性CECT诊断为炎症反应带,经6个月随访观察无肿瘤进展。治疗后消融灶周围的炎症充血反应多在1个月内消失,但少数炎症反应会持续更长时间。有文献报道炎症性病变可表现出类似恶性肿瘤的增强模式,即动脉期高增强,门静脉期或延迟期增强消退[10]。这种情况会引起动态3D-CEUS的误判,必要时可对增强部分进行穿刺活检以避免漏诊。
此外,我们通过临床实践对如何获得动态3D-CEUS高质量图像有一些体会:①进行3D-CEUS前,利用常规超声选择最佳透声窗,通过侧动探头观察肿瘤是否能完整显示和包纳;②在对图像进行后处理时,要适当调节阈值、透明度等成像参数,如阈值调节不宜过高或过低,过高会丢失部分容积信息,过低则噪声过多影响诊断;③通过旋转、切割全方位观察滋养动脉分布情况,避免因图像前后重叠交错而遗漏诊断信息。
总之,动态3D-CEUS技术在评价消融治疗后近期疗效方面与CECT或CEMRI的价值相当,可直观、动态和有效显示消融治疗后残癌的立体血流灌注模式及与消融坏死区之间的空间关系,为进一步提高残癌检出的准确率提供了新的手段。但本研究仅为初步临床应用,尚需积累更多经验进行深入研究。
[1]经翔, 丁建民, 杜智, 等.射频消融治疗复发性肝癌的临床疗效 [J].中华消化外科杂志, 2009, 8(6): 473-474.
[2]TOMBESIP,DI VECEF, SARTORI S.Resection vs thermal ablation of small hepatocellular carcinoma:What’s the first choice? [J].World J Radiol, 2013, 28,5(1): 1-4.
[3]经翔, 丁建民, 王彦冬, 等.超声造影在肝癌射频消融治疗中的临床价值 [J].中国超声医学杂志, 2010, 26(8):734-737.
[4]SPOREA I, BADEA R, MARTIE A, et al.Contrast enhanced ultrasound for the evaluation of focal liver lesions indailypractice.Amulticentre study[J].Med Ultrason, 2012, 14(2): 95-100.
[5]INOUE T, KUDO M, HATANAKA K, et al.Usefulness of contrast-enhanced ultrasonography to evaluate the post-treatment responses of radiofrequency ablation forhepatocellular carcinoma: comparison with dynamic CT[J].Oncology, 2013, 84(Suppl 1): 51-57.
[6]LUO W, NUMATA K, MORIMOTO M, et al.Role of Sonazoid-enhanced three-dimensional ultrasonography in the evaluation of percutaneous radiofrequency ablation of hepatocellular carcinoma [J].Eur J Radiol, 2010, 75(1):91-97.
[7]SALVAGGIO G, CAMPISI A,LO GRECO V, et al.Evaluation of posttreatment response of hepatocellular carcinoma: comparison of ultrasonography with secondgeneration ultrasound contrast agent and multidetector CT [J].Abdom Imaging, 2010, 35(4): 447-453.
[8]LUO W, NUMATA K, MORIMOTO M, et al.Threedimensional contrast-enhanced sonography of vascular patterns of focal liver tumors:pilot study of visualization methods [J].AJR Am J Roentgenol, 2009, 192(1):165-173.
[9]毛丽娟, 王文平, 丁红, 等.肝肿瘤动态三维超声造影与二维超声造影的比较研究 [J].中华超声影像学杂志,2012, 21(2): 133-137.
[10]吕明德, 谢晓燕, 徐辉雄, 等.肝局灶性病变超声造影:参照欧洲指南1015例临床报告[J].中华超声影像学杂志, 2006, 15(6): 431-434.
