低剂量γ射线照射后的大鼠血清代谢组学研究
2014-11-05何颖沈先荣侯登勇刘玉明蒋定文王庆蓉李珂娴陈伟钱甜甜
何颖,沈先荣,侯登勇,刘玉明,蒋定文,王庆蓉,李珂娴,陈伟,钱甜甜
随着核能技术的发展和广泛应用,电离辐射的危害越来越受到重视。研究表明,低剂量电离辐射暴露的人群和概率远大于大剂量照射事件或事故,国内外放射生物学家数十年来一直致力于低水平电离辐射暴露后的生物学效应和健康效应研究,但目前仍然存在较多争议[1-5]。辐射流行病学调查发现,长期受到低剂量电离辐射的人员会出现头晕、乏力、记忆力减退等症状[6]。电离辐射可诱导机体分子水平的变化,引起代谢产物异常,因此寻找敏感的生物标志物对揭示电离辐射损伤的机制具有重要意义。大剂量电离辐射诱导相关代谢物的变化已有较多研究,但关于低剂量电离辐射对代谢产物的影响鲜见报道[7-10]。代谢组学技术可通过对生物体液、组织中的内源性代谢产物图片进行分析,研究机体代谢网络在正常状态、疾病或药物作用下的变化规律[11-14]。本研究应用核磁共振(NMR)技术检测低剂量电离辐射后大鼠血清代谢谱的变化,寻找低剂量电离辐射敏感的生物标志物并探讨其损伤机制,为低剂量电离辐射的危害评估和防护提供依据。
1 材料与方法
1.1 仪器与试剂 INOVA 600MHz超导核磁共振谱仪(Varian Inc.,美国),配备脉冲场梯度,带梯度场的三共振探头。MiniSpin Plus离心机(Eppendorf,德国)。重水(D2O,99.9%,Cambridge Isotope Laboratories Inc.,美国)。3-三甲基硅烷基-2,2,3,3-四氘代丙酸钠(TSP,Merck公司,德国)。
1.2 动物分组与处理 雄性成年SD大鼠16只(购自第二军医大学动物中心),体重200~250g,随机均分为正常对照组和照射组。照射组采用累积照射法,以60Co γ射线每天照射1h,照射剂量率为72mGy/h,动物距离钴源中心2.43m。连续照射7d(累积剂量0.5Gy)。正常对照组不进行照射处理。
1.3 血清样本制备 照射结束后剖杀动物,腹主动脉取血,4℃下3000r/min离心10min,取上清(即为血清)。取1.5ml离心管,向管中依次加入含100μl TSP的重水溶液(1mg/ml)、300 μl血清以及200μl重水(D2O),充分震荡混匀后,14 000r/min离心10min,取550μl上清加入5mm核磁共振管中待用。
1.4 NMR数据采集 采用弛豫编辑脉冲序列(CPMG脉冲序列,-RD-90°-(-180°-)n-ACQ)和扩散编辑脉冲序列(LEDbpp脉冲序列,-RD-90°-G1-180°-G1-90 °-T-90°-G1-180 °-G1-90°- -90°-ACQ)采集血清样本数据,分别观测血清中的小分子代谢物和脂类代谢产物。CPMG实验的谱宽为8000Hz,采样点数64k,采样时间4s,累加次数64次, τ为200μs,2nτ为320ms,弛豫延迟为2s,其间采用低功率脉冲对水峰进行预饱和。LEDbpp实验的谱宽为8000Hz,采样点数64k,采样时间4s,累加次数64次,扩散时间为100ms,τ为5ms,弛豫延迟为2s,其间采用低功率脉冲对水峰进行预饱和。在对自由感应衰减(free induction decay,FID)信号数据进行填零,分别加上1Hz(CPMG实验)和3Hz(LEDbpp实验)的线增宽因子后,进行傅立叶变换,得到核磁共振氢谱(1H NMR)图。以乳酸甲基信号双峰的左侧峰定标为1.33。
1.5 NMR数据处理 对所得NMR数据经傅立叶变换得到谱图,然后调整相位并进行基线校正。对CPMG数据,将0.4~4.4范围内的谱按照每段0.04ppm进行分段积分。对LED数据,将0~6.0范围内的谱按照每段0.04ppm进行分段积分,并将4.6~5.0之间的谱排除。将积分按每张谱的总积分强度归一化。
1.6 统计学处理 将检测所得数据输入SIMCA-P+软件(V10.04,Umetrics,Ume,Sweden)进行多元统计分析。数据采用平均中心化(mean centering)或Pareto标度化(Pareto scaling)进行预处理之后采用PCA分析。必要时可对数据采用正交信号校正(orthogonal signal correction,OSC)处理,然后再进行PLS分析。分析结果以得分图(score plot)和载荷图(loading plot)的形式表示。
2 结 果
2.1 大鼠血清样本的1H NMR图谱 正常对照组和照射组大鼠血清样本的弛豫编辑和扩散编辑1H NMR谱图中波峰有明显差异,提示两组大鼠血清代谢产物成分有明显差异(图1、2)。
2.2 CMPG1H NMR模式识别 正常对照组和照射组大鼠血清样品的CMPG1H NMR图谱的正及信号校正-偏最小=乘法(OSC-PLS)分析结果如图3。模型参数R2X(cum)=89.8%,R2Y(cum)=72.7%,Q2(cum)=64.3%。对应的得分图(图3A)的积分值集中分布于散点图的椭圆内(95%可信区间),说明模型拟合效果好,两组的分布区域基本能区分开来。根据载荷图(图3B)结合原始图谱,可以得到差异代谢物及其NMR峰化学位移值,结果显示,与正常对照组比较,照射组大鼠血清中脂质、葡萄糖、肌酸、甘氨酸/葡萄糖含量增加,乳酸、苏氨酸/脂质、丙氨酸含量降低(表1)。
2.3 LED1H NMR模式识别 正常对照组和照射组大鼠血清样品的LED1H NMR图谱的OSCPLS分析结果如图4。模型参数R2X(cum)=81.3%,R2Y(cum)=98.2%,Q2(cum)=96.2%。对应的得分图(图4A)的积分值集中分布于散点图的椭圆内(95%可信区间),说明模型拟合效果好,两组的分布区域完全分开。根据载荷图(图4B)结合原始图谱,可以得到差异代谢物及其NMR峰化学位移值,结果显示,与正常对照组比较,照射组大鼠血清中高密度脂蛋白、低密度脂蛋白、极低密度脂蛋白/低密度脂蛋白、不饱和脂肪酸含量增加,N-乙酰糖蛋白1、N-乙酰糖蛋白2、饱和脂肪酸和磷脂酰胆碱含量降低(表2)。

图1 大鼠血清样本弛豫编辑(CPMG)1H NMR图谱Fig. 1 1H NMR CPMG spectra of rats serum
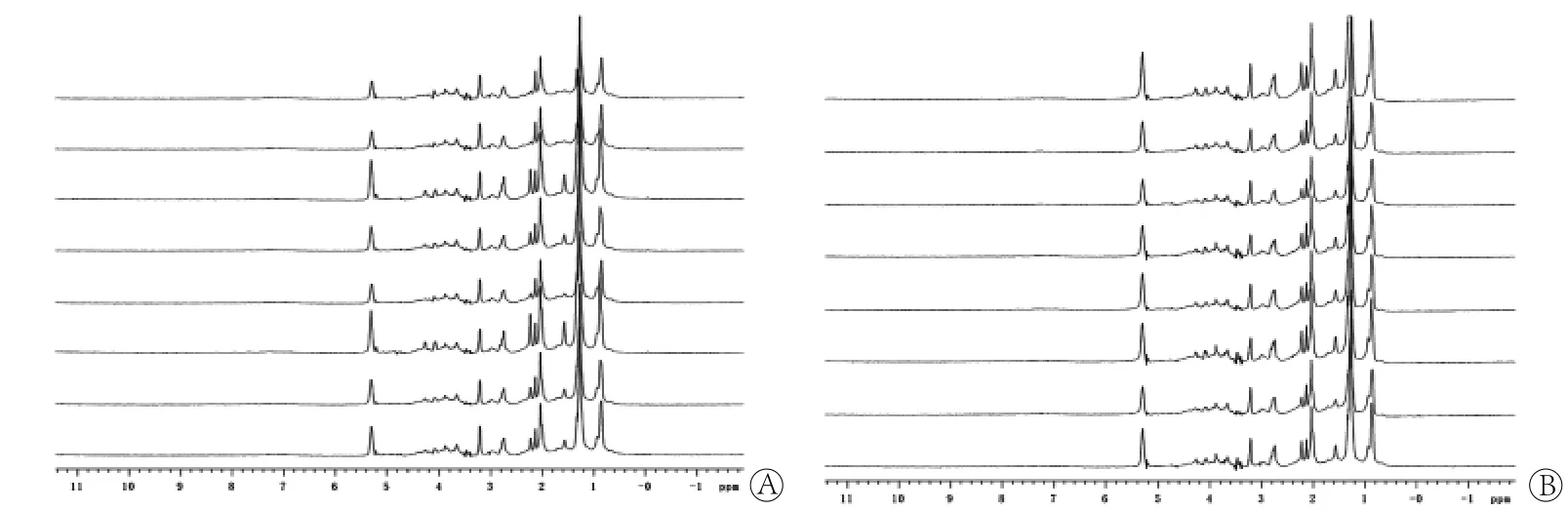
图2 大鼠血清样本扩散编辑(LED)1H NMR图谱Fig. 2 1H NMR LED spectra of rats serum

图3 照射组(■)和正常对照组(▲)大鼠血清1H NMR CPMG的OSC-PLS分析结果Fig. 3 OSC-PLS analysis of serum from irradiated group (■) and control group (▲) based on 1H NMR CPMG spectra
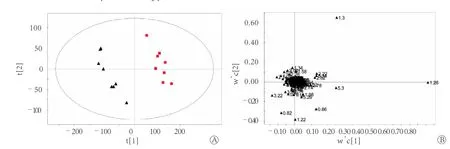
图4 照射组(■)和正常对照组(▲)血清1H NMR LED的OSC-PLS分析结果Fig. 4 OSC-PLS analysis of serum from irradiated group (■) and control group (▲) based on 1H NMR LED spectra

表1 大鼠血清小分子代谢物浓度变化Tab.1 Change of micromolecular metabolites in rats serum
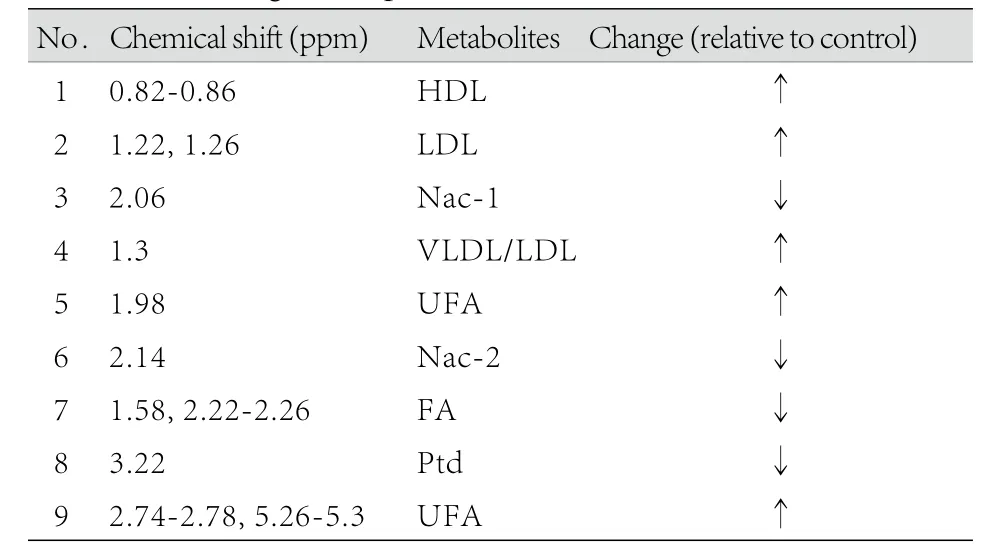
表2 大鼠血清脂类代谢物浓度变化Tab.2 Changes of lipid metabolites in rats serum
3 讨 论
本研究1H NMR模式识别分析发现,正常对照组与低剂量(0.5Gy)γ射线照射组血清代谢物谱存在显著差异,两组样本能较好分开,说明血清代谢组学分析能够较好地反映低剂量电离辐射对机体产生的生物效应,可作为开展低剂量电离辐射生物效应和分子机制研究的有效手段。
丙氨酸是体内重要的非必需氨基酸,有研究显示丙氨酸是淋巴细胞再生及免疫过程重要的参与者[15]。N-乙酰糖蛋白是急相反应时血清中检测到的糖蛋白,其含量变化反映了免疫系统的炎症反应水平[16-18]。研究发现,辐照后大鼠血清中丙氨酸、N-乙酰糖蛋白含量降低,提示辐射造成了机体的免疫功能受损。
乳酸是糖酵解过程的正常代谢产物,在缺氧条件下在乳酸脱氢酶的催化下由丙酮酸生成,维持机体正常的能量代谢[19]。肌酸是体内细胞能量代谢的中间产物。辐照后乳酸和肌酸含量的变化提示机体能量代谢异常。
磷脂酰胆碱亦称卵磷脂,在体内可将血液中的胆固醇和脂肪酸乳化为极细的颗粒后从血管中排出,有助于恢复血管弹性、保持血流畅通,被誉为“血管清道夫”。辐照导致大鼠血清中磷脂酰胆碱含量降低,提示机体胆固醇和脂肪酸代谢受损。辐照后脂质、葡萄糖、高密度脂蛋白、低密度脂蛋白、极低密度脂蛋白/低密度脂蛋白、不饱和脂肪酸含量增加,饱和脂肪酸含量降低,进一步提示机体糖代谢、脂代谢出现异常。
综上所述,本研究结果提示,低剂量电离辐射对机体的作用可能与免疫功能受损及能量代谢、糖代谢和脂类代谢异常有关,长期低剂量电离辐射可能危害健康,应采取积极的防护措施,重点关注职业暴露人群的免疫系统功能及代谢类疾病分布情况。
[1]Bonner WM. Low-dose radiation: thresholds, bystander effects,and adaptive responses[J]. Proc Natl Acad Sci USA, 2003,100(9): 4973-4975.
[2]Prasad KN, Cole WC, Hasse GM. Health risks of low dose ionizing radiation in humans: a review[J]. Exp Biol Med, 2004,229(5): 378-382.
[3]Morgan WF. Non-targeted and delayed effects of exposure to ionizing radiation: I. Radiation-induced genomic instability and bystander effects in vitro, clastogenic factors and transgenerational effects[J]. Radiat Res, 2003, 159(5): 581-596 .
[4]Strzelczyk JJ, Damilakis J, Marx MV, et al. Facts and controversies about radiation exposure, part 2: low-level exposures and cance r risk[J]. J Am Coll Radiol, 2007, 4(1): 32-39.
[5]Preston RJ. Update on linear non-threshold dose-response model and implications for diagnostic radiology procedures[J]. Health Phys, 2008, 95(5): 541-546.
[6]Yu YH, Gao ZX, Zhang FQ. Investigation of biological effects of professional ionizing radiation exposure[J]. Chin J Radiol Health, 2003,12(3): 185-186.[于永红, 高忠贤, 张方清. 电离辐射对职业照射生物效应影响的调查研究[J]. 中国辐射卫生, 2003, 12(3): 185-186.]
[7]Wolfram RM, Budinsky AC, Palumbo B, et al. Radioiodine therapy induces dose-dependent in vivo oxidation injury:evidence by increased isoprostane 8-epi-PGF(2 alpha)[J]. J Nucl Med, 2002, 43(9): 1254-1258.
[8]Camphausen K, Menard C, Sproull M, et al. Isoprostane levels in the urine of patients with prostate cancer receiving radiothera py are not elevated[J]. Int J Radiat Oncol Biol Phys, 2004, 58(5):1536-1539.
[9]Tyburski JB, Patterson AD, Krausz KW, et al. Radiation metabolomics. Identification of minimally invasive urine biomarkers for gamma-radiation exposure in mice[J]. Radiat Res, 2008, 170(1): 1-14.
[10]Chen HY, Wang SM, Peng RY, et al. The effects of microwave radiation on expressions of pCREB, CREM, and CBP in the testicular tissue of rats[J]. Med J Chin PLA, 2012, 37(4): 379-382.[陈浩宇, 王水明, 彭瑞云, 等. 微波辐射对大鼠睾丸组织pCREB、CREM及CBP蛋白表达的影响[J]. 解放军医学杂志, 2012, 37(4): 379-382.]
[11]Mei YB, Feng ZC. Metabonomics research in progress in the field of pediatric critical care[J]. Med J Chin PLA, 2011, 36(6): 676 -678.[梅亚波, 封志纯. 代谢组学在儿科危重症领域的研究进展[J]. 解放军医学杂志, 2011, 36(6): 676-678.]
[12]Wang LF, Li X, Peng RY, et al. A metabolomics approach to screening urinary metabolites upon microwave exposure in monkeys[J]. Mil Med Sci, 2011, 35(5): 369-378.[王丽峰, 李翔,彭瑞云, 等. 基于代谢组学对微波辐射后猕猴尿液代谢产物的筛选研究[J]. 军事医学, 2011, 35(5): 369-378.]
[13]Huo C, Wang M, Ma ZC, et al. NMR-spectroscopy-based metabonomic study on the mouse model of blood deficiency syndrome induced by radiation[J]. Tianjin J Tradit Chin Med,2010, 27(3): 233-235.[霍超, 王穆, 马增春, 等. 辐射损伤所致血虚证小鼠模型及四物汤反证的代谢组学研究[J]. 天津中医药, 2010, 27(3): 233-235.]
[14]Zhong Q, Gao YX, Chang H, et al. Plasma metabonomics analysis of male patients with hyperuricemia[J]. Tianjin Med J,2011, 39(8): 695-697.[钟麒, 高玉霞, 常红, 等. 男性高尿酸血症患者血浆代谢组学的研究[J]. 天津医药, 2011, 39(8): 695-697.]
[15]Norrelund H, Wiggers H, Halbirk M, et al. Abnormalities of whole body protein turnover, muscle metabolism and levels of metabolic hormones in patients with chronic heart failure [J]. J Intern Med, 2006, 260(1): 11-21.
[16]Bell JD, Brown JC, Nicholson JK, et al. Assignment of resonances for 'acute-phase' glycoproteins in high resolution proton NMR spectra of human blood plasma[J]. FEBS Lett, 1987, 215(2):311-315.
[17]Sun L, Hu W, Liu Q, et al. Metabonomics reveals plasma metabolic changes and inflammatory marker in polycystic ovary syndrome patients [J]. J Proteome Res, 2012, 11(5): 2937-2946.
[18]Chen Y, Wu J, Tu L, et al. 1H-NMR spectroscopy revealed mycobacterium tuberculosis caused abnormal serum metabolic profile of cattle[J]. PLoS One, 2013, 8(9): e74507.
[19]Patel AB, Xia Y, Chowdhury GM, et al. Effects of continous hypoxia on energy metabolism in cultured cerebrocortical neurons[J]. Brain Res, 2008, 1229: 147-154.
