劳力性热射病患者肝功能早期变化规律及其对预后判断的价值
2014-11-05周京江赵佳佳宋青杨文超高铁婴
周京江,赵佳佳,宋青,杨文超,高铁婴
热射病(heat stroke)是中暑最为严重的一个类型,主要表现为核心体温升高(>40℃)、中枢神经系统功能障碍(谵妄、抽搐、昏迷)和肝脏与凝血功能损害。临床上常将热射病分为经典型热射病(classic heatstroke,CHS)和劳力性热射病(exertional heatstroke,EHS)[1-3]。前者多见于年老体弱或者有基础疾病者,主要因体温调节能力下降所导致。后者主要发生于暴露在高温、高湿环境中进行体力劳动或军事、体育训练的人群[4]。热射病一般发病急促,病情进展快,任何诊断治疗上的延误都可能导致严重后果[5-6]。热射病患者的肝功能损伤十分常见,有学者提出肝损伤应该是诊断热射病的必要条件之一[7-8]。虽然各医院每年收治的中暑患者很多,但达到热射病诊断标准的相对较少,很多医生对于热射病的认识仍然很有限。由于EHS相对少见且多为散发病例,大规模的临床研究很难开展。本文回顾性分析近年来69例EHS患者发病后早期肝功能的变化情况及其对预后判断的价值,总结EHS患者肝功能变化规律,从而为临床救治EHS提供理论依据。
1 资料与方法
1.1 临床资料 收集2005-2013年10所部队医院资料完整的EHS住院患者69例,所有患者均符合EHS诊断标准[5]。69例均为男性,军队士兵或军校学员,参加军事训练时或训练后发病,其中存活57例,死亡12例。
1.2 研究方法 所有患者均给予补液、降温等对症支持治疗,均行持续肾脏替代治疗(continuous renal replacement therapy,CRRT),部分患者因胆红素升高明显给予血浆置换治疗(plasma exchange,PE)。将患者按照预后分为存活组和死亡组,统计各组患者年龄、住院天数、入院时APACHE Ⅱ评分;收集两组患者发病后的前10d血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)的化验结果进行分析。如一天内有多次生化检验者采用该日每项结果的最差值,对于预后判断采用患者发病期间每项检验结果的最差值。
1.3 统计学处理 采用SPSS 19.0统计软件进行分析,计量资料以s表示,组间比较正态分布资料采用成组资料t检验,非正态资料采用WilCoxon秩和检验,对预后判断的分析采用受试者工作特征曲线(receiver operating characteristic curve,ROC)下面积表示。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基本资料的比较 69例患者年龄21.2±4.3岁,存活组年龄与死亡组比较差异无统计学意义(P>0.05),但存活组住院天数大于死亡组,APACHEⅡ评分低于死亡组(P<0.01)。所有患者均出现肝功能异常(表1)。
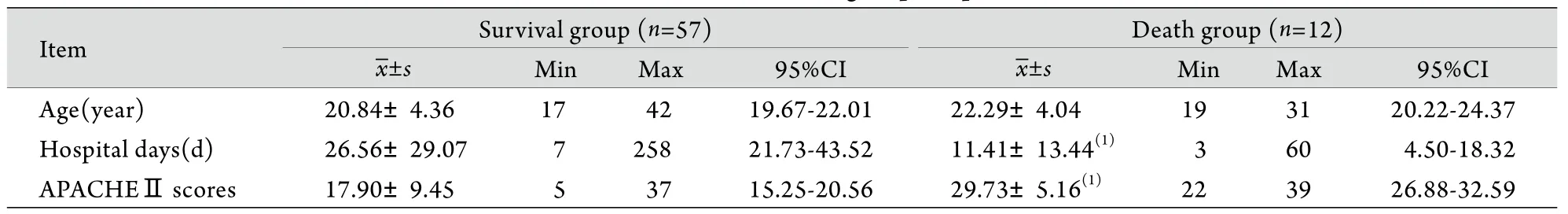
表1 两组患者一般资料比较Tab.1 General data of two groups of patients
2.2 两组患者血清转氨酶比较 两组患者在发病早期血清转氨酶均表现为先升高后下降的趋势,存活组ALT在发病第4天达到最高峰之后开始逐渐下降,AST在发病后第3天达到高峰并开始下降;死亡组ALT和AST在发病后第3天达到高峰并开始逐渐下降。存活组ALT在发病后第1-4天、第10天与死亡组比较差异有统计学意义(P<0.05),存活组AST在发病后第1-4天与死亡组比较差异有统计学意义(P<0.05,图1A、B)。
2.3 两组患者血清胆红素比较 两组患者在发病早期胆红素均呈先升高后缓慢下降趋势,存活组TBIL在发病后第5天达到最高峰之后开始缓慢下降,DBIL在发病后第8天达到最大值并开始缓慢下降;死亡组TBIL和DBIL在发病后第7天达到最大值之后开始缓慢下降。死亡组患者TBIL、DBIL均值比相对应发病天数的存活组高,其中存活组TBIL在发病后第2-10天与死亡组比较差异有统计学意义,存活组DBIL在发病后第1-10天与死亡组比较差异有统计学意义(P<0.05,图1C、D)。
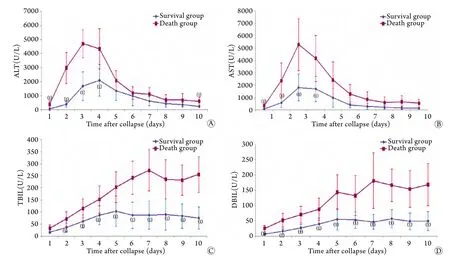
图1 两组患者血清指标变化Fig.1 Changes of serum index of patients in two groups
2.4 肝功能对于患者死亡的预测价值 ALT对于EHS患者死亡预测的ROC曲线下面积为0.833±0.064,95%CI(0.709,0.958),P<0.001,最佳截断值为3016.5U/L,敏感度为91.67%,特异度为67.86%。AST对于EHS患者死亡预测的ROC曲线下面积为0.798±0.073,95%CI(0.655,0.940),P=0.003,最佳截断值为4745U/L,敏感度为58.33%,特异度为89.28%。TBIL对于EHS患者死亡预测的ROC曲线下面积为0.810±0.067,95%CI(0.678,0.941),P=0.002,最佳截断值为123.9μmol/L,敏感度为100%,特异度为67.86%。DBIL对于EHS患者死亡预测的ROC曲线下面积为0.836±0.063,95%CI(0.713,0.960),P<0.001,最佳截断值为87.42μmol/L,敏感度为91.67%,特异度为71.43%(图2)。
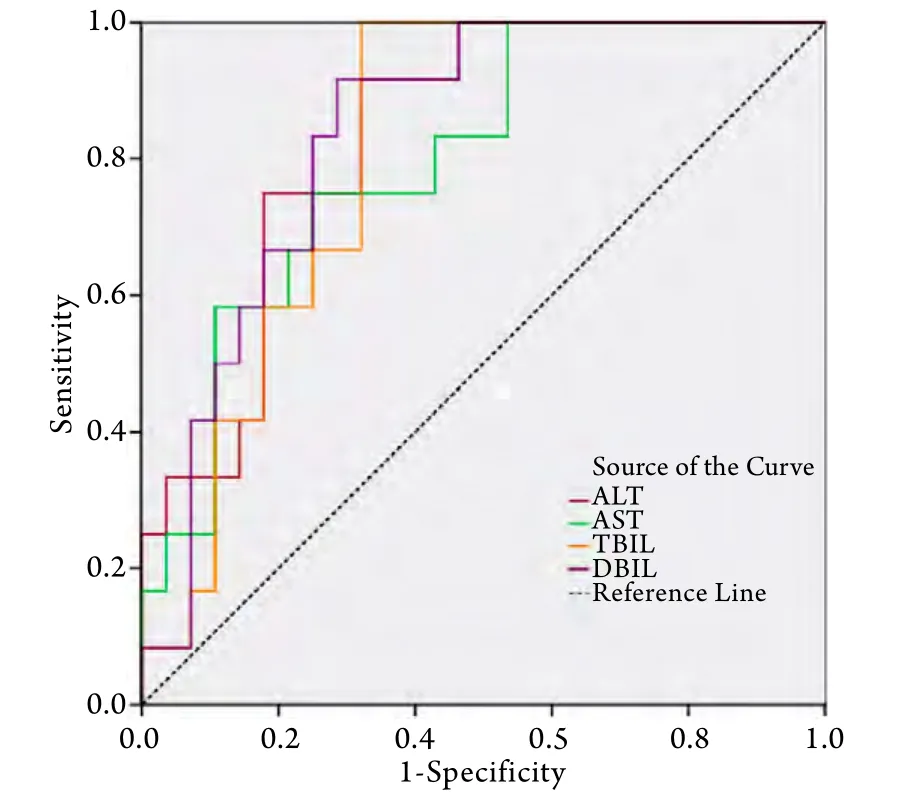
图2 肝功能指标的ROC曲线Fig.2 ROC curves of liver function
3 讨 论
随着全球气候变暖,中暑的发病率也在逐年增加,而作为中暑最严重的一个类型,热射病的比例也在逐年增高[9-10]。本文回顾性总结了69例EHS患者发病早期肝功能的变化情况及其对预后判断的价值,以期能对EHS的诊治提供借鉴。
血清转氨酶是衡量肝细胞损伤最为常用的指标之一,在肝细胞损伤时大量释放入血。在肝细胞中,ALT主要存在于非线粒体中,而约80%的AST存在于线粒体中,两者的血浆半衰期分别为47h和17h。血清胆红素对于判断有无黄疸、黄疸程度及类型有重要意义。热射病患者病情的严重程度不仅与核心温度的高低有关,还与高温的持续时间密切相关[11-13]。本研究发现热射病患者发病后肝功能的变化呈现出一定的规律性,血清转氨酶和胆红素总体都呈先升高后下降的趋势,其中血清转氨酶在发病第3~4天达高峰后开始缓慢下降,血清胆红素在第5~8天达高峰后开始下降。发病早期血清转氨酶及胆红素对于预后的判断具有较高的价值,提示当EHS患者的各项指标达到或高于其截断值时,死亡风险增加,应引起重视。
早期血清转氨酶升高主要是肝细胞破坏造成的ALT和AST大量释放入血,由于AST主要存在于线粒体中,因此AST越高提示肝细胞损伤越重。由于半衰期较短,血清转氨酶在发病后第3~4天达峰后开始快速下降,而同时由于肝细胞和胆管细胞受损,肝脏排除胆红素的能力下降,血清胆红素开始逐渐升高,肝损伤严重者会出现“酶胆分离”的现象[14-15]。肝损伤越重血清胆红素越高,持续时间越长。我们发现在发病5~7d后DBIL/TBIL多>0.5,提示此时黄疸为胆汁淤积型黄疸。
Core等[16]早在1949年发现,热射病患者肝细胞最初为云雾状肿胀,8h后肝细胞胞质中可出现微小空泡,10h后可出现小的脂肪滴并开始融合,16h可见肝小叶中心坏死,60h约60%以上受累小叶坏死,到达第7天时巨噬细胞溶解、坏死碎片达到最高,此时残存的肝细胞开始再生。本研究中死亡患者的平均生存时间只有11.4d,其中最长的一例在发病第60天因无法控制的感染而死亡,大部分死亡患者都没有坚持到肝细胞开始再生的时间,或者肝细胞刚开始再生不久即发生死亡。Hadad等[17]报道了16例EHS所致急性肝衰竭病例,其中13例行保守治疗,3例实施原位肝移植,保守治疗的有5例死亡,占38.5%,而原位肝移植的3例患者全部死亡。目前国内未见原位肝移植治疗EHS肝衰竭的报道,本研究中所有患者都接受保守治疗,追踪随访结果发现,57例存活者肝功能多在发病后1个月左右基本恢复正常,最长的一例在发病后2个月恢复正常,一年后复查肝功能指标全部正常。因此,只要能够帮助热射病患者度过急性肝衰竭期,肝功能多能够恢复正常。
本研究为回顾性资料分析,可能会造成一定的选择偏倚。由于横纹肌、心肌等细胞也含有ALT和AST[18],并且这些细胞在受损时也可释放ALT和AST,而多数医院的检测手段无法区分其亚型。此外本研究并没有排除血液滤过、血浆置换等治疗对肝功能指标的影响,因此患者肝功能数据可能与真实情况存在差异。由于伦理学的因素,空白对照试验无法进行,期待在将来能够进行前瞻性、大样本的临床研究来减少误差,同时找出有效的防治热射病肝损伤的方法。
[1]Liu YN, Geng Y, Fu W, et al. Relationship between core temperature change during recovery and prognosis in classic heat stroke rat models[J]. Med J Chin PLA, 2013, 38(10): 818-821. [刘亚楠, 耿焱, 付炜, 等. 经典型热射病大鼠恢复期体温变化与预后的关系[J]. 解放军医学杂志, 2013, 38(10): 818-821.]
[2]Adams T, Stacey E, Stacey S, et al. Exertional heat stroke[J]. Br J Hosp Med (Lond), 2012, 73(2): 72-78.
[3]Geng Y, Fu W, Liu YN, et al. Comparison of classical heat stroke between conscious and unconscious rat models[J]. Med J Chin PLA, 2013, 38(8): 615-619. [耿焱, 付炜, 刘亚楠, 等. 清醒与麻醉状态经典型热射病大鼠模型比较[J]. 解放军医学杂志,2013, 38(8): 615-619.]
[4]Ji J, Song Q, Zhou FH, et al. Etiology of fatal exertional heatstroke induced by military trainning[J]. Med J Chin PLA,2008, 33(8): 1035-1037.[纪筠, 宋青,周飞虎, 等. 军事训练导致的致死性劳力性热射病病因学调查与分析[J]. 解放军医学杂志, 2008, 33(8): 1035-1037.]
[5]Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25): 1978-1988.
[6]Li JJ, Ma TZ, Sun SZ, et al. The value of continuous renal replacement therapy in heatstroke patients complicated with multiple organ dysfunction syndrome[J]. J Logist Univ CAPF(Med Sci), 2013, 22(10): 880-882. [李建军, 马铁柱, 孙世中, 等. 持续肾脏替代治疗在合并多脏器功能不全综合征的热射病患者中的应用价值[J]. 武警后勤学院学报(医学版), 2013, 22(10): 880-882.]
[7]Ferrer Gómez C, Valia Vera JC, De Andrés Ibáñez J. Acute liver failure and heat stroke[J]. Rev Esp Anestesiol Reanim, 2009,56(2): 120-121.
[8]Giercksky T, Boberg KM, Farstad IN, et al. Severe liver failure in exertional heat stroke[J]. Scand J Gastroenterol, 1999, 34(8):824-827.
[9]Belshaw C. Preventing heat stroke in Australian communities[J].Aust Nurs J, 2009, 16(7): 28-31.
[10]Fauroux AM. Preventing heat stroke[J]. Soins Gerontol,2007(66): 20-21.
[11]Leon LR. Heat stroke and cytokines[J]. Prog Brain Res, 2007,162: 481-524.
[12]Chang CK, Chang CP, Liu SY, et al. Oxidative stress and ischemic injuries in heat stroke[J]. Prog Brain Res, 2007, 162: 525-546.
[13]Liu H, Song Q, Zhou FH, et al. Application of mild hypothermia in the treatment of exertion heat stroke[J]. Med J Chin PLA,2010, 35(9): 1148-1150. [刘辉, 宋青, 周飞虎, 等. 亚低温在劳力型热射病治疗中的应用[J]. 解放军医学杂志, 2010, 35(9):1148-1150.]
[14]Azzopardi N, Chetcuti S, Sant J, et al. Acute Liver Impairment in a Young, healthy athlete: Hypoxic hepatitis and rhabdomyolysis following heat stroke[J]. Case Rep Gastroenterol, 2012, 6(2):563-568.
[15]Pardo Cabello AJ, Benticuaga Martinez MN, Martin Moreno A, et al. Acute liver failure following heat stroke[J]. An Med Interna, 2005, 22(9): 429-430.
[16]Gore I, Isaacson NH. The pathology of hyperpyrexia;observations at autopsy in 17 cases of fever therapy[J]. Am J Pathol, 1949, 25(5): 1029-1059.
[17]Hadad E, Ben-Ari Z, Heled Y, et al. Liver transplantation in exertional heat stroke: a medical dilemma[J]. Intensive Care Med, 2004, 30(7): 1474-1478.
[18]Thomas J, Crowhurst T. Exertional heat stroke, rhabdomyolysis and susceptibility to malignant hyperthermia[J]. Intern Med J,2013, 43(9): 1035-1038.
