趋化性细胞因子在肾移植排斥反应中的临床应用价值
2014-11-05肖漓何秀云周文强樊文梅魏玉香王新颖高钰马锡慧孔祥瑞韩永许晓光黄海燕石炳毅
肖漓,何秀云,周文强,樊文梅,魏玉香,王新颖,高钰,马锡慧,孔祥瑞,韩永,许晓光,黄海燕,石炳毅
1998年Sallusto等[1]报道,趋化性细胞因子参与调控T细胞的活化及趋化向移植物的迁移过程。因此,趋化性细胞因子在器官移植领域中的作用受到关注[2]。本研究关注两类5种趋化性细胞因子。其中一类趋化性细胞因子的近氨基端存在两个相邻的半胱氨酸(CC),包括单核趋化蛋白-1(monocyte chemoattractant protein,MCP-1)和调节激活正常T细胞表达分泌因子(reduced upon activation normal T cell expression and secretion,RNATES)。另一类其近氨基端存在半胱氨酸-其他氨基酸-半胱氨酸(CXC)基序,包括中性粒细胞激活蛋白-1(neutrophilactivating protein 1,NAP-1/IL-8)、IFN-γ诱生单核因子(monokine induced by interferon-γ,MIG)和IFN-γ诱导蛋白-10(IFN-γ-inducible protein-10,IP-10)。本研究采用流式微球捕获技术(CBA)检测肾移植受者体内趋化性细胞因子的表达变化,分析其与临床及因子间的相关性,为揭示排斥反应的发生机制提供实验依据。
1 资料与方法
1.1 研究对象及分组 2011年1-12月间在解放军第309医院全军器官移植研究所进行同种异体肾移植术的患者149例,排除并发任何感染、样本收集缺失、无肾脏病理结果等患者,最终纳入21例,年龄34.9±7.5岁,其中男15例,女6例,观察周期为术前1d至术后28d,收集样本135份。原发病包括IgA肾病、慢性肾小球肾炎、多囊肾等。将21例进行同种异体肾移植术的患者分为急性排斥反应(AR)组(n=11),功能稳定组(F组,n=10),另纳入同期在解放军第309医院健康查体的志愿者10例作为对照组(C组),年龄33.0±6.8岁,其中男5例,女5例,并排除各种原发性疾病。所有受者均签订知情同意书。临床研究经医院医学伦理委员会批准,术后依据常规使用免疫抑制剂。
1.2 指标定义 急性排斥反应(AR):尿量减少,发热(体温可>38℃)、血压升高,实验室检查发现肌酐和尿素氮升高、肌酐清除率下降、蛋白尿、尿比重下降。尿脱落细胞检查发现集合小管、核残余细胞碎片及纤维蛋白原沉着增多。彩超显示移植肾体积增大、血流减少、皮髓分界模糊、血管阻力增加(R>0.9)。11例AR均发生于术后1个月内,时间为3~25d,平均为10.5d。移植肾功能稳定的判断依据:术后移植肾功能恢复正常,半年内血肌酐维持在103μmol/L以下,24h尿量在1600ml左右,尿比重为1.01~1.04,B超显示移植肾体积、结构和血流均正常。
1.3 仪器及试剂 美国BD公司FACS Calibur流式细胞仪。使用CellQuest、BD CBA数据分析软件。细胞因子检测试剂盒为BDTM Cytometric Bead Array(CBA) Human chemicokine生产。5种偶合不同荧光强度的微球,这种荧光染料发射波长约650nm,同时微球连接5种细胞因子抗体。
1.4 样本采集 分别收集研究对象外周血3~5ml,采用EDTA抗凝,时间点包括术前1d,术后1、7、14、28d以及排斥反应发生时。2500r/min离心10min分离血浆,每例取3管,100μl/管,-80℃保存备用。样本量AR组(n=58)和F组(n=50)共计108份,检测时为确保数据的准确性,每份样本平行测量3管,取均值进行统计分析。
1.5 CBA检测步骤 流式微球捕获技术检测血浆中5种细胞因子为CXCL10/IP-10、CXCL9/MIG、CXCL8/IL-8、CCL2/MCP-1、CCL5/RNATES。标本制备:50μl待测血浆首先加入50μl捕获微球(依据说明及时配置捕获微球混合物),然后加入50μl检测抗体(PE标记),室温避光孵育2h,加入1ml洗液,1500r/min离心5min,洗涤3次,上机采用CellQuest软件获取数据。标准品制备:将标准品按照梯度法依次稀释为5000、2500、1250、625、312.5、156、80、40、20pg/ml及空白对照管,上机检测后绘制标准曲线。上机前清洗仪器并分别使用BD CaliBRITE Beads校准仪器,CBA试剂盒中的Cytometer Setup Beads调节电压、补偿等。
1.6 统计学处理 应用Graph 5.0软件进行分析,经正态性检验后5种趋化性细胞因子表达含量不符合正态分布,以M(R)表示,组间比较采用Wilcoxon秩和检验;相关性分析采用线性回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组间的临床特征 AR组于AR发生当天检测肌酐水平,F组于术后14d检测,结果显示AR组肌酐为305.42±87.13μmoI/L,F组为69.31±11.87μmoI/L,两组比较差异有统计学意义(P<0.05),两组间其余指标比较差异无统计学意义(P>0.05,表1)。
2.2 趋化性细胞因子的组间比较 移植术前,AR组、F组MCP-1表达含量明显高于C组,差异有统计学意义(P<0.05)。IL-8在3组的表达含量差异均无统计学意义(P>0.05)。AR、F组MIG表达含量与C组比较差异均有统计学意义(P<0.01或P<0.05)。AR、F组IP-10表达含量与C组比较明显升高,差异均有统计学意义(P<0.05)。AR和F组间受者外周血浆中5种趋化性细胞因子的表达差异均无统计学意义。为确定排斥反应影响肾功能时的细胞性趋化因子释放情况,我们检测移植术后趋化性细胞因子的表达含量。与C组比较,除F组MIG外,AR组、F组细胞性趋化因子MCP-1、IL-8、MIG、IP-10均明显升高,差异有统计学意义(P<0.05或P<0.01);且AR组亦明显高于F组。3组移植术前、术后RANTES表达的平均荧光强度(MFI)比较差异均无统计学意义(P>0.05,表2)。
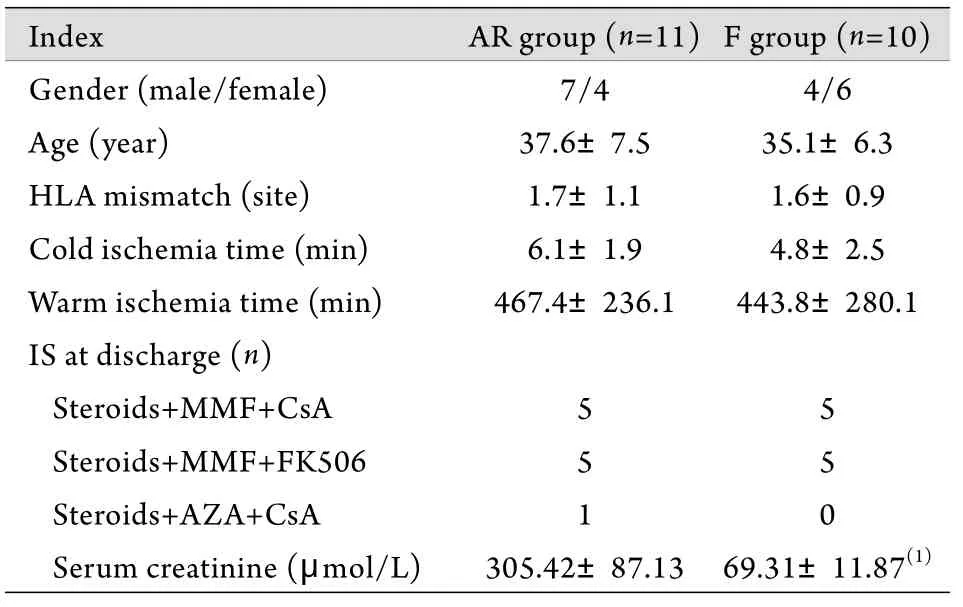
表1 两组患者临床特征比较Tab.1 Comparison of clinical features in two groups
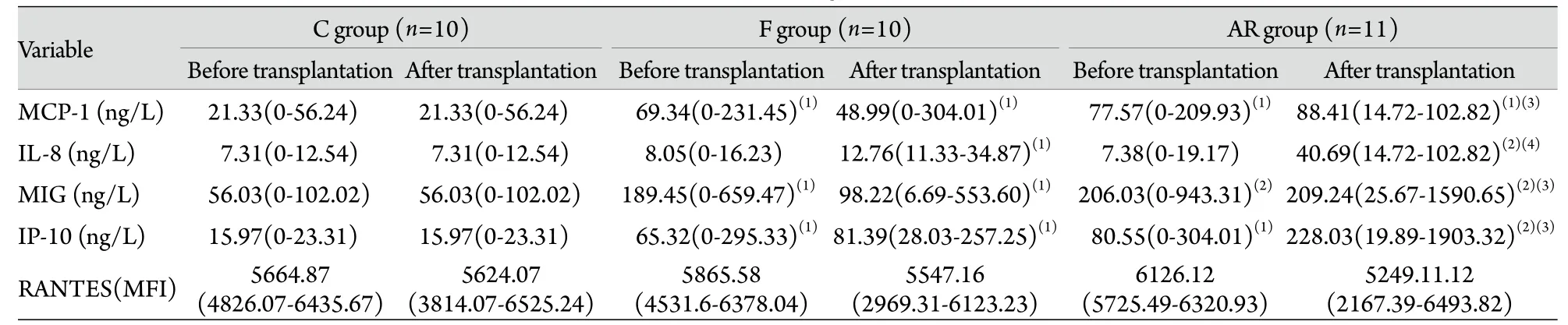
表2 移植术前、术后各组趋化性细胞因子的组间比较[M(R)]Tab.2 Comparison of levels of Chemokines in three groups before and after transplantation [M(R)]
2.3 趋化性细胞因子与肌酐的相关性分析 相关性分析结果显示,术前MCP-1、RNATES、IP-10、MIG和IL-8的表达含量与肌酐水平之间无明显相关性,Spearman相关系数(r)分别为-0.1487、0.1000、0.1000、-0.7000、-0.3000。术后IL-8、MIG与肌酐水平呈正相关性[(r=0.4896、95%CI(0.2423~0.6772),r=0.6245、95%CI(0.4145~0.7713),P<0.01)]。而MCP-1,RNATES、IP-10与肌酐水平无显著相关性(P>0.05,图1)。
3 讨 论
排斥反应的发生过程是移植物抗原经受者APC提呈后,初始状态的淋巴细胞活化成为效应T细胞,继而进入抗原存在的移植物组织发挥免疫效应[3]。趋化性细胞因子是一类对不同靶细胞具有趋化效应的细胞因子家族,1992年统一命名为chemokine。迄今,已知的趋化性细胞因子达50种。根据半胱氨酸的位置、排列方式和数量分为4类:CC,CXC,C和CXXXC趋化性细胞因子。可由多种细胞包括单核/巨噬细胞、T细胞、B细胞、血小板等产生,具有激活和趋化白细胞的作用[4-5]。已发现趋化性细胞因子参与T细胞的分化、迁移、活化及效应,它在排斥反应中的调控作用也越来越受到关注[6]。
本研究采用CBA法[7]以微量样本同时检测5种趋化性细胞因子,具有灵敏、精确、重复性好的优点。结果发现,术前AR和F组间受者外周血浆中5种趋化性细胞因子的表达差异均无统计学意义,但两组MCP-1、MIG、IP-10表达水平均高于C组(P<0.05)。肾移植受者术前肾功能严重损伤,MCP-1是趋化单核细胞浸润和造成肾小管损伤的主要原因,MIG和IP-10通过IFN-γ诱导Th1漂移,从而使肾组织炎症反应加速。有研究总结肾移植受者术前IP-10和MIG高水平表达更易发生严重的IR,因此提出可作为抗排斥反应治疗的监测指标,并且具有早于肌酐的预测价值[8]。但其术前结果与本研究存在差异,原因可能为肾移植受者存在不同的原发病,本研究中的受者术前诊断包括急慢性肾小球肾炎、系膜增生性肾小球肾炎、红斑狼疮等肾脏疾病,其中3例为乙型肝炎病毒携带者,而其他肾移植受者的原发病以慢性肾炎为主。为探讨术前趋化性细胞因子与肾功能的相关性,分别统计其与血肌酐的Spearman相关系数,结果显示无相关性,因此推测趋化性细胞因子的表达水平与其原发病引起的炎症反应更为相关,而其与肾移植术后的转归及其原发病的病理分类有待进一步扩大样本量分析。
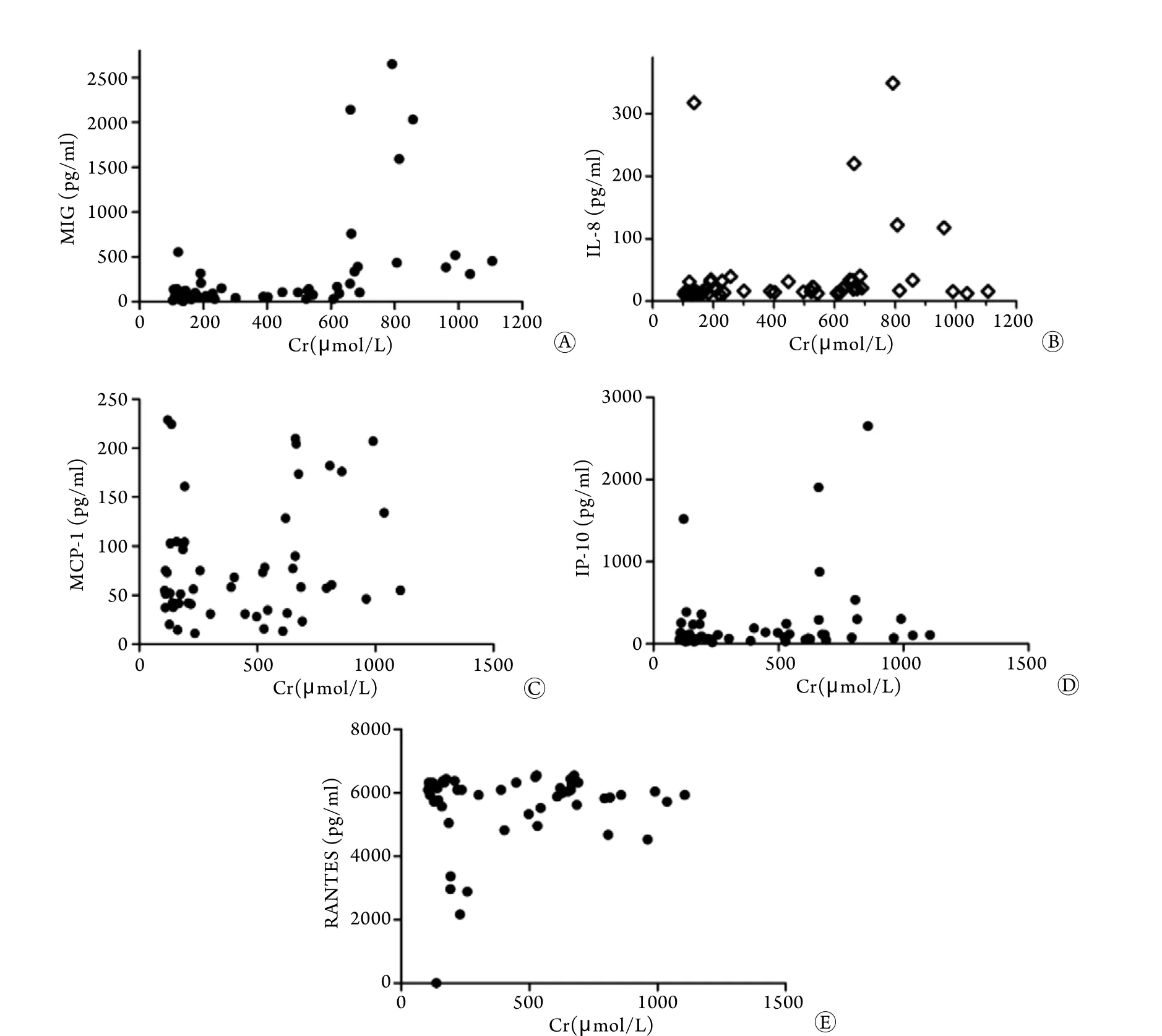
图1 肌酐与MIG(A)、IL-8(B)、MCP-1(C)、IP-10(D)、RNATES(E)表达含量的相关性分析Fig.1 Association analysis between serum creatinine (Cr) and the expressions of MIG (A), IL-8(B), MCP-1(C), IP-10(D),RNATES(E)
本研究比较了术后AR、F组受者外周血浆中趋化性细胞因子的表达水平,发现AR组的MCP-1、IL-8、MIG、IP-10均高于F组。IL-8、MIG和IP-10是CXC类趋化性细胞因子,其中MIG和IP-10主要介导Th1型炎症反应,趋化单核细胞和T细胞,可加强Th1反应和破坏Th2反应的进程。有研究报道MIG、IP-10水平升高与IR相关[9-10]。值得注意的是,研究结果中AR组IL-8与F组比较显著升高(P<0.01)。IL-8可非特异性趋化和激活中性粒细胞,参与哮喘、银屑病和接触性皮炎等的发病过程,而其在肾移植受者体内的表达未见报道。目前已明确地塞米松、CsA、FK506等免疫抑制剂以及IFN-γ、IL-10和IL-4可下调IL-8的产生[11]。本研究中肾移植受者发生AR时,其体内IL-8表达水平显著升高,提示IL-8参与AR的可能性。进一步统计分析发现,MIG和IL-8表达水平与肾移植受者的血肌酐水平呈正相关,因此MIG和IL-8具有作为补充肾功能监测标志的应用前景。研究报道MCP-1、RANTES等在发生慢性排斥反应的移植肾组织中的表达上升[12-13],由于本研究检测的RANTES含量高于CBA方法最高检测阈值,依据技术指南使用MFI反映其表达含量,结果显示AR组RANTES的表达无显著升高或降低,这是由于外周血和肾组织局部微环境存在差异。
综上,MIG和IL-8的表达水平具有成为监测肾功能的生物标志分子的潜在价值,但仍有待扩充样本量、细化分组因素进一步研究,以为临床提供更为确切的参考值。同时CBA方法扩展了流式细胞仪的应用范围,从细胞抗原到细胞外蛋白或细胞因子的定量检测,可同时检测单一样本中的多个目的蛋白,具有微量、灵敏度高、重复性好、高通量、检测灵活等优点且范围宽,值得推广应用。
[1]Sallusto F, Lanzavecchia A, Mackay CR. Chemokines and chemokine receptors in T-cell priming and Th1/Th2-mediated responses[J]. Immunol Today, 1998, 19(12): 568-574.
[2]Sarwal M, Chua MS, Kambham N, et al. Molecular heterogeneity in acute renal allograft rejection identified by DNA microarray profiling[J]. N Engl J Med, 2003, 349(2): 125-138.
[3]Guo HZ, Zhao S, Cui GH, et al. Dynamics and distribution of CD8+Treg in rat orthotopic lung transplant recipients[J]. J Zhengzhou Univ (Med Sci), 2013, 48(4): 463-466. [郭海周, 赵松, 崔广晖, 等. 大鼠原位肺移植后CD8+调节性T 细胞的变化[J]. 郑州大学学报(医学版), 2013, 48(4): 463-466.]
[4]Kunkel SL, Strieter RM, Lindley IJ, et al. Chemokines: new ligands, receptors and activities[J]. Immunol Today, 1995,16(12): 559-561.
[5]Hamilton JA. Colony stimulating factors, cytokines and monocyte-macrophages--some controversies[J]. Immunol Today, 1993, 14(1): 18-24.
[6]Ma L, Zhang WH, Zhou GJ, et al. The effects of resveratrol on transplant rejection and expression of IL-2 and IL-10 in the islet-like cell-cluster transplantation[J]. Med J Chin PLA, 2012,37(6): 606-609. [马丽, 张薇华, 周光纪, 等. 白藜芦醇对小鼠胰岛样细胞团的抗移植排斥作用及其IL-2、IL-10表达的影响[J]. 解放军医学杂志, 2012, 37(6): 606-609.]
[7]Jiménez R, Ramírez R, Carracedo J, et al. Cytometric bead array(CBA) for the measurement of cytokines in urine and plasma of patients undergoing renal rejection[J]. Cytokine, 2005, 32(1):45-50.
[8]Jiang YG, Peng WH, Chen JH. Impact of pre-transplant serum levels of IP-10, MIG and BLC on acute rejection episode[J].Acta Acad Med Nei Mongol, 2010, 4(32): 375-378. [蒋宇光, 彭文瀚, 陈江华. 术前血清IP-10, Mig和BLC水平与移植肾排异关系的研究[J]. 内蒙古医学院学报, 2010, 4(32): 375-378.]
[9]Huang H, Xu X, Yao C, et al. Serum levels of CXCR3 ligands predict T cell-mediated acute rejection after kidney transplantation[J]. Mol Med Rep, 2014, 9(1): 45-50.
[10]Lo DJ, Weaver TA, Kleiner DE, et al. Chemokines and their receptors in human renal Allotransplantation[J].Transpalntation, 2011, 91(1): 70-77.
[11]Jin BQ. Cellular and molecular immunology[M]. 2nd Ed.Beijing: 2006. 190-191. [金伯泉. 细胞和分子免疫学[M]. 2版.北京: 科学出版社, 2006. 190-191.]
[12]Wei YL, Zhang JL, Hou CM, et al. Determination of pathological factors involved in lupus nephritic mice with cGVHD[J]. Bull Acad Mil Med Sci, 2010, 34(5): 427-432. [魏应林, 张及禄, 侯春梅, 等. 慢性移植排斥反应诱导的小鼠肾炎发生因素的初步探讨[J]. 军事医学科学院院刊, 2010, 34(5): 427-432.]
[13]Rotondi M, Rosati A, Buonamano A, et al. High pretransplantserum levels of CXCL10/IP-10 are related to increased risk of renal allograft failure[J]. Am J Transplant, 4(9):1466-1474.
