Akt和GLUT-4在妊娠糖尿病与孕期体重过度增长孕妇脂肪组织中的表达变化
2014-11-05伍丽周玮刘建
伍丽,周玮,刘建
我国妊娠糖尿病(gestational diabetes mellitus,GDM)发病率为3%~4%,且呈逐年上升趋势[1]。孕前肥胖尤其体重超过65kg是GDM的危险因素[2]。McMahon等[3]研究发现,孕前体重<49kg或>65kg可增加GDM风险。研究证实,GDM和肥胖可引起孕妇脂肪组织及骨骼肌胰岛素信号通路缺陷[4]。胰岛素抵抗是GDM发病的始动因素,是机体对胰岛素效应性降低的一种状态,表现为胰岛素效应器官(肝脏、骨骼肌和脂肪)对胰岛素的敏感性降低,其中脂肪组织是胰岛素抵抗的始发部位[5-6]。但目前只有少数研究报道了孕期体重过度增长,即体重指数(BMI)增长过快、糖耐量正常妇女的胰岛素信号通路变化情况,对孕期体重过度增长与GDM之间关系的分子基础研究还较少。本文旨在探讨GDM和孕期体重过度增长对胰岛素信号通路的影响,分析GDM发生的分子机制。
1 资料与方法
1.1 研究对象及分组 选择2013年2-7月在重庆医科大学附属第二医院行系统产检并剖宫产分娩的GDM孕妇15例(GDM组)。诊断标准为:孕24~28周行75g糖耐量试验(OGTT)测定,按WHO标准即空腹5.1mmol/L,1h 10.0mmol/L,2h 8.5mmol/L,其中1项或1项以上达到或超过正常值,可诊断为GDM[6],选择其中BMI增加约为7kg/m2、经饮食治疗使血糖控制良好者(餐后2h血糖<6.7mmol/L)作为GDM组。选择同期入院且糖耐量正常、BMI增加约4kg/m2,接受剖宫产手术的孕妇15例,作为正常孕妇(NGT1)组。选择同期行剖宫产、糖耐量正常、BMI增加约8kg/m2的孕妇15例作为体重过度增长(NGT2)组。所有入选病例均排除高血压、多囊卵巢、肝肾功能异常等疾病。3组产妇年龄、孕周、空腹血糖(fasting blood glucose,FBG)、早孕期BMI等差异均无统计学意义(P>0.05),NGT2组BMI的增加明显高于NGT1组(P<0.05,表1)。
1.2 生化指标及检测 采患者空腹血5ml,高速离心机4℃下4000r/min离心5min,分离血清;经4℃下14 000r/min离心5min去除细胞碎片,上清分装至1.5ml EP管,立即检测FBG和空腹胰岛素(fasting insulin,FINS)。血糖测定采用葡萄糖氧化酶法,胰岛素测定采用放射免疫法。计算胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)及胰岛β细胞分泌指数(homeostatic model assessment of insulin secretion index,HOMA-IS)。HOMA-IR=FBG×FINS/22.5。HOMA-IS=20×FINS/(FBG-3.5)。
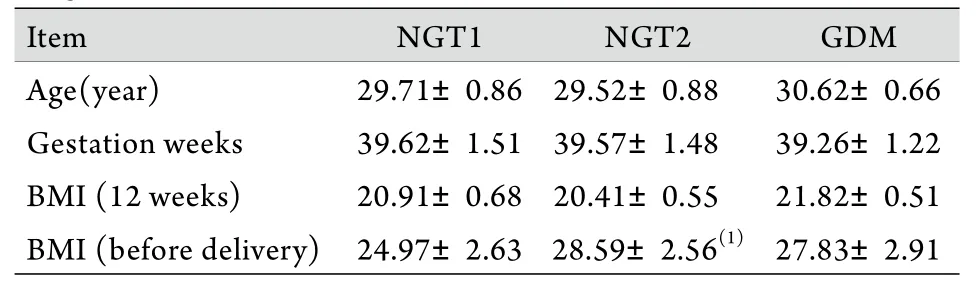
表1 三组孕妇基线临床资料比较Tab.1 Comparison of baseline data among three groups of pregnant women
1.3 脂肪组织磷酸化蛋白激酶B(Akt)及葡萄糖转运蛋白4(GLUT-4)的表达检测
1.3.1 材料准备及处理 剖宫产手术时按无菌要求留取少量腹部皮下脂肪组织,将其移入盛有Krebs-Henseleit缓冲液的无菌培养皿中,剔除筋膜和小血管组织,再用Krebs-Henseleit缓冲液清洗3次,顺筋膜纹路分成直径约1mm的脂肪小团。脂肪组织分为2份,分别置入普通Krebs-Henseleit缓冲液(基础状态)以及含胰岛素(1×10-7mol/L)的Krebs-Henseleit缓冲液(胰岛素刺激状态)中,在37℃、95%O2、5%CO2孵箱中温育30min后冰浴终止反应。
1.3.2 Western blotting法检测蛋白表达 各取两种状态的脂肪组织50mg,用Western细胞裂解液(碧云天公司)1ml在冰上匀浆,4℃下12 000×g离心20min,留取上清。用BCA蛋白定量试剂盒进行蛋白定量,取50μg蛋白加5×上样缓冲液(体积比4:1)100℃煮沸10min,行12%SDS-PAGE电泳后湿转至PVDF膜上,用5%脱脂牛奶室温封闭1h,按1:1000比例稀释GLUT-4、p-Akt、t-Akt一抗(Millipore公司),4℃过夜;TBST漂洗3次,每次5min;再按1:2500比例稀释辣根过氧化物酶标记的二抗,室温孵育1h,TBST漂洗3次后用ECL化学发光剂在X线下曝光、显影。经Quantity One软件分析光密度值,结果以目的蛋白条带与内参蛋白β-actin条带光密度值的比值表示。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析,数据结果以s表示,三组间比较采用单因素分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 生化指标水平比较 NGT1组、NGT2组、GDM组空腹血糖无明显差异(P>0.05);GDM组FINS、HOMA-IR、HOMA-IS均高于NGT2组,且NGT2组高于NGT1组(P<0.05,表2)。
2.2 Akt磷酸化水平及GLUT-4蛋白表达 基础状态下的脂肪组织中,NGT1组、NGT2组、GDM组Akt的表达无明显差异(P>0.05);经胰岛素刺激后,NGT1组Akt蛋白的磷酸化程度明显增高(P<0.05),而NGT2组和GDM组则无明显变化(P>0.05)。
基础状态下的脂肪组织中,GDM组GLUT-4蛋白表达水平与NGT1组相比明显降低(P<0.05),NGT2组与NGT1组相比稍有下降,但差异无统计学意义(P>0.05);经胰岛素刺激后,三个组GLUT-4蛋白表达水平与各自的基础状态相比均有所增加,NGT1组增加的幅度高于NGT2组(P<0.05,图1)。
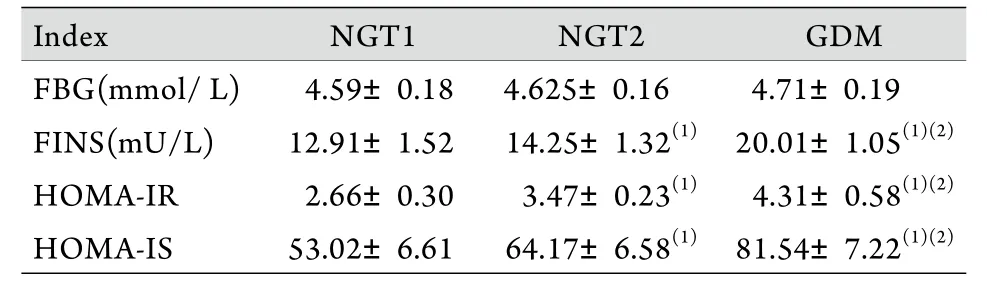
表2 三组孕妇血生化指标比较Tab.2 Comparison of blood biochemical information among three groups of pregnant women
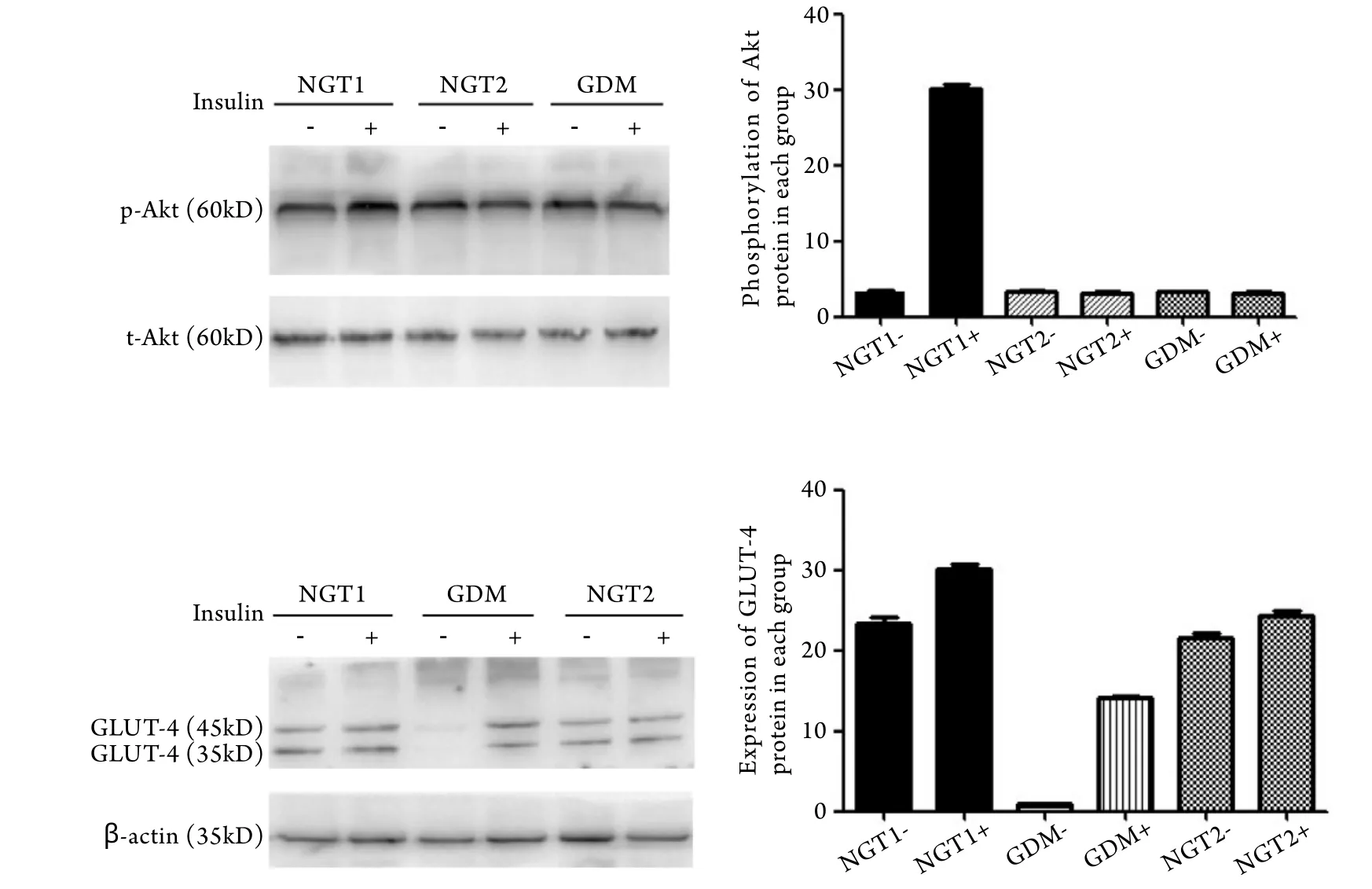
图1 三组脂肪组织Akt和GLUT-4蛋白表达Fig. 1 Expression of Akt and GLUT-4 in adipose tissue of three groups
3 讨 论
GDM是在妊娠期首次发现的糖代谢异常,它的特征性标志是胰岛素抵抗,目前大部分研究支持胰岛素信号通路的变化和随后出现的葡萄糖转运异常是使糖尿病孕妇发生胰岛素抵抗的潜在原因,但是发生这种现象的机制目前仍有待阐明[7]。
胰岛素在机体信号转导通路中发挥着多重作用,如通过葡萄糖转运蛋白进行葡萄糖的转运、糖原合成、蛋白质合成和脂类代谢等,胰岛素信号通路缺陷可使正常代谢受到影响[8]。本研究3组孕妇临床资料和生化结果表明:NGT2组整个孕期BMI增加约为8.5kg/m2,较NGT1组明显增高,属于体重过度增长。由于GDM组进行了饮食控制,所以3组孕妇FBG差异无统计学意义。GDM组FINS、HOMA-IR和HOMA-IS最高,NGT2组次之,NGT1组最低,差异有统计学意义。这些结果提示孕期体重增长过快的孕妇,虽然FBG保持稳态,但其他糖代谢相关的生化指标已有向GDM发展的趋势,这可能是由于孕期肥胖使母体胰岛β细胞分泌的胰岛素不足以抵消胰岛素敏感性进行性下降所致,所以胰岛素的靶组织之一皮下脂肪组织中出现胰岛素信号通路障碍,发生胰岛素抵抗。
PKB/Akt是一种丝氨酸/苏氨酸激酶,参与多种细胞的信号转导途径。PKB/Akt激活后,可使GLUT-4从胞质转移至胞膜,介导葡萄糖向细胞内转运,促进糖的吸收。张敬芳等[9]研究发现,2型糖尿病大鼠对胰岛素刺激的反应性降低,与正常对照组相比,其骨骼肌和肝脏胰岛素刺激后的Akt活性分别下降41%和32%。本研究结果显示:基础状态时,NGT1组、NGT2组、GDM组Akt的表达无明显差异。经胰岛素刺激后,NGT1组Akt蛋白的磷酸化程度明显增高(P<0.05),而NGT2组和GDM组则无明显变化,提示NGT1组孕妇对胰岛素保持应有的敏感性,在胰岛素刺激作用下,当信号传至Akt时,使Akt蛋白磷酸化程度增高,从而激活葡萄糖的摄取和利用等一系列生物学效应。而GDM患者和NGT2组孕妇对胰岛素的反应性降低,表现为经胰岛素刺激后,Akt无法发生磷酸化而进一步活化,即GDM组和NGT2组Akt蛋白磷酸化程度(p-Akt)较NGT1组孕妇为低,致使下游信号分子传递减弱,最终导致葡萄糖的摄取和利用减少,血糖水平升高。
Colomiere等[10]发现肥胖妇女的肌肉组织中GLUT-4 mRNA和蛋白表达水平明显低于体重正常孕妇。本研究结果显示:在基础状态(无胰岛素刺激)的脂肪组织中,GDM组GLUT-4蛋白表达与NGT1组相比明显降低,NGT2组与NGT1组相比稍有下降,但差异无统计学意义;经胰岛素刺激后,三组GLUT-4蛋白表达水平与各自基础状态比较均有增加,NGT1组增加的幅度明显高于NGT2组。该结果提示,在基础状态时,GDM患者由于胰岛素信号通路中的上游信号分子胰岛素受体底物(IRS-1/IRS-2)、Akt出现转录或翻译水平的缺陷,影响了信号传递[11],而此时,NGT2组孕妇的胰岛细胞处于正常状态而出现代偿,因而胰岛素信号通路最后环节GSVS中核心分子GLUT-4没有呈现明显降低。经胰岛素刺激后,NGT1组和NGT2组与各自的基础状态相比,GLUT-4蛋白表达水平均增高,但NGT1组增加的幅度显著大于NGT2组,再次证明体重过度增长孕妇对胰岛素的敏感性下降,使信号传递发生障碍,影响GLUT-4的表达和功能,阻碍GLUT-4从储存囊泡转运至细胞膜,从而无法发挥正常的葡萄糖转运作用。
综上所述,本研究进一步证实了GDM孕妇脂肪组织中胰岛素信号通路受损,对胰岛素的反应降低,导致胰岛素抵抗;同时也发现孕期体重过度增长的孕妇脂肪组织中的关键蛋白Akt、GLUT-4有着与GDM孕妇逐渐趋于一致的表现。笔者推测体重过度增长和GDM发生有着必然联系,孕期胰岛素敏感性的下降导致糖脂代谢紊乱,而代谢紊乱则进一步加重胰岛素抵抗,最终发展成为GDM。这将为加强孕期营养指导,防止体重过度增加提供理论依据,并对GDM的病因学研究和母体未来2型糖尿病的发生提供进一步的研究思路。
[1]Yang H, Wei Y, Gao X, et al. Risk factors for gestational diabetes mellitus in Chinese women: a prospective study of 16 286 pregnant women in China[J]. Diabet Med, 2009, 26(11): 1099-1104.
[2]JW Weeks, CA Major, M De Veciana, et al. Gestational diabetes:does the presence of risk factors influence perinatal outcome[J].Am J Obstet Gynecol, 1994, 171(4): 1003-1007.
[3]McMahon MJ, Ananth CV, Liston RM, et al. Gestational diabetes mellitus. Risk factors, obstetric complications and infant outcomes[J]. J Reprod Med, 1998, 43(4): 372-378.
[4]Colomiere M, Permezel M, Lappas M, et al. Diabetes and obesity during pregnancy alter insulin signaling and glucose transporter expression in maternal skeletal muscle and subcutaneous adipose tissue[J]. J Mol Endocrinol, 2010, 44(4): 213-223.
[5]Chen Y, Wang LW, Li L, et al. Insulin resistance and B cell function after delivery in gestational diabetes mellitus[J]. Chin J Pract Intern Med, 2011, 31(1): 42-44. [陈宇, 王立伟, 李玲, 等.妊娠糖尿病患者分娩后胰岛素抵抗和胰岛B细胞功能研究[J]. 中国实用内科杂志, 2011, 31(1): 42-44.]
[6]Ning M, Pang L, Xie W, et al. Blood glucose lowering effect of ophiopogonis tuber extract and mechanism of anti-insulinresistance[J]. Med J Chin PLA, 2014, 38(1): 26-28. [宁萌, 潘亮, 谢文利, 等. 麦冬提取物的降糖作用及其抗胰岛素抵抗的机制研究[J]. 解放军医学杂志, 2014, 38(1): 26-28]
[7]Hua SF, Han YH, Kuang DF, et al. The relationship between visfatin level and insulin resistant degree in gestational diabetic patients[J]. Tianjin Med J, 2011, 39(7): 577-579. [华绍芳, 韩玉环, 匡德凤. 妊娠期糖尿病患者内脏脂肪素水平与胰岛素抵抗的关系[J]. 天津医药, 2011, 39(7): 577-579.]
[8]Xing X, Gou WL. Obstetrics and gynecology[M]. 8th ed.Beijing: People's Medical Press, 2013. 75. [谢幸, 苟文丽. 妇产科学[M]. 8版, 北京: 人民卫生出版社, 2013. 75.]
[9]Zhang JF, Wu Y, Ouyang JP, et al. The effection of Astragalus polysaccharides to Akt and GLUT-4[J]. Chin J Endocrinol Metab, 2008, 10(24): 546-547. [张敬芳, 吴勇, 欧阳静萍,等.黄芪多糖降糖作用及其对蛋白激酶B和葡萄糖转运蛋白4的影响[J]. 中华内分泌代谢杂志, 2008, 10(24): 546-547].
[10]Colomiere M, Permezel M, Lappas M. Diabetes and obesity during pregnancy alter insulin signaling and glucose transporter expression in maternal skeletal muscle and subcutaneous adipose tissue[J]. J Mol Endocrinol, 2010, 44(4): 213-223.
[11]Lain KY, Catalano PM. Metabolic changes in pregnancy[J]. Clin Obstet Gynecol, 2007, 50(4): 938-948.
