样品制备过程对测定水中溶解态微囊藻毒素的影响
2014-11-05贾云璐周起超宋立荣
贾云璐 陈 伟 赵 爽 周起超 宋立荣
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉430072; 2. 中国科学院大学, 北京 100049)
淡水水体富营养化的加剧导致大量产毒蓝藻生长形成水华, 并威胁饮用水安全。水体中存在的蓝藻毒素种类很多, 以肝脏毒性著称的微囊藻毒素(MCs)是最为常见的毒素种类, 因危害性大, 受到的关注也最多[1—5]。
MCs可溶于水[6—8], 其中最主要一种异构体MC-LR[9]在水中的溶解度大于1 g/L。在水中, 蓝藻水华释放出的 MCs主要以溶解态的形式分布于水柱中, 少量被吸附到底泥或是悬浮物上形成颗粒态藻毒素[6]。测定水中溶解态藻毒素, 水样一般要经过膜过滤去除藻细胞及其他形式 MCs[4,7,10], 但是样品制备过程尚无标准操作程序可循。为了更准确地测定溶解态MCs浓度, 评估水中MCs的分布和潜在风险, 本文比较了几种常见膜过滤样品制备方法和常规离心法对溶解态藻毒素测定结果的影响。本研究将为进一步制定水体溶解态微囊藻毒素的风险评估标准方法提供一些方法学指导。
1 材料与方法
1.1 仪器、试剂和材料
Millipore超纯水仪, 高速低温离心机(德国eppendorf公司)。HPLC采用岛津LC-10A 高效液相色谱系统(日本岛津公司), 配备有 UV检测器和LC-10A数据系统。用于 HPLC分析的 MC-LR,MC-YR和MC-RR标准品购买自WAKO公司(日本),实验用纯毒素纯化参考陈伟等建立的方法[11], 并通过国内外三个实验室比对, 其纯度大于 99%, 可以作为标准品使用。实验中使用滤器和滤膜的规格和生产厂家等信息如表1所示。
模拟试验的原水水样采集于武汉市东湖, 经ELISA方法检测无藻毒素检出; 野外水华水样采集(2011年9月)于安徽省巢湖(Ch-W: N 31°41'47.4", E 117°21'44.8"; Ch-E: N 31°35'32.6", E 117°48'36.9")和江苏省太湖(Th-W: N 31°26'58.7", E 120°1'43.2";Th-N: N 31°24'39.2", E 120°11'14.3")。
1.2 HPLC (High Performance Liquid Chromatogram)法分析高浓度的微囊藻毒素样品
分析时所用色谱柱为岛津 ODS柱(4.6 mm×150 mm), 检测波长为238 nm, 流动相为60%甲醇,40%磷酸盐缓冲液(0.05 mol/L K2HPO4, pH=3), 流速为1.0 mL/min, 进样量为10 μL。
1.3 IC ELISA(anti-immune complex ELISA)酶联免疫法分析低浓度的微囊藻毒素样品
ELISA试剂盒及测定方法, 参照国标方法GB/T20466-2006。IISMCLR单克隆抗体包被96孔酶标板,4℃过夜, 0.5%明胶封阻, 37℃反应2h, 用PBS-T洗涤3次, 加入毒素标准品和样品100 mL, 37℃放置1h, 每孔继续加入 100 L生物毒化的单克隆抗体,室温放置 2h, PBS-T洗涤 3次, 以 1︰1000稀释HRP/Streptavidin (辣根酶标记链亲和素)加入每孔室温反应 2h, 加底物 TMBZ显色, 30min后, 以1 mol/L的H2SO4终止反应, 在450 nm波长测定吸光度A450, 绘制标准曲线, 计算样品MC的浓度。

表1 过滤膜的基本信息Tab. 1 Basic information of different filter membranes in this study
1.4 纯水加标回收实验
设置微囊藻毒素 MC-LR和 MC-RR浓度不同(0.005、0.025、0.1、0.25、0.5、1.25 μg/mL)处理组,5 mL体系, 经不同滤膜减压抽滤或滤器处理后, 取样1 mL置于1.5 mL棕色样品瓶中, 待检测。
1.5 原水加标回收实验
分别取原水水样(ELISA方法未检出藻毒素)5 mL, 加入 MC-LR和 MC-RR(浓度分别为 0.25、1.25 μg/mL), 按照1.4中的方法进行处理。
1.6 含高浓度蓝藻细胞样品预处理和测定
采集野外含有蓝藻细胞的水样1 L, 4℃保存待用。分别取100 mL水样, 采用上述滤膜法去除藻细胞, 滤液混匀后取适量待测。另外, 比较常规离心法(离心条件为8000、4000 r/min, 5min, 4℃)去除藻细胞效率, 并测定离心后水中MCs含量。以ELISA方法测定各组处理后MCs的含量。
2 结果
2.1 纯水内标法
不同滤膜和滤器过滤后回收率如图 1。在 6个浓度实验组中, PES针式过滤器前处理后回收率高于其他处理; 玻璃纤维滤膜(GF/C)回收率显著高于3种孔径0.45μm微孔滤膜。图 1中箭头所指为3种孔径0.45μm微孔滤膜处理后, 0.1μg/mL的处理组毒素浓度低于HPLC检出限。0.1μg/mL以下各组采用ELISA进行低浓度藻毒素含量分析。同样, PES针式小过滤器处理后, MCs的平均回收率在90%以上, GF/C处理后回收率在80%以上。然而其他3种膜处理法的平均回收率相对较低, 在50%左右。表2为不同膜吸附MCs的饱和吸附量, 数据显示, 每个PES针式过滤器和 GF/C滤膜的饱和吸附量低于1μg, 而其他3种滤膜吸附藻毒素的能力较强, 最高可达每张CA滤膜吸附279.1μg藻毒素。
2.2 原水内标法
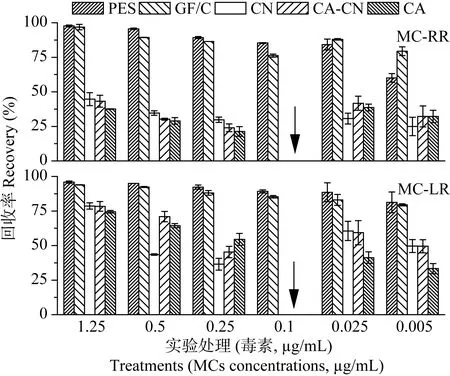
图1 纯水加入MCs后不同膜过滤处理的回收率Fig. 1 MCs recovery in Milli-Q water after pretreatments with different membranes
原水中存在大量有机质, 是否会干扰膜过滤法制备样品测得原水中微囊藻毒素含量?为了回答这一问题, 本研究在不含毒素原水中加入纯毒素, 过滤后检测, 并计算得MCs回收率如图2。结果与纯水加标回收法相近, 即高浓度毒素的各组处理方法回收率高于低浓度, 3种微孔滤膜(0.45 μm)减压过滤处理后的回收率显著低于玻璃纤维膜法和针式滤器处理后的各组。
2.3 蓝藻水华水样的预处理和ELISA测定
为了探究采用不同滤膜过滤法对含有野外含高浓度蓝藻细胞水样中溶解态藻毒素测定的影响, 本研究分别对取自我国太湖和巢湖的样品进行测定,并系统比较不同处理过程。首先, 采用同样的过滤膜法前处理水华水样, 测定各组滤液中MCs浓度见表3。可以得出, GF/C滤膜法和针式滤器处理组获得的结果较为相近, 而其他 3种膜过滤处理组皆未检出藻毒素。
此外, 通过藻细胞计数, 评估了不同转速离心去除水华水样中藻细胞的效率(表4), 并将离心上层液过滤(GF/C 过滤膜法)后, 测定滤液中 MCs含量(表3)。从表4中可以发现, 即使在离心转速为8000 r/min下, 也很难完全去除水华样品中藻细胞。同时, 表3中离心(过滤)组 MCs浓度皆高于其他组, 且较高的离心转速处理后测定的溶解态 MCs浓度高于低转速处理。因此, 即使是低转速离心处理, 藻细胞也有破裂的风险, 导致藻毒素释放。
3 讨论
膜过滤法在测定水中溶解态微囊藻毒素中, 不同材质的过滤膜对于微囊藻毒素的亲和力和吸附能力不同, 从而, 过滤膜材质选择至关重要。对于目前使用最为广泛的是玻璃纤维滤膜, 根据孔径不同,常见种类有 47 mm A/E 玻璃纤维滤膜(1.0 μm,Gelman Science)[12]、47 mm GF/C 玻璃纤维滤膜(1.2 μm, Whatman)[4,10,13,14]和孔径为 0.45 μm 的水系滤膜[15]。醋酸纤维滤膜也是一种常见的水系过滤膜, 如液相色谱中常用的 0.22 μm 醋酸纤维滤膜(cellulose-acetate, CA; Axiva, India)[16]。Moran, et al.比较了玻璃纤维滤膜、聚碳酸酯膜和混合纤维素膜在测定叶绿素 a和初级生产力中的性能差异, 指出玻璃纤维滤膜对于DO14C有较强的吸附能力, 使获得的POC偏高[17]。微囊藻毒素分子虽然是疏水性化合物, 以最常见的 3种结构体为例, 它们的logKow(表征疏水性的参数)分别为 MC-RR(4.4)、MC-LR(4.2)、MC-YR(3.9)。但是分子中含有的羧基和各种氨基酸使其又具有极性化合物的性质。微囊藻毒素可溶于水, 并常以水相存在, 所以MCs不易被水体中颗粒或碎屑吸附[6—8], 却可能被亲水性强的滤膜, 如各种纤维滤膜吸附。

表2 不同过滤膜的饱和吸附量a(微克/每张滤纸)Tab. 2 The adsorption capacity of different membranes (μg/sheet)

表3 野外水华水样过滤前后MCs含量变化(微克/升)Tab. 3 Changes in microcystins concentrations in water bloom samples before and after pretreatments with different methods (μg/L)
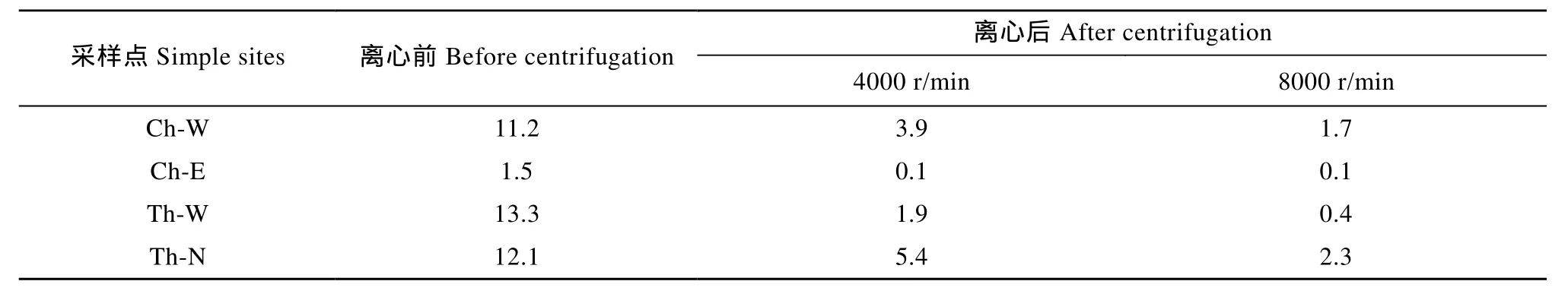
表4 离心前后藻类细胞密度(×10 cells/L)的变化Tab. 4 Algal cell density(×108 cells/L)before and after centrifugation
微囊藻毒素结构体多达 85种以上[16], Vasconcelos, et al.指出天然水华水体中大部分为 MC-LR(所占比例为45.5%—99.8%)[9], Marina Aboal, et al.也认为MC-LR为主要结构体, 其次为MC-RR[10]。2007年宋立荣等研究指出在中国太湖主要的微囊藻毒素结构体为 MC-RR、MC-LR和 MC-YR。其中MC-RR占 50%以上[1]。所以本研究选取我国自然水体中主要微囊藻毒素异构体MC-RR和 MC-LR作为研究对象。MC-RR分子具有两个精氨酸, 且分子量较其他结构体大, 导致这两种毒素异构体在经过同样的样品制备步骤后回收率存在一定差异, MC-RR的回收率更低, 例如实验中经醋酸纤维滤膜过滤处理后, 其平均回收率只有21%。
对于含有大量产毒藻细胞的水样, 若直接测定溶解态MCs的含量, 将会引起藻细胞破裂, 胞内藻毒素释放, 导致测定结果显著偏高。采用离心法去除藻细胞, 然后测定上清液中藻毒素浓度, 即为原水中溶解态藻毒素含量, 然而离心法并不能完全去除藻细胞, 反而可能导致产毒藻细胞裂解, 释放出胞内藻毒素, 导致溶解态藻毒素浓度上升, 无法正确反映原水中溶解态MCs含量。
总之, 样品制备过程对于测定水柱中溶解态微囊藻毒素非常重要, 不恰当的方法往往会使测得的结果偏低或者偏高, 导致过度低估或者高估溶解态微囊藻毒素的潜在风险。而采用PES或GF/C材质的滤膜过滤处理水样较好地去除藻细胞及其他颗粒态藻毒素, 同时避免在样品制备过程中藻毒素被滤膜吸附, 可以作为样品制备方法, 更准确地测定水体中溶解态藻毒素。
